草苁蓉多糖对过氧化氢致HL-7702细胞损伤的保护作用
2021-11-17金爱花常慧张钊葛乃嘉全吉淑尹学哲
金爱花,常慧,张钊,葛乃嘉,全吉淑*,尹学哲*
1(延边大学附属医院,吉林 延吉,133000)2(延边大学 医学院,吉林 延吉,133002)
肝损伤是指各种致病因素作用于肝组织而引起的肝细胞变性、坏死以及肝功能改变。活性氧(reactive oxygen species,ROS)自由基在不同形式的肝损伤过程中扮演了重要角色,而ROS引发的氧化应激是肝细胞损伤的重要因素,是包括肝损伤在内的多种肝脏疾病发生的病理基础。当肝细胞内ROS过剩时,其引发的氧化应激容易使细胞内脂质、核酸、蛋白质等生物分子发生改变,导致肝细胞结构和功能的损伤,最终诱发肝细胞死亡[1-2]。H2O2是一类小分子活性氧,易溶于水和穿透细胞膜,是常见的细胞氧化损伤剂[3];其能够诱导肝细胞DNA损伤,导致受损基因表达发生改变,同时还可诱发细胞内蛋白质和脂质损伤[4]。当肝细胞损伤较轻时不仅不会造成肝细胞死亡,在抗氧化剂作用下肝细胞的这些损伤还有可能被修复[4-5]。草苁蓉多糖(Boschniakiarossicapolysaccharides,BRP)是草苁蓉全草中最为丰富的重要活性成分,无毒,具有较强的抗氧化及免疫调节活性,在多种疾病的防治中发挥重要作用[6-8]。课题组研究发现,BRP对HepG2细胞氧化应激损伤具有抑制作用,且抑制HepG2细胞核转录因子-κB(nuclear factor-κB,NF-κB)的激活[9]。HepG2细胞虽具有肝实质细胞的部分特征,但毕竟是肝癌细胞,其生长规律和生物学功能与正常肝细胞可能有些差异[10-11]。因此,有可能不能完整体现正常肝实质细胞受到损伤时的实际情况。HL-7702细胞,又称L02细胞,是永生化的人正常肝细胞,可连续传代,并在多次传代中仍能保持正常肝实质细胞原有生化和生理特征,是体外肝细胞研究的理想细胞系,常用于肝细胞毒性的细胞学研究中[12-13]。
本研究以H2O2为诱导剂,HL-7702人正常肝细胞株为研究对象,建立肝细胞氧化应激损伤模型,分别从增殖、凋亡以及相关信号通路等方面,探讨BRP对H2O2诱导的HL-7702细胞损伤的保护作用以及相关作用机制,为其在保肝方面的应用提供科学依据。
1 试验材料
1.1 细胞株与试剂
BRP,由延边大学医学院生物化学与分子生物学教研室制备,多糖含量为97.4%,主要为分子质量为4.9×104Da的中性多糖[6]。HL-7702细胞株,江苏凯基生物技术股份有限公司;DMEM高糖培养基、胎牛血清,以色列BI公司;胰蛋白酶,美国西格玛公司;CCK-8试剂盒,北京庄盟国际生物基因科技有限公司;乳酸脱氢酶(lactate dehydrogenase,LDH)测试盒、丙二醛(malondialdelyde,MDA)测试盒,南京建成生物科技有限公司;Hoechst33342染色液、原位末端标记(TdT-mediated dUTP nick end labeling,TUNEL)细胞凋亡测试盒,上海碧云天生物技术有限公司;小鼠p53、多聚ADP核糖聚合酶[poly(ADP-ribose)polymerase,PARP]、细胞外信号调节蛋白激酶(extracellular signal-regulated kinase,ERK)抗体以及兔Bcl-2、Bax、Bak、细胞色素c(cytochrome c,Cyto c)、Caspase-3、c-Jun N末端激酶(c-Jun N-terminal kinase,JNK)、p-JNK、p38丝裂原活化蛋白激酶(p38 mitogen-activated protein kinase,p38)、p-p38、p-ERK、NF-κB抗体,美国赛信通公司;兔β-actin抗体、兔抗小鼠二抗、山羊抗兔二抗,美国西格玛公司。
1.2 仪器与设备
CO2细胞培养箱,美国Shellab公司;超声波细胞粉碎机,宁波新芝生物科技有限公司;酶标分析仪,深圳雷杜公司;冷冻离心机,德国艾本德公司;垂直板电泳仪、转印槽,美国伯乐公司;全自动化学成像分析系统,上海培清科技有限公司。
2 实验方法
2.1 BRP无菌液的配制
将BRP用无血清的DMEM培养基配成质量浓度为400 mg/L的储液,过滤除菌,贮于4 ℃备用。
2.2 HL-7702细胞的培养及传代
HL-7702细胞用DMEM培养基(含10%胎牛血清、100 μg/mL链霉素、100 U/mL青霉素)在体积分数5% CO2、饱和湿度条件下常规培养[9,13]。待HL-7702细胞达到80%以上融合度时,用胰酶消化并传代[9,13]。
2.3 BRP安全剂量的选定
取HL-7702细胞接种于96孔板中,每孔接种密度为2×105个/mL[9,13]。放置24 h待HL-7702细胞贴壁后,换成含BRP培养液,使BRP质量浓度分别为0、25、50、100、200和400 mg/L,继续培养12 h。用CCK-8测试盒测定HL-7702细胞存活率,以细胞存活率≥95%为BRP安全使用剂量[14]。每组设6个复孔,实验重复3次。

(1)
2.4 H2O2诱导的HL-7702细胞氧化损伤模型的建立
取HL-7702细胞接种于96孔板中,每孔接种密度为2×105个/mL[9,13]。培养24 h待HL-7702细胞贴壁。换入含H2O2(摩尔浓度分别为75、150、300、600和1 200 μmol/L)的无血清培养液,继续培养6 h[9,13]。按测试盒操作步骤和方法,用CCK-8法检测HL-7702细胞存活率。每组设6个复孔,实验重复3次。
2.5 BRP对H2O2诱导HL-7702细胞氧化损伤的影响
取HL-7702细胞接种于96孔板中,每孔接种密度为2×105个/mL[9,13]。培养24 h待HL-7702细胞贴壁。随机分为正常组、模型组、BRP低剂量组和高剂量组(分别为BRP50组和BRP100组)。模型组HL-7702细胞先常规培养24 h待细胞贴壁后,于无血清培养液中培养12 h,加H2O2使其终摩尔浓度为300 μmol/L,继续培养6 h;BRP低剂量组和高剂量组HL-7702细胞常规培养24 h,分别用含50和100 mg/L BRP的无血清培养液继续培养12 h,再用终摩尔浓度为300 μmol/L的H2O2损伤6 h;正常组则常规培养24 h,用无血清培养液继续培养12 h,再换无血清培养液培养6 h[9,13]。按测试盒操作步骤和方法,用CCK-8法检测HL-7702细胞存活率,用微板法检测细胞及培养液中LDH活性并计算LDH释放率[13]。每组设6个复孔,实验重复3次。
(2)
2.6 BRP对H2O2诱导HL-7702细胞MDA水平的影响
取HL-7702细胞接种于6孔板中,分组和处理同2.5。按测试盒操作步骤和方法,用硫代巴比妥酸法检测细胞中MDA生成量[13,15]。
2.7 BRP对H2O2诱导HL-7702细胞凋亡的影响
细胞凋亡的观察采用Hoechst33342染色法及TUNEL染色法。取HL-7702细胞接种于6孔板中,分组和处理同2.5。细胞固定,分别加Hoechst33342染色液及TUNEL工作液孵育,封片后在荧光显微镜下观察染色结果[16]。
2.8 BRP对H2O2诱导HL-7702细胞凋亡相关蛋白表达的影响
取HL-7702细胞接种于100 mm培养皿中,分组和处理同2.5。分别提取细胞总蛋白、胞浆及核蛋白,并在SDS-PAGE上进行电泳、分离蛋白质,并转移到PVDF膜上,封闭,敷一抗、二抗,ECL显色,采集图像并进行灰度分析[9,15]。
2.9 数据分析

3 结果与分析
3.1 BRP安全使用剂量的确定
为了研究BRP剂量对HL-7702细胞生长的影响,并确定BRP的安全使用剂量,观察了不同质量浓度BRP处理HL-7702细胞时细胞存活率的变化,结果如图1所示。当BRP质量浓度在25~100 mg/L时,HL-7702细胞存活率均高于95%,对细胞生长的影响不明显,可视为无显著细胞毒性;而当BRP质量浓度在200~400 mg/L时,HL-7702细胞存活率低于95%,具有细胞毒性作用。因此,本实验选定50和100 mg/L为后续研究中BRP干预的安全剂量。
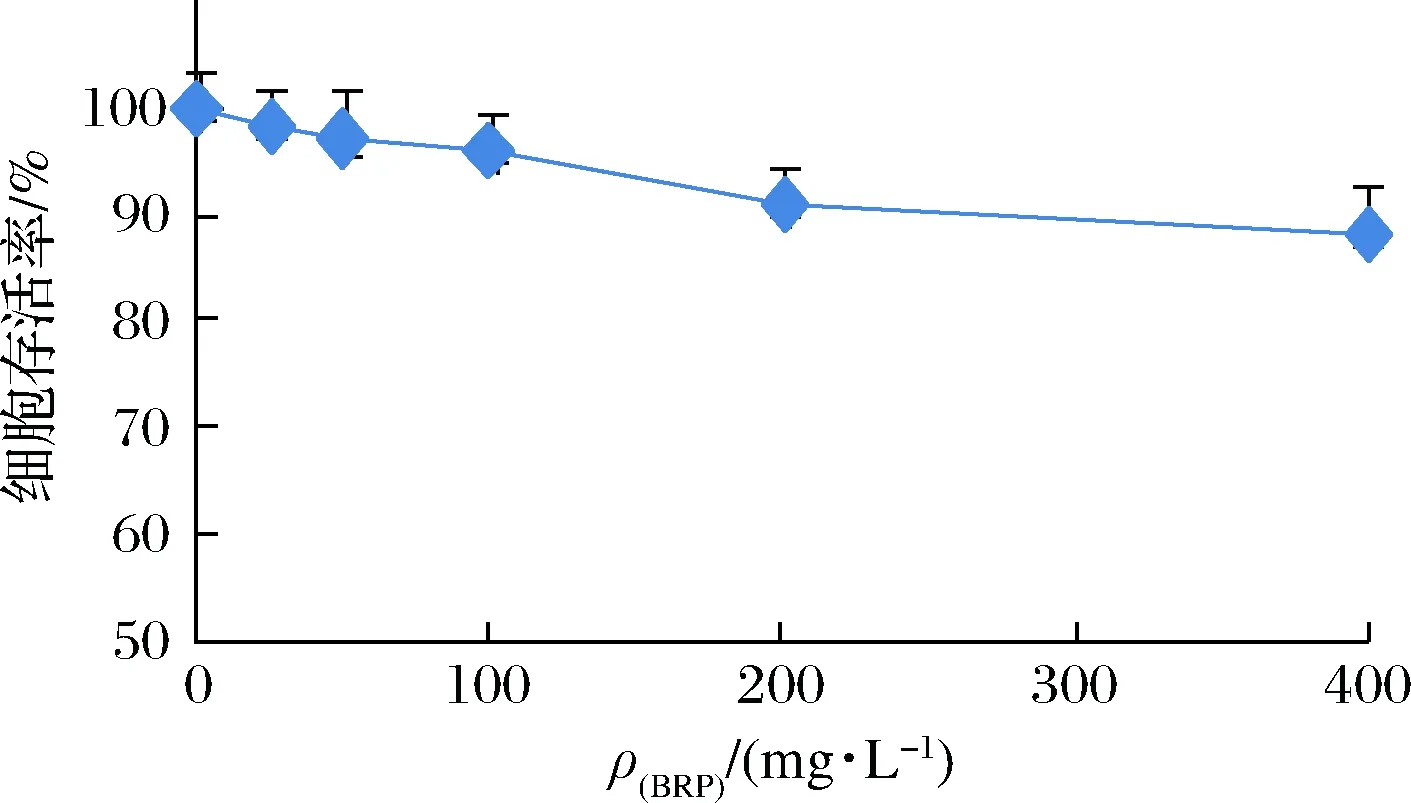
图1 BRP对HL-7702细胞存活率的影响Fig.1 Effect of BRP on viabilities of HL-7702 cells
3.2 H2O2损伤浓度的确定
H2O2诱导的氧化应激是肝细胞损伤的主要机制之一,可使肝细胞生成过量ROS,造成肝细胞损伤甚至死亡[13,15]。为了研究H2O2抑制HL-7702细胞生长的作用规律,找出诱导HL-7702细胞损伤的最佳使用剂量,观察了不同质量浓度H2O2处理HL-7702细胞时该细胞存活率的变化,结果如图2所示。H2O2可显著降低HL-7702细胞存活率,当H2O2质量浓度为300 μmol/L时,HL-7702细胞存活率约为42%,接近半数抑制率。因此,在后续的研究中,模型制备条件选定为300 μmol/L H2O2处理HL-7702细胞6 h。

图2 H2O2对HL-7702细胞存活率的影响Fig.2 Effect of H2O2 concentration on viabilities of HL-7702 cells
3.3 BRP对H2O2诱导的HL-7702细胞存活率影响
BRP对H2O2诱导的HL-7702细胞存活率的影响如图3所示。BRP能够提高H2O2损伤的HL-7702细胞存活率(P<0.05),当BRP质量浓度分别为50和100 mg/L时,HL-7702细胞存活率为80.3%和84.9%(P<0.05),比模型组增高26.2%和30.8%。但BRP低剂量组和高剂量组间差异却无统计学意义(P>0.05)。

图3 BRP对H2O2诱导的HL-7702细胞存活率的影响Fig.3 Effect of BRP on cell viabilities of H2O2-induced HL-7702 cells注:与正常组比较,#P<0.05;与模型组比较,*P<0.05(下同)
3.4 BRP对H2O2诱导的HL-7702细胞LDH释放的影响
细胞损伤或死亡过程中,肝细胞内的重要胞内酶如LDH,可释放到细胞培养液中,造成培养液中LDH活性增高,因此可以由培养液中的LDH释放率评价细胞受损或死亡程度[17]。BRP对HL-7702细胞培养液中LDH释放率的影响如图4所示。BRP能够降低H2O2诱导的HL-7702细胞培养液中LDH的释放(P<0.05),当BRP质量浓度为50和100 mg/L时,培养液中LDH释放率比模型组分别降低26.9%和32.8%,表明BRP能够有效保护HL-7702细胞膜完整性。但BRP不同剂量组间的差异却无统计学意义(P>0.05)。

图4 BRP对H2O2诱导的HL-7702细胞LDH 释放的影响Fig.4 Effect of BRP on LDH release of H2O2-induced HL-7702 cells
3.5 BRP对H2O2诱导的HL-7702细胞MDA生成的影响
用H2O2损伤肝细胞可使肝细胞内产生大量ROS,并引发细胞膜脂质的过氧化反应,细胞内生成的MDA增多[18]。BRP对H2O2损伤的HL-7702细胞MDA水平的影响如图5所示。BRP能够降低H2O2诱导的HL-7702细胞MDA的生成(P<0.05),当BRP质量浓度为50和100 mg/L时,MDA生成量与模型组比较分别降低0.32和0.43 μmol/μg,提示BRP预处理可降低HL-7702细胞氧化应激水平。但BRP不同剂量组间的差异却无统计学意义(P>0.05)。
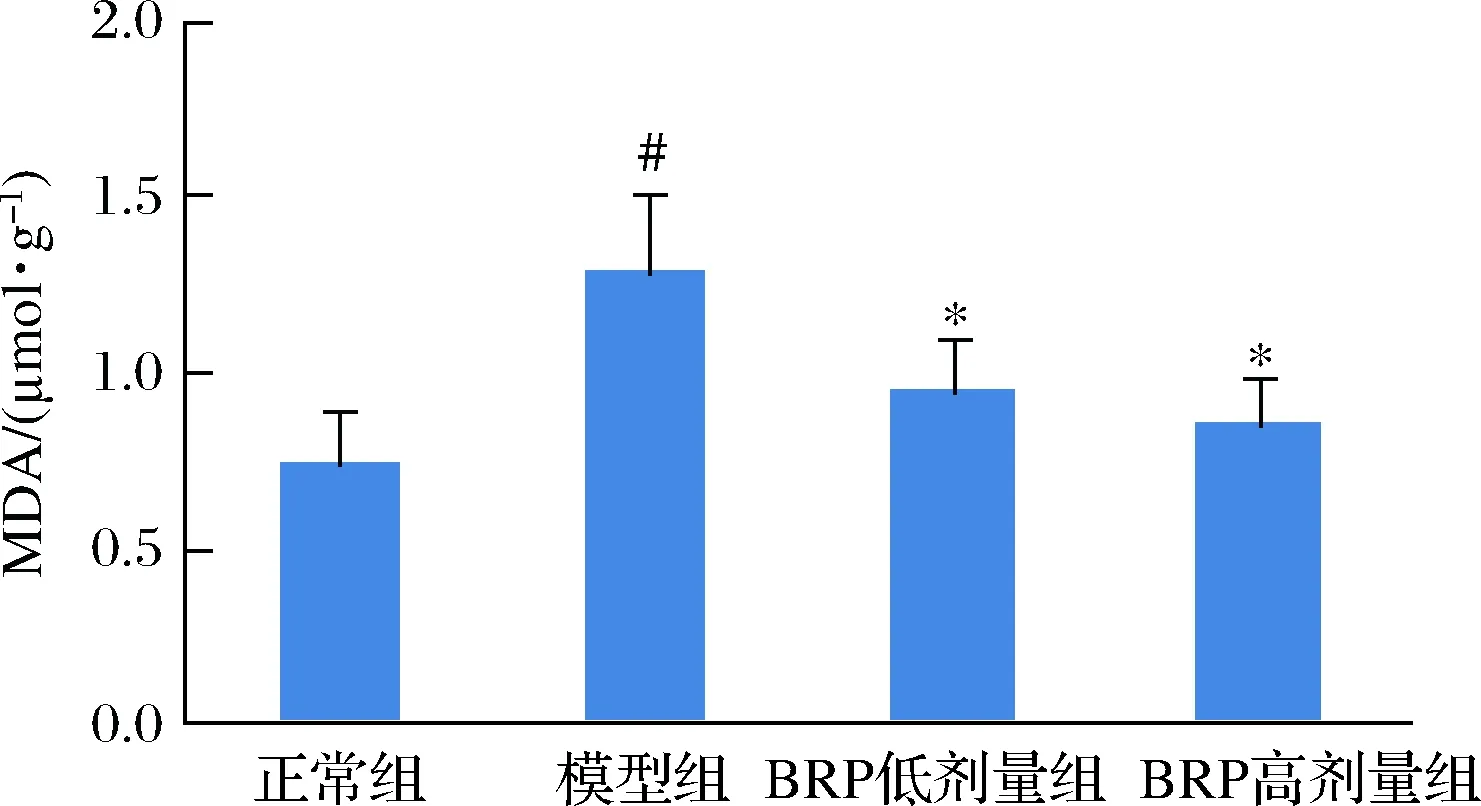
图5 BRP对H2O2诱导的HL-7702细胞MDA水平的影响Fig.5 Effect of BRP on MDA levels in H2O2-induced HL-7702 cells
3.6 BRP对HL-7702细胞Hoechst33342染色的影响
Hoechst染料是一种可穿过细胞膜的细胞核复染剂,与DNA结合后发出蓝色荧光,常用于细胞凋亡检测,以分辨凋亡细胞中固缩的细胞核[19]。Hoechst33342可使正常细胞核染上较浅的蓝色荧光,而细胞发生凋亡时,其荧光强度会变强[20]。BRP对H2O2诱导的HL-7702细胞Hoechst33342染色的影响如图6所示。正常组HL-7702细胞核染色均匀且较浅;与正常组比较,模型组HL-7702细胞核荧光染色增强,部分细胞核出现核固缩,这与前人报道一致[21];与模型组比较,BRP组HL-7702细胞核荧光染色减弱,凋亡细胞减少。
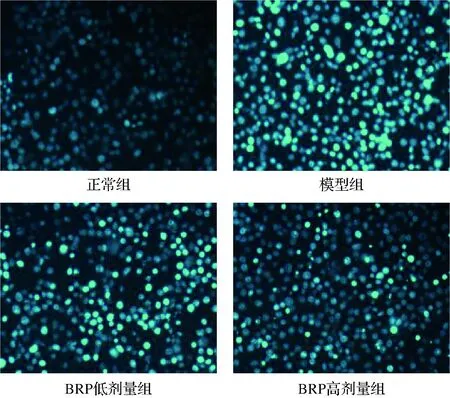
图6 BRP对HL-7702细胞Hoechst33342染色的 影响(×100)Fig.6 Effect of BRP on Hoechst33342 staining of HL-7702 cells (×100)
3.7 BRP对H2O2诱导的HL-7702细胞凋亡的影响
TUNEL法为细胞凋亡检测的“金标准”,可使凋亡细胞中断裂DNA 3′-OH末端的被荧光素标记的脱氧尿苷酸发出绿色荧光[22]。BRP对H2O2诱导的HL-7702细胞凋亡的影响如图7所示。与正常组比较,模型组发出绿色荧光的凋亡细胞明显增多;与模型组比较,BRP组凋亡的HL-7702细胞明显减少,提示BRP预处理可抑制H2O2诱导的HL-7702细胞的凋亡。

图7 BRP对H2O2诱导的HL-7702细胞凋亡的 影响(×100)Fig.7 Effect of BRP on apoptosis of H2O2-induced HL-7702 cells (×100)
3.8 BRP对H2O2诱导的HL-7702细胞凋亡相关蛋白表达的影响
不同剂量BRP对损伤HL-7702细胞的保护作用,从细胞毒性、氧化应激以及细胞凋亡等多个指标上均不显示显著性差异,但在趋势上高剂量组比低剂量组有优势,因此在后续的机制研究中,选100 mg/L为BRP干预剂量。BRP对H2O2诱导HL-7702细胞凋亡相关蛋白表达的影响如图8所示。与正常组比较,模型组HL-7702细胞浆Cyto c水平升高,细胞p53、Bak、Bax等促凋亡蛋白的表达上调(P<0.05),抗凋亡蛋白Bcl-2表达下调(P<0.05),C-casp3及C-PARP水平升高(P<0.05);与模型组比较,BRP组HL-7702细胞浆Cyto c水平降低(P<0.05),促凋亡蛋白p53、Bak、Bax表达下调(P<0.05),抗凋亡蛋白Bcl-2表达上调(P<0.05),C-casp3和C-PARP水平下降(P<0.05)。提示,BRP可能通过降低促凋亡蛋白和抗凋亡蛋白的比值而抑制H2O2诱导的肝细胞凋亡。

a-蛋白印迹结果;b-灰度比值结果图8 BRP对HL-7702细胞凋亡相关蛋白表达的影响Fig.8 Effect of BRP on expression of apoptosis-related proteins in HL-7702 cells
3.9 BRP对H2O2诱导的HL-7702细胞MAPK、NF-κB活化的影响
ROS能够引起MAPK、NF-κB通路的激活[20]。BRP对H2O2诱导HL-7702细胞MAPK、NF-κB活化的影响如图9所示。H2O2对HL-7702细胞ERK、JNK、p38、NF-κB总蛋白表达以及p38磷酸化无显著影响(P>0.05),但上调HL-7702细胞ERK、JNK磷酸化以及NF-κB p65核转移(P<0.05);而BRP显著降低ERK、JNK磷酸化水平以及NF-κB p65核转移水平(P<0.05)。提示,BRP可能是通过ERK、JNK及NF-κB通路来调控凋亡相关蛋白的表达,从而抑制H2O2致肝细胞凋亡的。

a-蛋白印迹结果;b-灰度比值结果图9 BRP对HL-7702细胞MAPK、NF-κB激活的影响Fig.9 Effect of BRP on activation of MAPK and NF-κB in HL-7702 cells
4 结论与讨论
肝细胞损伤是多种肝病的共同病理基础,而ROS引发的氧化应激是造成肝细胞损伤的重要机制[4]。H2O2是实验室常见的氧化应激损伤剂,极易透过细胞膜对肝细胞造成损伤、甚至死亡[3-4]。本研究H2O2诱导的HL-7702细胞损伤入手,运用现代分子生物学与分子药理学方法,探讨BRP对肝细胞氧化应激损伤的保护作用。结果表明,H2O2能够降低HL-7702细胞存活率、升高LDH释放率、升高细胞MDA水平,提示HL-7702细胞氧化损伤模型构建成功。而安全剂量的BRP预处理HL-7702细胞后,BRP组HL-7702细胞存活率与模型组比较显著增高,LDH释放率和细胞MDA生成量显著下降,细胞凋亡程度显著减少,表明BRP能够保护H2O2诱导的HL-7702细胞损伤,抑制细胞凋亡。
线粒体是细胞内最易受ROS攻击的目标之一,因此在H2O2诱导的肝细胞凋亡中处于重要地位[23]。而Bcl-2家族在线粒体途径细胞凋亡的发生中起着核心作用[24]。目前,Bcl-2家族蛋白中研究最多的主要有2种,一种是促凋亡蛋白,如Bak、Bax等,另外就是抗凋亡蛋白,如Bcl-2、Bcl-xL等,二者之间比例决定着损伤细胞走向生存或者死亡[24]。促凋亡蛋白和抗凋亡蛋白的比值增高则造成线粒体膜电位降低,促进Cyto c从线粒体释放入胞质,继而激活下游的Caspase家族,形成Caspase 3活化片段#C-casp3,导致一系列凋亡特征性形态变化和生化改变,并切割其特异性底物PARP形成C-PARP,最终导致细胞凋亡[24-25]。而p53能介导DNA损伤后的细胞应激反应,若损伤DNA修复失败可与其他凋亡蛋白协同诱导细胞凋亡的发生[26]。研究表明,BRP预处理能够降低HL-7702细胞浆Cyto c水平,下调促凋亡蛋白p53、Bak、Bax表达,上调抗凋亡蛋白Bcl-2表达,降低C-casp3和C-PARP水平。提示,BRP可能是通过调控p53以及Bcl-2家族蛋白来抑制H2O2致HL-7702细胞凋亡的。MAPK是肝细胞内促细胞增殖和传递应激信号的关键激酶,主要包括ERK、JNK、p38等3条途径,分别调控细胞生存、凋亡以及炎症等,且协同和拮抗共存,三者与肝细胞凋亡的发生均有着密切相关性,在上游活化子以及下游靶点之间存在着交叉和重叠[27]。NF-κB是近期研究较多的转录因子,调控多种与炎症相关细胞因子的转录,在肝损伤的发生发展中也起重要作用[28]。因此,MAPK、NF-κB通路与肝细胞氧化应激损伤的关系一直是肝疾的研究热点[27-29]。本研究表明,BRP预处理能够降低ERK、JNK磷酸化以及NF-κB p65核转移水平。提示,BRP可能是通过ERK、JNK以及NF-κB通路调控凋亡相关蛋白的表达从而抑制H2O2致HL-7702细胞凋亡的。综上所述,BRP能够有效保护H2O2诱导的HL-7702细胞损伤,并抑制细胞凋亡,此作用可能与BRP对ERK、JNK、NF-κB通路的调控有关。此外,NF-κB通路又是与炎症密切相关的重要信号通路。BRP能否通过NF-κB通路影响肝细胞以及巨噬细胞的炎症反应仍需进一步研究。
