太子参提取物抗氧化能力的比较研究
2021-11-17孔钰婷何洪安凤平林余鹏宋洪波黄群
孔钰婷,何洪,安凤平,2*,林余鹏,宋洪波,2,黄群,2
(1.福建农林大学食品科学学院,福建 福州 350002;2.福建省特种淀粉品质科学与加工技术重点实验室,福建 福州 350002)
太子参为石竹科植物孩儿参的干燥块根,在福建、山东、江苏、安徽、贵州等地均有种植。太子参已列入可用于保健食品的名单中,具有益气健脾、生津润肺的功效,广泛用于治疗各种疾病,如心绞痛、糖尿病、肺燥干咳等[1-3]。太子参的功能性研究成为关注的热点。有研究表明,太子参水提物和醇提物都具有很好的抗氧化活性,能清除·OH,提高超氧化物歧化酶和谷胱甘肽过氧化物酶的活力。试验还表明,太子参醇提取物的抗脂质过氧化活性强于水提取物[3]。但太子参醇提取方法以及提取物组成与抗氧化能力的关系尚不明晰。
本研究以柘荣太子参为原料,探究不同浓度乙醇的提取物抗氧化能力,进而对比研究初步纯化对提取物组成和抗氧化能力的影响,通过体外模拟消化考察组分稳定性并评价其抗氧化能力,为利用太子参开发抗氧化功能食品提供依据。
1 材料与方法
1.1 材料与试剂
柘荣太子参:福建咸康药业有限公司,粉碎后过40目筛备用。
VC(分析纯):国药集团化学试剂有限公司;人参皂苷Rb1标准品(色谱纯):安徽西青果生物科技有限公司;芦丁(分析纯)、葡萄糖(分析纯):北京索莱宝科技有限公司;香草醛(分析纯)、ABTS(分析纯):阿拉丁试剂(上海)有限公司;DPPH(分析纯)、胃蛋白酶(30 000 U/mg)、胰蛋白酶(2 500 U/mg)、猪胆盐(胆酸含量≥60%):上海源叶生物科技有限公司;D101大孔树脂(分析纯):艾美科健(中国)生物医药有限公司。
1.2 仪器与设备
UV-1780紫外分光光度计、Nexera UHPLC LC-30A超高效液相色谱仪:日本岛津公司;HH-2数显恒温水浴锅:常州国华电器有限公司;N-1100旋转蒸发仪、FDU-1200冷冻干燥机:上海爱朗仪器有限公司;MS 3涡旋振荡器:德国IKA公司;Heraeus Fresco17离心机:美国Thermo Fisher Scientific公司;SpectraMax PLUS酶标仪:美国Molecular Devices公司;Triple TOF 5600高分辨质谱仪:美国AB Sciex公司;ACQUITY UPLC BEH色谱柱:美国Waters公司。
1.3 方法
1.3.1 太子参提取物的制备
分别以0%、30%、50%、70%、90%乙醇为溶剂,将太子参粉按料液比为1∶8(g/mL),以60℃回流提取2次,每次1 h,合并两次滤液于50℃旋蒸浓缩至1/4,冷冻干燥得粉末,为粗提物,分别命名为T0、T30、T50、T70和T90。
将30%乙醇提取并浓缩的液体用石油醚萃取后旋蒸去除石油醚,用水补足体积,稀释8倍过滤后上大孔树脂D101,水洗至Molish反应至阴性,用30%、50%、70%、90%乙醇梯度洗脱,收集洗脱液减压浓缩,冷冻干燥得粉末,为初步纯化物(洗脱物),分别命名为X30、X50、X70 和 X90。
1.3.2 总糖、黄酮和皂苷含量的测定
1.3.2.1 总糖含量的测定
采用苯酚-浓硫酸法[4]。取1 mL样品溶液,加5%苯酚1 mL,混匀后加5 mL浓硫酸,混匀,室温(26℃)避光反应30 min后于490 nm处测定吸光度。以葡萄糖为标品,绘制标准曲线。
1.3.2.2 黄酮含量的测定
参考Pitura等[5]的方法测定。取0.5 mL样品溶液于10 mL容量瓶中,加入1.5 mL蒸馏水稀释,加入5% NaNO20.3 mL后混匀,室温(26℃)放置 5 min,加入0.6 mL 10% AlCl3溶液。6 min后加入2 mL的1 mol/L NaOH溶液,加蒸馏水至刻度,混匀后于510 nm处测定吸光度。以芦丁为标准品,绘制标准曲线。
1.3.2.3 皂苷含量的测定
取适量样品溶液于10 mL具塞试管中,60℃水浴挥干溶剂,加入0.2 mL 5%香草醛-冰醋酸溶液,0.8 mL高氯酸,混匀,水浴加热15 min后冰水浴冷却,加入5 mL冰醋酸,摇匀,于560 nm波长处测定吸光度。以人参皂苷Rb1为标准品,绘制标准曲线[6]。
1.3.3 抗氧化能力的测定
1.3.3.1 DPPH自由基清除能力
在 20 μL样品溶液中加入 180 μL DPPH溶液(0.1 mmol/L),振荡混匀后室温(26℃)下避光反应30 min,用酶标仪于517 nm处测吸光度。同时采用VC作为阳性对照,清除率计算见公式(1)[7]。

式中:A0为空白对照的吸光度;A1为样品与DPPH反应后的吸光度;A01为样品自身的吸光度。
1.3.3.2 ABTS+自由基清除能力
参考Thaipong等[8]的方法,20mL7mmol/L的ABTS+溶液与350 μL 140 mmol/L的过硫酸钾溶液混合,于室温(26℃)下避光反应14 h,制成ABTS+储备液,用时将该储备液稀释至734 nm处吸光度为(0.7±0.005)。在20 μL不同浓度的样品溶液中加入 180 μL ABTS+溶液,混匀后避光反应10 min,用酶标仪在734 nm处测定其吸光度,采用VC作为阳性对照。清除率计算见公式(2)。

式中:A0为空白对照的吸光度;A1为样品与ABTS+溶液反应后的吸光度;A01为样品自身的吸光度。
1.3.3.3 羟自由基清除能力
在2 mL不同浓度的样品溶液中依次加入0.6 mL的6 mmol/L FeSO4溶液和0.6 mL的6 mmol/L H2O2溶液,混匀静置反应10 min后加入0.6 mL的6 mmol/L水杨酸,摇匀静置10min,于510nm波长处测定其吸光度。采用VC作为阳性对照,清除率计算见公式(3)[9]。

式中:A0为空白样品的吸光度;A1为样品与自由基反应后的吸光度;A2为无水乙醇代替水杨酸时的吸光度。
1.3.3.4 铁离子抗氧化能力测定
配制铁离子抗氧化能力(ferricionreducingantioxidant power,FRAP)工作液[300 mmol/L,pH3.6 的醋酸盐缓冲溶液,10 mmol/L三吡啶基三嗪(tripyridyltriazine,TPTZ]溶液和 20 mmol/L FeCl3溶液按体积比 10∶1∶1混合),取12 μL样品与188 μL FRAP工作液混合,反应10 min后于593 nm下测定吸光度。以FeSO4为标准的回归方程计算样品的抗氧化能力,1 mmol/L FeSO4为1个FRAP值[10]。
1.3.4 体外模拟消化
体外模拟消化包括胃消化和肠消化。参照Minekus等[11]的方法配制胃液和肠液,胃液含有25 000 U/mL的猪胃蛋白酶,肠液中包含800 U/mL的胰蛋白酶和胆盐。
体外模拟胃消化是将100 mg样品加入至20 mL胃液中,置于37℃恒温摇床,100 r/min消化2 h,分别在 0.5、1.0、1.5、2.0 h 取样 5 mL,4 ℃、10 000 r/min 离心10 min,取上清液用于成分和抗氧化能力检测。
将经胃液消化的样品添加至20 mL肠液中,于恒温振荡器37℃、100 r/min 消化 2 h,分别在 0.5、1.0、1.5、2.0 h取样5 mL,4℃、1 000 r/min离心10 min,取上清液用于成分及抗氧化能力检测。
1.3.5 超高效液相色谱-串联四极杆飞行时间质谱物质鉴定
称取50mgX30,加入500 μL含有内标的甲醇溶液(80%甲醇,内标浓度 2 μg/mL),匀浆 4 min,冰水浴超声处理1 h,-20℃静置1 h;将样本以4℃、12 000 r/min离心10 min,取出上清液过0.22 μm滤膜后于2 mL进样瓶中上机检测。
使用Waters的UPLC BEH C18色谱柱(1.7 μm×2.1 mm×100 mm),进样体积为 5 μL,流速 0.4 mL/min。
利用质谱仪进行质谱分析,在软件(Analyst TF 1.7,AB Sciex)控制下基于信息关联数据采集(data independent acquisition,IDA)功能进行一级、二级质谱数据采集。使用Progenesis QI软件将质谱原始数据导入,对含有MS/MS数据的峰进行物质鉴定。
1.3.6 数据处理
利用DPS 7.5软件进行统计分析,3次重复测定结果以平均值±标准差表示。采用单因素方差分析并用最小显著性差异法(least significant difference,LSD)法进行多重比较。
2 结果与分析
2.1 体外抗氧化能力
2.1.1 粗提物体外抗氧化能力比较
粗提物体外抗氧化能力的比较结果详见图1。
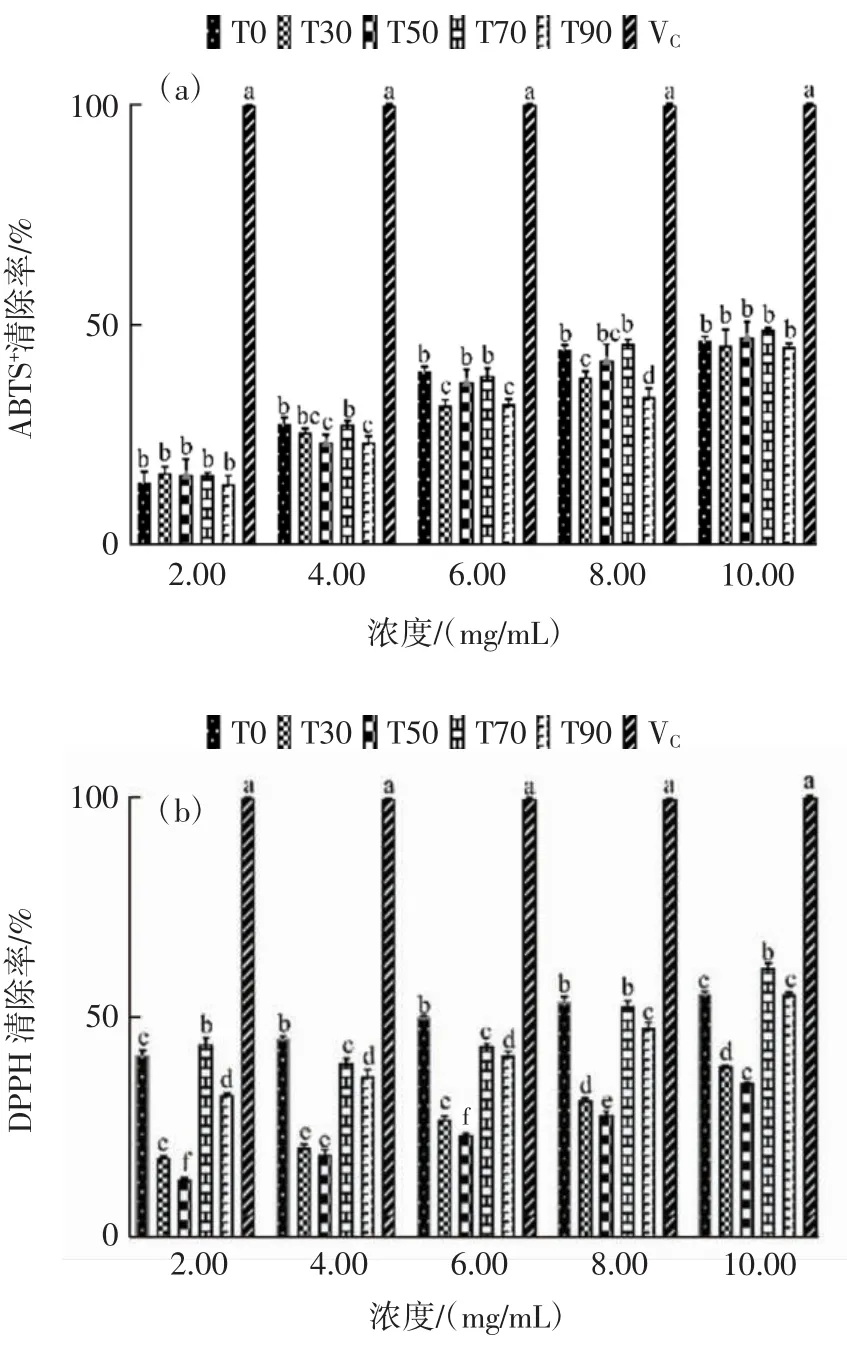

图1 太子参粗提物体外抗氧化能力比较Fig.1 In vitro antioxidant capacity of the Radix pseudostellariae extracts
由图1可知,太子参粗提物的抗氧化活性随其浓度增加而增强。从图1(a)和图1(b)可以看出,粗提物清除DPPH自由基和ABTS+自由基的效果均较VC弱;图1(c)表明粗提物对羟自由基具有较好的清除能力,有文献报道太子参水提物在动物体内对羟自由基具有良好清除作用[12];当浓度达到6 mg/mL时,除T90外,其余各粗提物对羟基自由基清除能力与VC相当,T90清除羟基自由基能力有所降低,原因可能是乙醇浓度过高会增加脂溶性物质的溶出[13],该类物质对羟基自由基清除贡献较小。图1(d)的结果表明相同浓度时,T70的FRAP值最高,说明T70对铁离子还原能力强于其它粗提物。
综合各项抗氧化指标评价结果,各粗提物中T70表现出最强的抗氧化能力,因此采用T70过柱洗脱进一步研究抗氧化能力。
2.1.2 洗脱物体外抗氧化能力比较
各级洗脱物的体外抗氧化能力比较结果见图2。

图2 洗脱物体外抗氧化能力比较Fig.2 In vitro antioxidant capacity of the ethanol elutions
从图2可以看出经大孔树脂D101吸附后,乙醇梯度洗脱的各级洗脱物抗氧化能力均随着浓度的增加而增强;相同浓度时,各级洗脱物抗氧化能力依次递减,即 X30>X50>X70>X90。在图 2(a)~图 2(c)中,X30浓度大于4 mg/mL时,清除ABTS+·、DPPH·和羟基自由基能力与VC差异不显著,说明抗氧化效果与VC相当。从图2(d)可以看出,尽管X30对铁离子还原能力显著低于VC,但显著好于其它洗脱物。综合而言,各级洗脱物中X30的抗氧化能力最强。
2.2 主要活性成分测定
太子参粗提物和洗脱物中主要活性物质含量见表1。

表1 太子参粗提物和洗脱物中总糖、皂苷、黄酮含量对比Table1 Comparison of total sugar,saponin and flavonoids in the extracts and the elutions of Radix pseudostellariae
如表1所示,不同浓度乙醇提取的太子参粗提物中总糖、皂苷和黄酮含量存在较大差异,其中糖类物质更容易被低浓度(30%)乙醇溶剂提取出来,70%乙醇更有利于皂苷和黄酮的溶出,进一步增加乙醇浓度则不利于皂苷和黄酮的溶出,说明主要成分的溶解性和选择性与乙醇浓度有关。
由T70过大孔树脂柱后不同浓度乙醇的洗脱物中总糖、皂苷和黄酮含量存在较大差异,其中X30中总糖、皂苷和黄酮含量均显著大于较高浓度乙醇的洗脱物;与T70相比,X30中总糖含量较T70中明显减少,而皂苷和黄酮含量则明显增大。综合上一节中X30的综合抗氧化能力优于T70,由此说明太子参提取物中皂苷和黄酮含量是抗氧化能力关键成分。
2.3 体外模拟消化及抗氧化能力
进一步比较X30和T70中主要成分在体外模拟消化过程中稳定性以及所表现出的抗氧化能力,如图3所示。
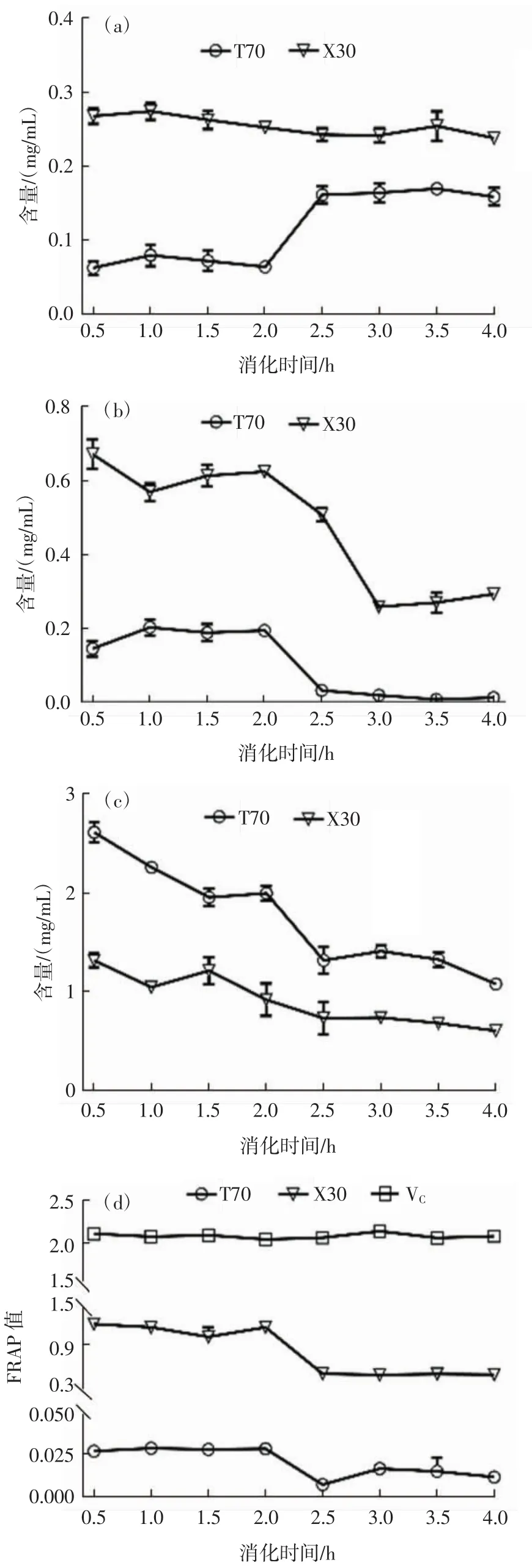
图3 体外模拟消化过程中太子参醇粗提物和洗脱物组分的变化Fig.3 Component changes of the extract and the elution of Radix pseudostellariae during simulated digestion.
图3(a)中T70中黄酮在胃液中消化曲线较平坦,说明胃酸对黄酮含量的影响较小;在肠消化阶段,消化液中黄酮含量增加,这与陆俊等[14]的研究结果类似。据报道,类黄酮化合物在胃肠道消化液中降解极少[15]。X30中黄酮含量在整个胃肠消化过程均表现出比较稳定,可能是由于糖苷/糖苷配基比例的差异反映出糖苷稳定性的差异[16]。
图3(b)表明X30和T70中皂苷含量在胃液中较稳定,在肠消化阶段皂苷浓度大幅度下降,这是因为皂苷能与肠液中的胆汁盐形成不可吸收的较大的聚集体[17],从而导致皂苷含量下降。由此可见,太子参皂苷类化合物主要在肠道被消化。
从图3(c)可以看出X30和T70中糖类物质在胃肠消化过程中含量逐渐减小,这是因为酸[18]和盐[19]都会导致糖类物质的解离,胃肠液中的电解质(NaCl、KCl、NaHCO3、CaCl2等)都会对其稳定性产生影响[20]。
消化过程中活性成分的酶解和降解转化,使得消化产物的抗氧化活性产生差异。如图3(d)所示,X30和T70在胃液消化过程中抗氧化能力较好,在肠液消化过程中抗氧化能力有所降低;X30在消化过程中的抗氧化能力明显强于T70,这些均是由其内在主要成分含量以及在消化系统中的稳定性所决定的。VC在胃肠消化过程中稳定性好;由于X30中主要成分含量高,其中的黄酮消化稳定好,尽管皂苷和糖的消化稳定性较差,仍具有较好的抗氧化能力。
2.4 成分鉴定
利用超高效液相色谱-串联四极杆飞行时间质谱(ultra-high performance liquid chromatography-quadrupole time-of-flight mass spectrometry,UHPLC-QTOFMS/MS)对太子参提取物中主要成分物质进行物质鉴定,得到的总离子流图(total ion chromatography,TIC)图谱如图4所示。

图4 UHPLC-QTOF-MS检测正、负离子模式TIC图Fig.4 TIC image of positive and negative ion modes detected by UHPLC-QTOF-MS
经鉴定,X30中皂苷类化合物主要为Sublateriol C和Laetiposide F,黄酮类化合物包括6,8-Di-C-beta-D-arabinopyranosylapigenin、Apigenin 8-C-[xylosyl-(1->2)-galactoside]、Isovitexin 2″-O-(6′″-(E)-pcouma-royl)glucoside、木犀草素、Kaempferol 3-(2G-xylosylrutinoside)-7-glucoside、Quercetin 3-rutinoside-7-(6″-benzoylglucoside)7-[(6-O-Benzoyl-beta-D-glucopyranosyl)oxy]-3-[[6-O-(6-deoxy-alpha-L-mannopyranosyl)-beta-D-glucopyranosyl]oxy]-2-(3,4-dihydroxyphenyl)-5-hydroxy-4H-1-benzopyran-4-one、6,8-Di-C-beta-D-arabinopyranosylapigenin、Apigenin 4′-glucuronide、Kaempferol 3-(3″-p-coumaroylrhamnoside)-7-rhamnoside,此外还含有三萜类物质钩藤酸E、三萜皂苷元熊果酸等。
3 结论
经体外抗氧化评价体系筛选出70%乙醇粗提物的抗氧化性较好,经大孔树脂D101富集纯化后30%乙醇的洗脱物X30具有更好的抗氧化能力,较高浓度的X30抗氧化能力与VC相当。X30中黄酮含量为(129.977±2.226)(mg/g干物质),皂苷含量为(613.477±11.994)(mg/g干物质),表示皂苷和黄酮对抗氧化具有决定性作用;在胃肠消化过程中黄酮的稳定性好,皂苷、总糖含量的稳定性相对较差;X30在胃肠消化过程中仍具有较好的抗氧化性。明确了X30中皂苷类和黄酮类化合物的主要组成。因此,X30具有良好的抗氧化功能开发和应用潜力。
