NMDA受体和vein基因对果蝇交配取向行为的调控研究
2021-11-17邵凌展
邵凌展,平 勇
(1. 上海交通大学 Bio-X研究院,上海 200240; 2. 上海交通大学 教育部遗传发育与精神疾病重点实验室,上海 200240)
精神分裂症(Schizophrenia)是一种病因、病理学复杂的情感性精神疾病,患者通常会表现出多类行为异常,包括认知、情感、幻觉、攻击等[1-4].2016年全球疾病负担研究(Global Burden of Disease Study 2016, GBD)显示精神分裂症的全球患病率约为0.26%,其中,中国居民的患病率达到0.42%,位居所有国家的前列,并呈现逐年上升的趋势[2].精神分裂症的病理机制尚未清楚阐释,但是人类遗传学研究表明遗传因素在精神分裂症的产生和病情发展中起到重要的作用,并已确定了大量与该疾病易感性相关的候选基因[4-5].N-甲基-D-天冬氨酸(N-methyl-D-aspartate, NMDA)受体功能低下一直被认为是精神分裂症的重要病因,NMDA两亚基NR1和NR2的表达失调和磷酸化异常与患者社交及感觉运动控制方面的行为缺陷有关[6].值得注意的是,NMDA受体信号通路通常被认为是精神分裂症各种候选易感基因的一个重要聚合点[7].而谷氨酸、γ-氨基丁酸(GABA)和多巴胺等信号通路被证实存在广泛的相互作用,多种神经递质系统的失衡是该疾病重要的病理生理学表现[8].
此外,基因连锁分析与关联研究证实神经调节蛋白NRG1(Neuregulin 1)及其受体ErbB4基因的改变与精神分裂症的发生有着很强的相关性,NRG1-ErbB4信号通路能够通过激活NMDA受体亚基蛋白NR2的磷酸化影响受体的功能[9].NRG1属于一类含有表皮生长因子(Epithelial Growth Factor, EGF)结构域的蛋白家族,在物种间保持着很高的同源性.哺乳动物的NRG家族成员NRG1~NRG4分别由nrg1~nrg4基因编码,通过激活酪氨酸激酶受体ErbB参与到早期神经发育、神经递质信号传导以及突触的可塑性中[10].已有研究发现,ErbB4通过其PDZ(Post Synaptic Density protein(PSD95), Drosophila disc large tumor suppressor(D1g1), zonula occludens-1 protein(zo-1))结构域与谷氨酸能突触后致密蛋白PSD95相互作用而锚定在突触后膜上[11].NRG1杂合突变(NRG1+/-)的小鼠产生了精神分裂症样行为,并且在分子层面上表现出NMDA受体表达量和磷酸化水平的降低,以及谷氨酸能突触功能的减退[12-13].果蝇神经细胞在种类上与复杂程度上与人脑相似,且使用着与哺乳动物类似的神经递质和神经调节蛋白[14].其中,vein(vn)蛋白及其受体EGFR分别为哺乳动物NRG和ErbB家族蛋白的唯一同源物[15],vn/EGFR信号通路曾被发现参与到果蝇腹神经束(VNC)等轴突发育中[16].
临床证据表明,精神分裂症与性别焦虑症(Gender Dysphoria, GD)存在一定的共病性(comorbidity),患者对性别身份认知的扭曲被认为与疾病的阳性症状(幻觉、妄想)有关[17].但是,目前对于精神分裂症患者的性别障碍的研究大多基于心理学投射实验(projective test)或性别角色测验[18],对实验结果掺杂主观性判断,并且缺乏对其遗传机制的深入探讨.因此,寻找合适的动物模型对疾病的性别认知行为学进行研究将有助于证实上述的关联性.果蝇凭借其强大的行为能力和遗传学背景,成为模拟神经精神疾病行为学研究的理想系统,其中最重要的是求偶交配行为[19].果蝇区分雄雌的能力受基因控制,并且涉及到不同脑区神经细胞和感官系统参与下对化学信息素,如7-三氯乙烯和顺式醋酸乙烯酯(cVA)的感知[20],而无法感知这些信息素的雄性果蝇会不恰当地出现同性求爱的行为[19].脑中多种神经递质信号紊乱曾被报道与果蝇异常的交配行为相关,比如,脑中降低的多巴胺水平能够导致果蝇活动性和交配成功率的降低,而多巴胺表达水平上调的果蝇则表现出雄-雄交配的表型[4,21],但是具体的中枢神经系统调控机制有待进一步研究.
本研究重点关注果蝇交配取向这一重要行为特征,首次证明了果蝇椭球体(EB)区NMDA受体表达能够导致其交配取向行为的异常.同时,我们发现果蝇精神分裂症易感同源基因vn和NMDA受体存在一定的信号联系,共同调控这一行为过程.
1 材料与方法
1.1 实验材料与试剂
本研究中所使用的雄果蝇均以每组10~15只成群培养于食物管中,其中w1118,elav-Gal4;+;+(后文简写为elav-Gal4),vnγ3果蝇来自本实验室保种;UAS-dsNR1,UAS-dsNR2,UAS-dNR1,UAS-dNR2由台湾省清华大学Ann-Shyn Chiang教授实验室馈赠;UAS-vn(#58498)来自美国印第安纳大学的Bloomington果蝇中心(Bloomington Stock Center);UAS-vnRNAi(#108432)来自奥地利维也纳果蝇资源中心(Vienna Drosophila Resource Center, VDRC).实验果蝇培养于标准玉米粉-红糖培养基上,放置于25 ℃光照培养箱内,光照条件为1 000 lux,相对湿度控制在60%左右,光照周期为明暗12 h交替(9:00 am开灯,21:00 pm关灯);实验中用到的普通体式显微镜购于意大利OPTIKA公司,透明果蝇食物管和UNIQ-10柱式TRIzol总RNA抽提试剂盒(B511321)购于生工生物工程(上海)股份有限公司,StepOne型荧光定量PCR仪购自美国ABI公司.
1.2 果蝇交配取向实验
果蝇交配取向实验于每日同一时间(7:00~9:00 am)进行,实验前大量收集羽化4 h内的果蝇.其中,测试需要用的雄果蝇(test fly)单只独立培养于食物管中至羽化后7 d进行实验,而供其选择交配的目标雄性果蝇和雌性果蝇(testee male or female)则以每组10~15只成群培养于食物管中.实验起始阶段,将成群培养的雄果蝇和雌果蝇各一只分别断头后固定在直径1.5 cm,高度2 cm的小型交配场地(圆柱体直径15 mm×高20 mm)两端.随后,放入CO2麻醉后的受试雄性果蝇,其苏醒后将在两只去头的目标果蝇中任意选择其交配对象.整个实验过程被录像记录,时长为2 h.交配取向指数(Preference Index, PI)反映了2 h实验过程中受试果蝇分别与断头雌性果蝇和雄性果蝇的交配时间差异,参见文献[4]公式如下:
PI=(T雌-T雄)/(T雌+T雄)×100%.
1.3 Western blot
分别选取20只羽化7 d左右的野生型w1118、elav-Gal4;UAS-dsNR1和elav-Gal4;UAS-dsNR2果蝇进行实验.在90倍体式显微镜下,使用DMEM细胞培养基在冰上剪取头部.在4 ℃环境下,通过12 000×g离心10 min去除表皮碎片.头部蛋白样品经SDS-PAGE电泳、转膜后,检测dNR1和dNR2蛋白的表达情况.Western blot实验中使用的dNR1和dNR2抗体由Ann-Shyn Chiang教授馈赠.
1.4 实时荧光定量PCR
挑选羽化后7 d左右的elav-UAS-vnRNAi,UAS-vnRNAi和elav-Gal4果蝇各50只,在冰上剪取头部,于液氮中分组冻存.用TRIzol试剂盒提取各组果蝇的总RNA,并进行电泳检测.随后,利用StepOne型荧光定量PCR仪完成RNA的逆转录,并使用SYBR Green和所设计的RT-PCR引物对各组RNA进行实时定量PCR.反应条件设定为95 ℃预变性3 min,95 ℃变性5 s和60 ℃退火30 s,循环45次.整个反应体系结束后,根据ct值,使用2-ΔΔCt方法计算表达量的相对变化.反应引物的设计使用Oligo 7.0软件,并以rp49为内参基因,引物由擎科生物科技有限公司合成,序列信息见表1.
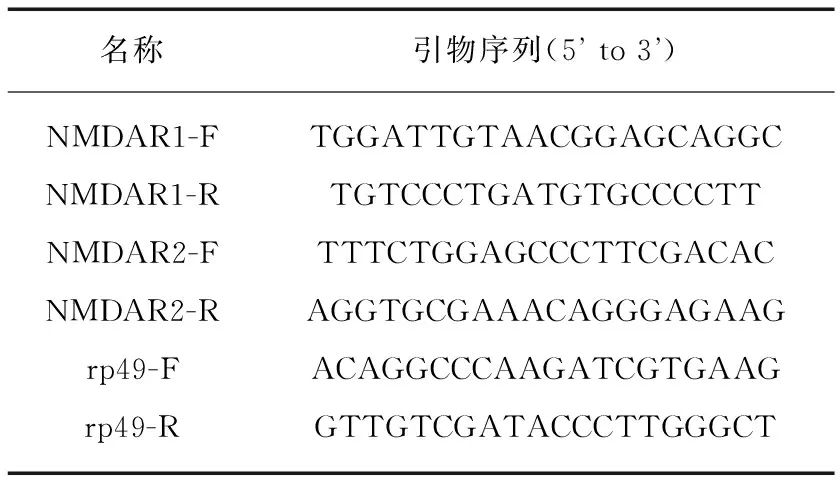
表1 实时荧光定量PCR引物序列信息Tab.1 Sequence information of genes fluorescencequantitative Real-time PCR primer
1.5 数据分析
所有实验获得数据均表示为平均值±标准误差(mean±SEM).正态分布的两种基因型参数的组间均值比较采用Studentt检验(Sigma Plot 14.0),并使用Graphpad Prism 6.0、CorelDRAW 2018等软件作图分析.统计学显著性差异设置为当*P<0.05时,即为有显著性差异,同时设定**P<0.01,***P<0.001,n.s.为无显著性差异.
2 结 果
2.1 NMDA受体表达影响果蝇交配行为
2008年,Grosjean等[19]为研究果蝇同性交配相关基因,设计了果蝇交配取向的实验量化方法(如图1(a)所示),通过记录被测试雄性果蝇选择雄性或雌性果蝇的时间段总和,计算交配取向指数(Preference Index, PI)来描述被测试果蝇的选择配偶偏向性.
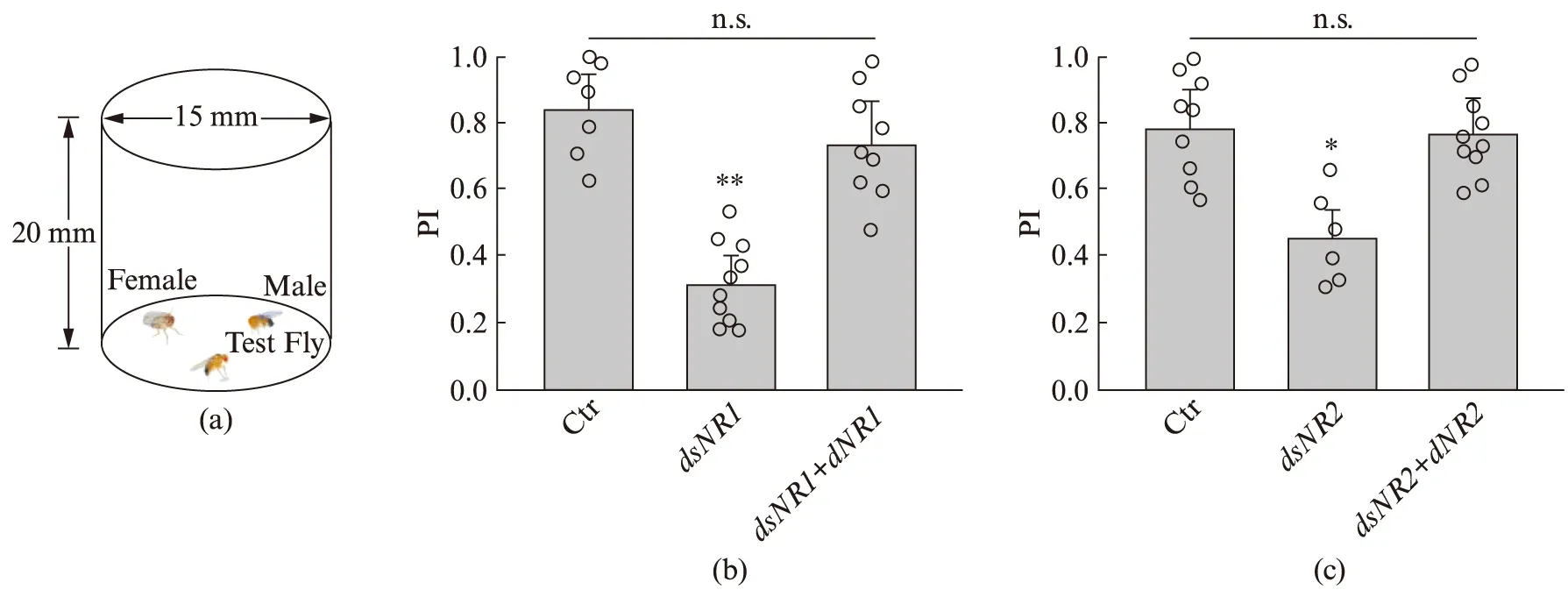
图1 NMDA受体功能性敲除导致果蝇交配取向改变Fig.1 Function-loss of NMDA receptor changes the mating orientation in flies(a) 为果蝇交配取向检测模式图.(b)、(c) 为果蝇交配取向指数统计柱状图.其中,Ctr为elav-Gal4,dsNR1为elav-Gal4;UAS-dsNR1,dsNR1+dNR1为elav-Gal;UAS-dsNR1/UAS-dNR1,dsNR2为elav-Gal4;UAS-dsNR2,dsNR1+dNR2为elav-Gal;UAS-dsNR2/UAS-dNR2.N=6~10.均值比较采用Student t检验,**P<0.01,*P<0.05,n.s.为无显著性差异.
我们沿用这一方法,首先利用dsRNA分别在果蝇全神经元范围内抑制NMDA受体两亚基蛋白基因dNR1和dNR2的表达,并观察比较其交配行为.在酵母转录因子基因Gal4的控制下,靶向dsRNA干扰能够在有丝分裂后神经元中剔除或关闭特定基因的表达[22].在实验中,我们选取的果蝇年龄均为羽化后7 d,由于果蝇的寿命周期较短,7 d的果蝇相较人类而言处于青年时期[3].对亚基蛋白表达水平的定量分析验证了RNAi干扰的效果,结果如图2所示,dNR1/2的表达分别被dsRNA所抑制.我们发现,相较于亲代对照组,亚基蛋白dsNR1(图1(b))和dsNR2(图1(c))表达抑制的果蝇均出现异常的交配行为.dsNR1/2果蝇的PI指数明显降低,分别为0.30和0.45,其中,dNR1受到抑制后的行为学差异更为明显.这一结果表明,该受体在全神经元范围内表达降低时,雄性之间交配行为增加.当我们继续通过UAS-dNR1/2恢复dNR1和dNR2两亚基的表达水平时,突变体果蝇的PI指数分别被挽救至0.71和0.74,进一步证明了这一异常行为由基因表达降低所引起.这些结果提示NMDA受体参与调控了果蝇的交配行为.

图2 果蝇dNR1和dNR2蛋白表达情况Fig.2 The expression of dNR1 and dNR2 proteins in fliesWestern blot实验证明dNR1/2蛋白的表达均为dsRNA所抑制,其中syn(syntaxin)为内参蛋白.
2.2 NMDA受体对果蝇交配取向的影响与特定神经元有关
为了研究NMDA受体的行为学作用机制,我们必须首先确定哪类神经元参与了该行为.影响果蝇社交行为的神经元有很多,在这里我们主要关注几种与果蝇认知行为相关的神经元,包括投射神经元(Projection Neurons, PNs)、蘑菇体区神经元(Mushroom Body Neurons, MBNs)以及蘑菇体后侧紧挨着的椭球体区神经元(Ellipsoid Body Neurons, EBNs),并使用3类表达范围更小的Gal4分别在上述神经元内驱动表达dsNR1(图3(a)和dsNR2(图3(b)),实现对NMDA受体功能的抑制.实验结果发现,当我们通过GH146-Gal4、201Y-Gal4在PNs和MBs两类神经元内抑制dNR1/2的功能时,果蝇的交配行为与对照组无异,PI指数保持在对照组区间范围内([0.78,0.83]),说明这两类神经元中NMDA受体的表达水平与交配取向无关.幸运的是,当我们用Feb170-Gal4分别驱动dsNR1和dsNR2在EB区域表达时,由图3可以看出,果蝇交配取向行为均呈现与全神经元表达一致的结果(图1(b)、(c)).果蝇的PI指数分别为0.41和0.49,与对照组相比分别降低了48.3%和38.6%.该结果提示EB区域NMDA受体表达水平与果蝇的交配行为相关.
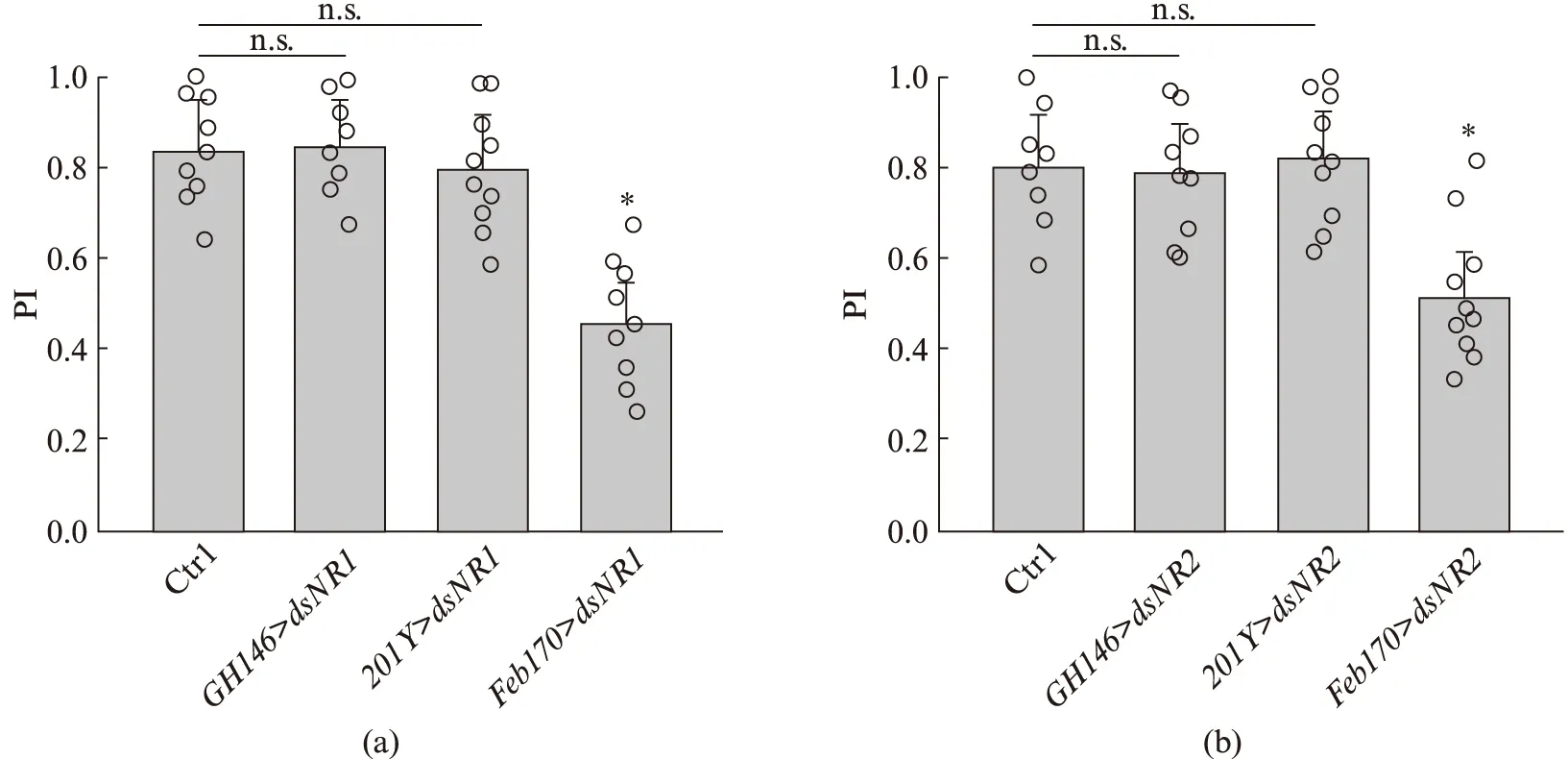
图3 降低果蝇EB区神经元NMDA受体表达水平导致果蝇交配取向异常Fig.3 Reduced NMDA receptor expression in EB region neurons leads to abnormal mating orientation in flies(a)、(b)分别为在3种神经元内抑制dNR1和dNR2亚基表达时的果蝇交配取向指数统计柱状图.其中,Ctr1和Ctr2分别为UAS-dNR1和UAS-dNR2,GH146>dsNR1/2、201Y-Gal4>dsNR1/2和Feb170-Gal4>dsNR1/2分别对应的果蝇基因型为GH146-Gal4;UAS-dsNR1/2、201Y-Gal4;UAS-dsNR1/2和Feb170-Gal4;UAS-dsNR1/2.N=8~10.均值比较采用Student t检验,*P<0.05,n.s.为无显著性差异.
2.3 vn突变体果蝇出现异常的交配取向行为
由于果蝇的交配行为具有复杂的神经系统调控机制,在确定了NMDA受体在此过程中的作用后,我们继续考虑是否还存在其他相关基因参与调节这一过程.通过选择性地对一些精神分裂症相关的果蝇易感同源基因进行行为学筛选,我们观察到果蝇类神经调节蛋白vn基因突变的雄性果蝇在交配时选择雌性配偶的总时长显著降低,结果见图4(a)(第650页).vn突变体果蝇vnγ3的PI指数仅为0.37,相比于野生型w1118和其亲代对照组UAS-vn分别降低了52.2%和54.1%.随后,我们使用vnRNAi对vn基因进行功能性敲除,以证实该基因在此行为学过程中的作用.由图4(b)(见第650页)可以看出,vnRNAi果蝇展现出与vnγ3突变体极为相似的行为学缺陷,PI指数仅为0.41.为了进一步确认该结果是由于基因表达水平降低,而非插入位点等其它影响,我们通过UAS-vn恢复突变体果蝇的vn基因表达水平.比较分析后发现两种突变体果蝇行为异常情况得到了挽救,恢复率达到90%以上,相较对照组果蝇无统计学显著差异.上述结果说明vn参与到果蝇交配取向行为的调节中.

图4 vn突变体果蝇交配取向异常Fig.4 vn mutants have abnormal mating orientation(a)、(b)分别为vnγ3与vnRNAi突变体果蝇交配取向指数统计柱状图,过表达vn能够挽救其交配取向的损伤.其中Ctr1为w1118,Ctr2为UAS-vn,vnγ3为vn突变体,vnγ3+vn为elav-Gal4;UAS-vn;vnγ3,vnRNAi为elav-Gal4;UAS-vnRNAi,vnRNAi+vn为elav-Gal4;UAS-vnRNAi/UAS-vn.N=9~10.均值比较采用Student t检验,**P<0.01,*P<0.05,n.s.为无显著性差异.
2.4 vn与NMDA受体对果蝇交配取向影响的关联
我们的实验提示vn和NMDA受体均参与调控果蝇的交配取向,那么两者间是否具有一定的关联呢?为了探寻vn和NMDA受体的相互作用,我们首先检测了vnRNAi果蝇基因dNR1与dNR2的表达情况.由图5可以看出,当我们抑制vn基因表达时,NMDA受体两亚基蛋白的表达量均有所降低,且2号亚基的表现更为明显.现有的证据显示,只有dNR2亚基的N端包含NMDA受体的主要激活物谷氨酸的结合位点,并且其C端具有与EGFR类似的PDZ结构域结合基序,能与锚定蛋白PSD95特异性结合[23].因此相较于dNR1,NMDA受体亚基dNR2似乎更有可能参与到vn/EGFR对神经元谷氨酸能信号的调控中.此外,我们通过dsRNA在先前筛选到的EB神经元内下调vn的表达,并挑选雄性果蝇进行交配取向行为测试.统计结果显示,果蝇的交配行为未受到显著的影响(Feb170-Gal4,PI=0.82±0.15;Feb170>vn-RNAi,PI=0.76±0.17;P>0.05),这说明EB神经元内vn的表达水平与果蝇的交配决策无关.
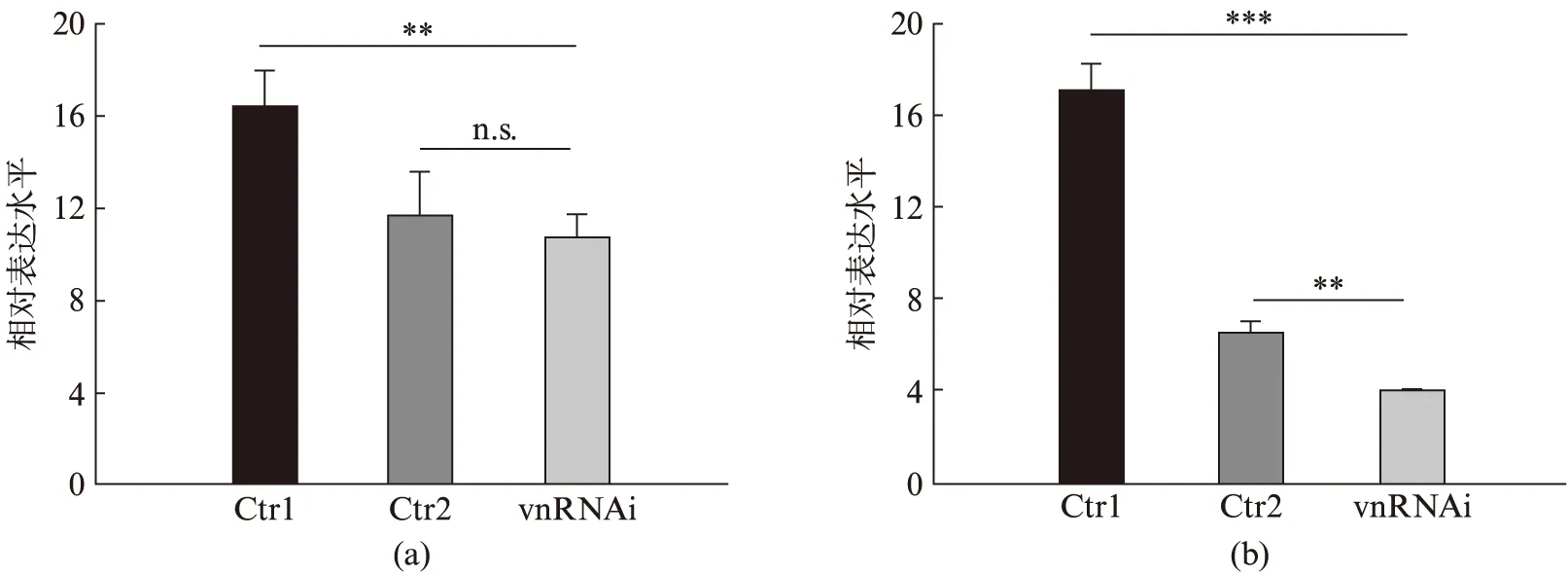
图5 vnRNAi果蝇NMDA受体两亚基蛋白mRNA的相对表达水平Fig.5 Relative mRNA levels of two NMDA receptor genes in vnRNAi flies(a)、(b)分别为vnRNAi果蝇dNR1与dNR2两基因mRNA表达量统计柱状图.Ctr1为elav-Gal4,Ctr2为w;UAS-vnRNAi,vnRNAi为elav-Gal4;UAS-vnRNAi.均值比较采用Student t检验,*P<0.05,**P<0.01,***P<0.001,n.s.为无显著性差异.
实际上,vn基因的5’端含有一段DNA编码的疏水性肽段,Schnepp等[24]对蛋白的功能研究曾证实vn能够分泌到胞外发挥作用.为验证上述猜测是否正确,我们采用杂交的方式在果蝇全神经元范围内同时抑制vn和dNR2受体的表达,并观察杂交后代雄性果蝇的交配行为表现.由图6可以看出,vn和NMDA受体dNR2亚基同时下调的果蝇,PI指数为0.41,相较对照组降低了45%,该差异具备统计学显著性.而与分别单独抑制vn和dNR2(PI指数分别为0.44和0.37)相比,雄性果蝇的交配决策的正确率没有显著降低,即没有出现基因表达抑制的叠加效应.这就说明在这一行为过程中,vn并非影响果蝇交配取向行为的独立因素,vn/EGFR与NMBA受体通路在某种程度上存在神经信号联系.
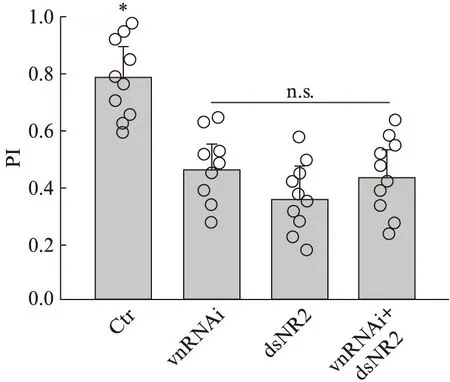
图6 同时抑制vn和dNR2不加强果蝇的交配取向异常Fig.6 Simultaneous suppression of vn and dNR2 did not aggravate the abnormal mating orientation in fliesvn和dNR2共表达后对果蝇交配倾向的影响与单独抑制没有显著性差异.图中Ctr为elav-Gal4,vnRNAi为elav-Gal4;UAS-vnRNAi,dsNR2为elav-Gal4;UAS-dsNR2,vnRNAi+dsNR2为elav-Gal4;UAS-vnRNAi/UAS-dsNR2.N=8~10.均值比较采用Student t检验,*P<0.05,n.s.为无显著性差异.
3 讨 论
果蝇的交配取向研究有一定的历史,但目前尚未实现从神经环路水平来解释这种复杂调控的发生基础.Liu等[21]用遗传和药理学的方法上调发育期果蝇脑部的多巴胺水平发现,雄性果蝇表现出对其他同性果蝇增强的求爱倾向.我们的结果则首次证明,抑制谷氨酸受体NMDA的表达能够导致果蝇交配取向行为的异常,而椭球体(EB)区域在此过程中起到重要作用.谷氨酸能神经元占大脑代谢活动总量的60%至80%,作为大脑中主要的兴奋性神经递质,谷氨酸神经传递的改变被发现与多种精神分裂症相关的神经递质信号紊乱有关[25].多项研究表明,多巴胺神经元是谷氨酸能投射到中脑多巴胺核(midbrain dopamine nucle)来调节的,这使得它们对谷氨酸的变化具有潜在的敏感性[26].EB是果蝇中央复合体的主要结构之一,虽然目前对其功能的研究相对较少,但已有文献表明EB区神经元的NMDA受体功能与果蝇的认知行为,如嗅觉学习记忆和行动决策相关[27-29].对于EB区神经元的形态学研究发现其中含有大量GABA的存在[30];Zhang等[27]使用GABA抗体对EB区域进行免疫组化染色,同样证实了该区约有2/3的Role 2(R2)和Role 4(R4)神经元以及部分Role 1(R1)和Role 3(R3)神经元都是GABA能的.发育期GABA能神经元中NMDA受体功能的异常是多巴胺异常释放所必需的[31],NMDA受体拮抗剂已被证明能降低GABA能中间神经元功能[32].结合本次实验结果,我们认为多巴胺调节增强导致的果蝇交配取向异常可能是继发于谷氨酸能功能障碍的.果蝇EB区NMDA受体表达量的下调导致谷氨酸能无法有效投射到脑部,对多巴胺神经元起到足够的抑制作用.反过来,受到过度刺激的多巴胺信号导致果蝇的交配取向异常.
在此基础上,我们又意外地通过行为学筛选发现另一果蝇精神分裂症易感同源基因vn参与到交配取向的调节中.vnγ3突变体果蝇的交配取向改变,随后的基因的RNAi干扰与过表达实验进一步证实突变体果蝇vn基因表达量下调与异常交配行为学的因果关系.果蝇神经系统的EGFR信号参与调控神经细胞的发育与相互作用,涉及到不同的分子机制与受体相互作用.除了神经调节蛋白类配体vn外,目前在果蝇中还发现了spitz(spi)、gurken(grk)和Keren(Krn)3类TGF-α配体[15].需要注意的是,哺乳动物神经调节蛋白NRG1已被证实能够通过直接影响多巴胺受体的功能来干扰多巴胺能的传递[33].因而NRG1-ErbB信号通路的改变被认为与精神分裂症患者脑内谷氨酸能和多巴胺能系统的失调有关,并直接导致了患者的神经发育性认知障碍[34].我们实验结果则证明了NRG1的同源蛋白vn能够影响NMDA受体基因的表达,即两者在果蝇的交配行为中存在的某种信号联系.虽然在EB区域抑制vn的表达时未发现果蝇交配取向的改变,但作为一种神经元合成并分泌的小分子蛋白[24],我们认为vn仍有通过分泌的方式间接影响果蝇EB区域神经元内NMDA受体表达的可能.在后续的研究中,我们将重点关注vn对NMDA受体的精确调控机制,深入研究神经递质影响果蝇交配行为的神经环路和细胞分子基础.
NMDAR之所以成为人们最关注的精神分裂易感基因之一,不仅在于其本身在认知行为方面的重要功能,还在于它具有复杂且庞大的与之相互作用的基因网络,对这个网络及其内部相互作用模式的研究将加深我们对精神分裂症遗传模式的认识.而作为精神分裂症患者神经损伤及发育异常的标志,认知功能障碍的病理生理机制仍未得到解析.因此,从理论上讲,利用果蝇建立精神分裂症模型,发现相关的早期风险因素,有助于揭示疾病背后复杂的神经环路,为疾病的治疗提供新的目标.
