羊栖菜酵素对小鼠肠道菌群结构和粪便差异代谢物的影响
2021-11-17赵菲佟长青李伟曲敏
赵菲,佟长青,李伟,曲敏
(大连海洋大学 食品科学与工程学院,海洋食品精深加工关键技术省部共建协同创新中心,辽宁 大连 116023)
羊栖菜Sargassumfusiforme属于褐藻门马尾藻属的一种海洋孢子植物,以浙江、福建和辽宁沿海地区居多[1]。中国药典早有记载,羊栖菜营养丰富,含有多种生物活性物质,如维生素、多酚类物质、多糖和蛋白质等[2],近年的研究表明,羊栖菜具有降血脂、抗疲劳、增强免疫力和延缓衰老的作用[3],因此,羊栖菜在医药、食品和化妆品等领域具有重要应用价值[4]。
酵素是一种发酵产物,能够参与机体新陈代谢等生命活动[5]。酵素食品是指以各种蔬菜、水果等为原料,采用各种有益菌发酵剂进行发酵制成的产品,含有多种营养成分和各种微生物及其代谢产物,具有改善肠道功能、增强免疫力等特性。酵素发酵原料多种多样,水果、蔬菜是酵素常用原料,除此之外,还可添加菌菇、中草药和藻类等进行发酵,制备多种酵素产品。近年来,学者对酵素产品的发酵工艺和功能性进行了较多研究,发现酵素食品普遍具有较好的抗氧化性和微生物多样性,且随着发酵程度的进行,酵素食品中的抗氧化性和微生物多样性呈现上升趋势。
肠道菌群作为胃肠道内环境稳定的重要组成部分,在维持机体健康等方面发挥着重要作用。在机体消化吸收过程中,营养摄取可导致肠道微生物系统发生变化[6]。研究表明,发酵食品会对机体肠道菌群多样性产生影响,同时,也会带来与机体糖分解有关的菌群改变、产短链脂肪酸(SCFAs)菌群丰度减小及蛋白质分解菌群增多等变化[7]。
羊栖菜酵素是用羊栖菜和果蔬经过多种菌种发酵得到的羊栖菜酵素,含有丰富的营养成分,具有良好的抗氧化活性和微生物多样性[8]。目前,关于羊栖菜酵素与肠道微生物菌群之间的作用关系尚不明确[9]。酵素对小鼠肠道菌群影响是近年来关注的焦点,多项研究表明,酵素可能与肠道中的微生物群落构成有关,能抑制肠道致病菌,促进有益菌生长,优化肠道菌群结构,对健康产生积极意义[10]。本研究中,以灌胃羊栖菜酵素和灌胃生理盐水的小鼠为研究对象,通过采集小鼠粪便对两组小鼠的肠道菌群差异性进行研究,并利用16S rRNA基因测序与代谢组学联合应用技术,研究羊栖菜酵素对小鼠肠道菌群结构和代谢产物的影响,旨在揭示羊栖菜酵素与肠道微生物菌群之间的关系。
1 材料与方法
1.1 材料
试验动物为SPF级昆明种小鼠100只,雄性,体质量为(25±2)g,购自大连医科大学动物实验中心。试验小鼠饲养于室温为(25±3)℃和湿度为40%~60%的遮光室内鼠笼中,小鼠可自由饮水和取食。SPF级试验维持鼠粮购自江苏省协同医药生物工程有限责任公司。试验动物许可证号SYXK(辽) 2008-0002。
主要仪器:AB Triple TOF 5600/6600质谱仪(AB SCIEX);Agilent 1290 Infinity LC超高压液相色谱仪(Agilent);低温高速离心机 (Eppendorf5430R)。色谱柱: ACQUITY UPLC BEH Amide 1.7 μm, 2.1 mm×100 mm column(Waters);ACQUITY UPLC HSS T3 1.8 μm, 2.1×100 mm column(Waters)。
1.2 方法
1.2.1 羊栖菜酵素的制备 按照杨培青等[5]的方法加以改进,即将羊栖菜、苹果、梨、胡萝卜、冬瓜洗净并沥干,切成1~3 cm见方的块状,取质量分别为15.0、1.0、0.5、0.5、0.5 g混合,再将酵母、乳酸菌及醋酸菌加入混合物中,酵母、乳酸菌和醋酸菌的加入量均为混合物质量分数的0.5%,于发酵罐中10~25 ℃下发酵50 d,即得羊栖菜发酵液。将所得羊栖菜发酵液过滤,滤液置于罐中贮藏30 d,即得羊栖菜酵素。
1.2.2 小鼠粪便的收集 将100只昆明种小鼠随机分为空白组 (control-1~control-10)和羊栖菜酵素组(JS-1~JS-10),每组设10个重复,每个重复5只小鼠。每天上午分别用生理盐水(control)和羊栖菜酵素(JS)对各组小鼠进行灌胃,灌胃剂量均为0.2 mL/10 g(体质量),每日一次,连续灌胃45 d。最后一次灌胃24 h后,采用拎尾法收集各组粪便存放在离心管中,置于液氮中速冻后于-80 ℃下保存备用。
1.2.3 16S rRNA高通量测序及微生物多样性分析将冷冻的小鼠粪便采用干冰送样方法寄送至上海中科新生命生物科技有限公司,用于DNA的提取及测序,通过基因组DNA抽提、PCR扩增、荧光定量、Illumina PE250测序将得到的PE reads根据overlap关系进行拼接。
对样品进行Chao1、Shannon、Simpson等Alpha多样性指数分析,并计算样品覆盖率。OTU数量代表物种的丰度,利用Mothur软件对每个样品的OTU数量(相似水平97%以上)进行计算[11]。
1.2.4 粪便代谢组学分析 取冷冻的小鼠粪便60 mg,分别加入200 μL水MP匀浆,涡旋60 s,加入800 μL甲醇-乙腈溶液(二者体积比为1∶1),涡旋60 s,低温超声30 min,2次,-20 ℃下放置1 h沉淀蛋白质,4 ℃下以14 000 r/min离心20 min,取上清液冷冻干燥,于-80 ℃下保存[12]。
样品采用超高效液相色谱系统(Agilent 1290 Infinity LC)进行分离,色谱仪中柱温为25 ℃,流速为0.3 mL/min,流动相为水+25 mmol/L 乙酸铵+25 mmol/L氨水(A相),乙腈(B相),在进行梯度洗脱过程中,采用随机样本连续分析法进行检测和分析[13]。
1.2.5 代谢产物鉴定与分析 代谢结构鉴定物的数据经Pareto-scaling预处理后进行多维统计分析,即PLS-DA有监督偏最小二乘法判别分析、无监督主成分PCA分析和OPLS-DA正交偏最小二乘法判别分析。结合相关数据库选取潜在差异标志物,结合相关生物标志物,采用MetPA数据库构建代谢通路,对数据进行分析解释[14]。其中,使用 OPLS-DA模型中变量重要性投影(variable importance in the projection,VIP)参数评价潜在的生物标志物。选择具有多维统计分析VIP>1和单变量统计分析P<0.05的代谢物,作为具有显著性差异的代谢物[15]。将筛选出的差异代谢物进行热图分析和利用Metaboanalyst数据库进行代谢通路分析。KEGG通路下包含的差异表达代谢物数目,在某种程度上反映试验设计中生物学处理对各个通路的影响程度,因此,结合两方面因素选择较为显著的代谢或信号转导途径及差异表达代谢物进行后续生物学机制研究[16]。
2 结果与分析
2.1 菌群多样性分析
从表1可见:在所有样品中,样品OTU数量最多的为羊栖菜酵素灌胃JS-5组和JS-6组(均为1 319),最少的为JS-1组(602),表明各组菌群丰度存在显著差异;Chao1值反映菌群多样性程度,指数值越大表示菌群多样性越高,样品中菌群多样性程度最高的为JS-5组(1 527);Shannon指数反映菌群多样性程度,指数值越大表示菌群多样性越高,样品中Shannon值最大的组也是JS-5组(5.46);Simpson指数也反映菌群多样性程度,数值越低表示菌群多样性越高,样品中JS-5组Simpson值最小(0.010 7);20个样品的覆盖率均在0.99以上,说明小鼠粪便样品中不能被检测到的可能性较低。因此,从20组小鼠粪便菌群的OTU数量及Alpha多样性可以看出,羊栖菜酵素灌胃组小鼠粪便菌群多样性最高,表明羊栖菜酵素灌胃对小鼠的肠道菌群具有较为突出的调节作用。

表1 各组样品粪便菌群的OUT数量及Alpha多样性
2.2 菌群构成
通过与数据库进行比对,对OTU进行物种分类并分别在门和属水平上对各个样品进行了分析。从图1可见:两组小鼠肠道微生物种类繁多,在门水平上主要有6大类,分别是厚壁菌门Firmicutes、拟杆菌门Bacteroidetes、变形菌门Proteobacteria、放线菌门Actinobacteria、ε-细菌Epsilonbacteraeota和脱铁杆菌门Deferribacteres,其中厚壁菌门和拟杆菌门是丰度比例最高的菌门;空白组中,厚壁菌门丰度为26.88%,放线菌门丰度为0.21%,而羊栖菜酵素组中,厚壁菌门丰度为43.00%,放线菌门丰度为4.74%,羊栖菜酵素灌胃组粪便菌群中厚壁菌门和拟杆菌门较空白组呈增加趋势;空白组中,拟杆菌门、变形菌门、ε-细菌、脱铁杆菌门的丰度分别为66.66%、2.79%、2.52%、0.53%,而羊栖菜酵素灌胃组中,拟杆菌门、变形菌门、ε-细菌、脱铁杆菌门的丰度分别为48.91%、1.72%、0.85%、0.05%,羊栖菜酵素组粪便菌群中这4种菌门较空白组呈减少趋势。这表明,羊栖菜酵素可选择性地抑制肠道致病菌,促进厚壁菌门和放线菌门等有益菌的生长,减少变形菌门、ε-细菌和拟杆菌门等有害菌、致病菌的比例。

图1 各组样品肠道菌群在门水平上的相对丰度
从图2可见:在属水平上,空白组和羊栖菜酵素组差异显著;空白组中,鼠李科Muribaculaceae丰度为26.37%,乳杆菌属丰度为5.27%,而羊栖菜酵素灌胃组中,鼠李科丰度为43.47%,乳杆菌属Lactobacillus丰度为22.22%,羊栖菜酵素组粪便菌群中鼠李科、乳杆菌属较空白组呈增加趋势;空白组中,拟杆菌属Bacteroides、毛骡菌科136组Lachnospiraceae NK4A 136 group、理研菌科RC9菌群Rikenellaceae RC9 gut group、幽门螺杆菌属Helicobacter和双歧杆菌属Bifidobacterium丰度分别为16.22%、5.73%、7.89%、2.52%、0.048%,而羊栖菜酵素灌胃组中,拟杆菌属、毛骡菌科136组、理研菌科RC9菌群、幽门螺杆菌属和双歧杆菌属丰度分别为1.00%、2.97%、0.29%、0.85%、3.06%,羊栖菜酵素组粪便菌群中这6种菌属较空白组呈减少趋势。
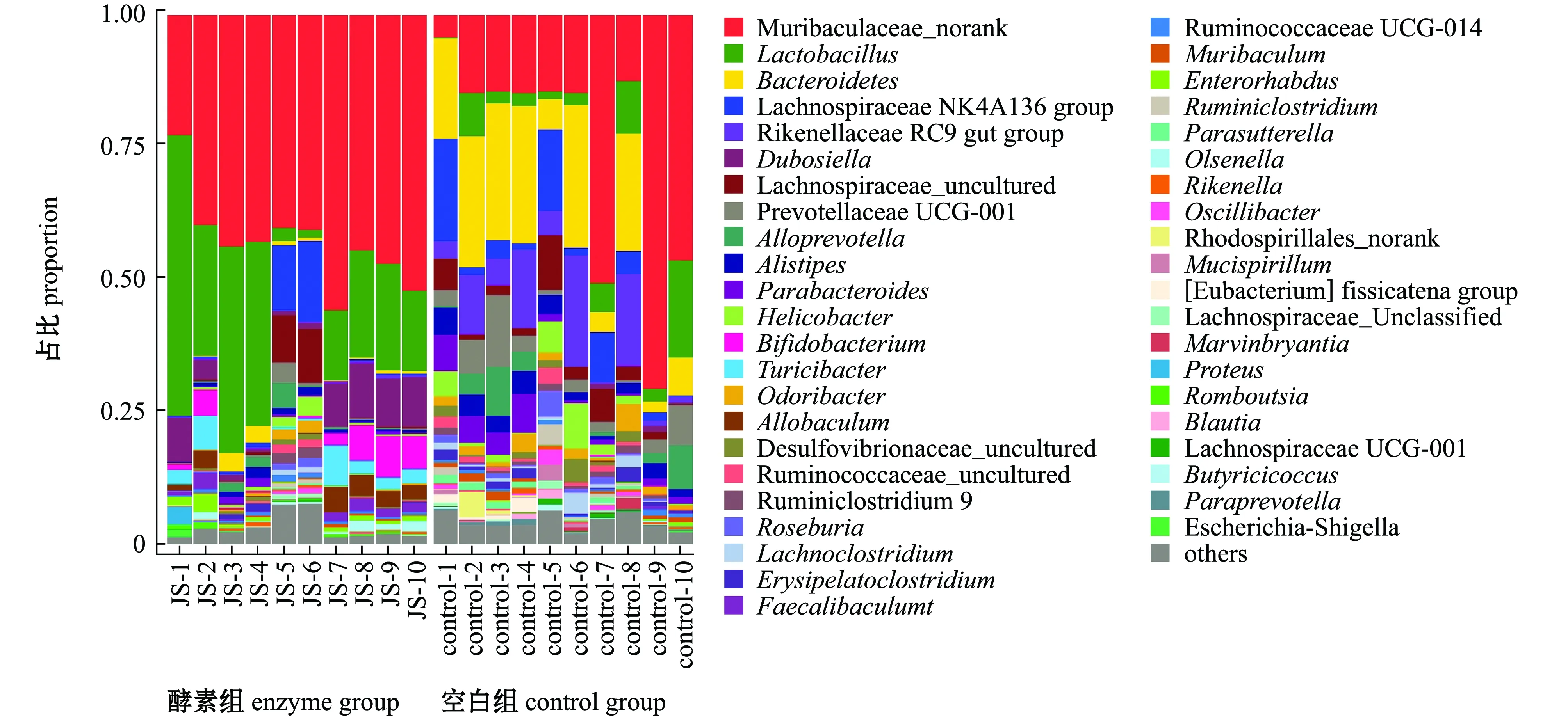
图2 各组样品肠道菌群在属水平上的相对丰度
2.3 粪便代谢组学分析
2.3.1 不同灌胃组间粪便样本的分类信息 采用PLS-DA法分析空白组和羊栖菜酵素组小鼠的代谢物谱差异,正、负离子模式结果见图3,其中两组粪便样本点在PC1维可以完全区分开,说明小鼠机体生理及物质代谢状况已经发生了明显的改变。为了验证PLS-DA 模型的可靠性,采用了OPLS-DA法对两组样本重新建模分析,结果得到较好的区分模型(图4)。
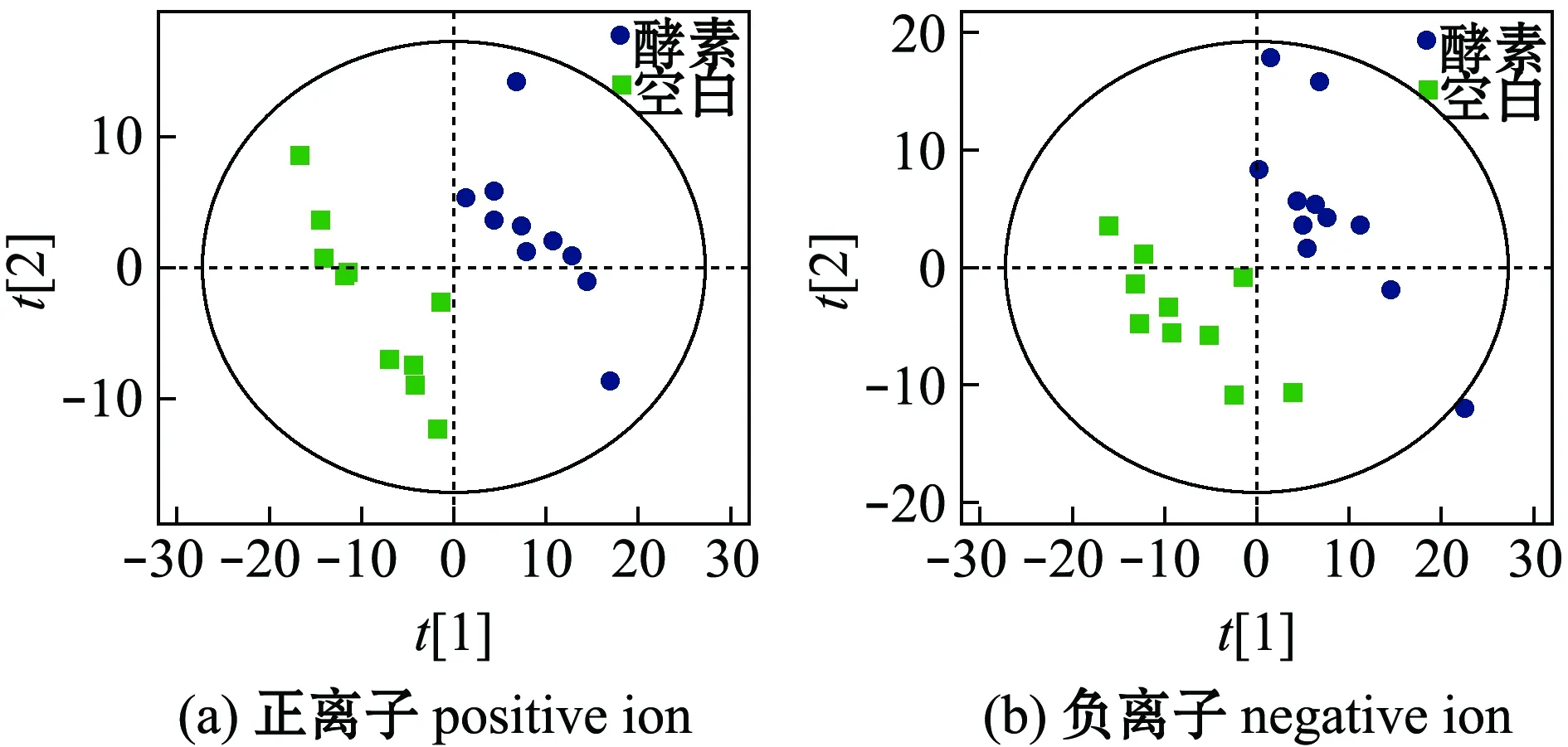
图3 空白组和羊栖菜酵素组小鼠粪便PLS-DA得分图

图4 空白组和羊栖菜酵素组小鼠粪便OPLS-DA得分图
2.3.2 显著性差异代谢物 选择具有多维统计分析 VIP>1和单变量统计分析P<0.05的代谢物作为具有显著性差异的代谢物。从表2可见:羊栖菜酵素灌胃组与空白组相比较,正、负离子模式下获得的14种显著差异潜在标记物中,次黄嘌呤、4-氨基丁酸、黄嘌呤、黄腐酚、胆碱、甜菜碱、腺苷、麦芽三糖、尿嘧啶、脱氧肌苷、尿苷二磷酸葡萄糖、肌苷在小鼠粪便中含量上调(fold change>1);而烟酰胺腺嘌呤二核苷酸、腺嘌呤、脱氧腺苷、ADP核糖、谷氨酸、硫胺素、甘氨酸、酪氨酸、α-D-葡萄糖、谷氨酸、肌酐、L-亮氨酸、尿苷在小鼠粪便中含量下调(fold change<1)。
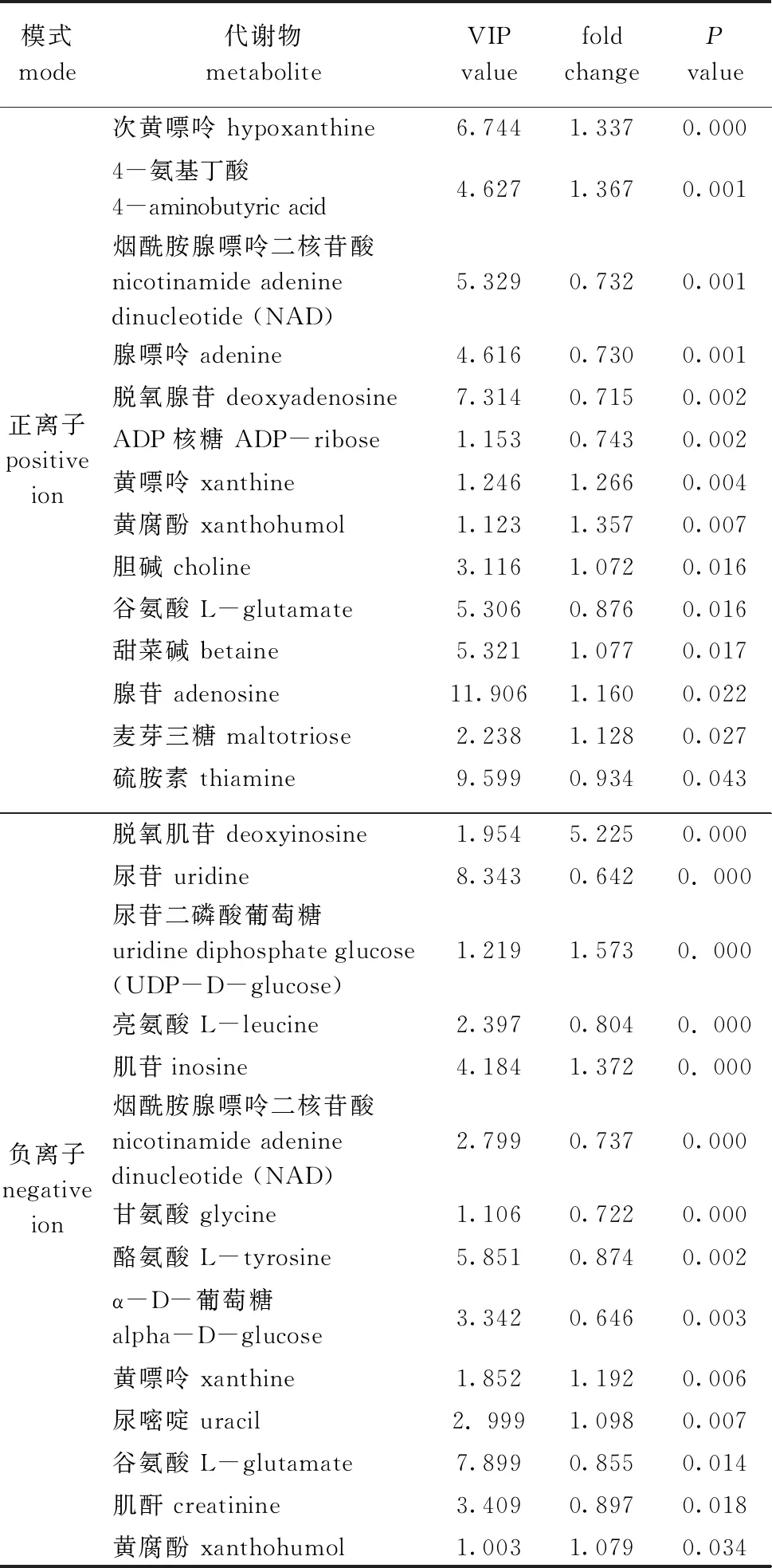
表2 正、负离子模式下两组的显著差异代谢物
2.3.3 代谢通路分析 以P<0.05作为截断标准,同时根据试验整体条件筛选羊栖菜酵素灌胃小鼠粪便的代谢通路,最终从14条代谢通路中,筛选得到7条主要影响的代谢通路如图5所示,分别为嘌呤代谢,丙氨酸、天冬氨酸和谷氨酸代谢,嘧啶代谢,半乳糖代谢,精氨酸和脯氨酸代谢,甘氨酸、丝氨酸和苏氨酸代谢,精氨酸的生物合成,其中对前5个代谢通路的影响最为显著。

图5 差异代谢产物的主要代谢通路
3 讨论
3.1 肠道菌群的变化
本研究中,不同灌胃组小鼠肠道菌群中起主要作用的微生物菌群不同,在羊栖菜酵素组中乳杆菌、双歧杆菌比例升高,且为优势菌群。乳杆菌和双歧杆菌是有益菌,是维持肠道细菌间生物拮抗作用的主要细菌,有助于肠道兼性菌的生长,同时能够提高巨噬细胞的补体功能和吞噬活性,增强细胞免疫和体液免疫,减轻肠上皮细胞的炎症反应,增强肠道防御功能,对调节肠道菌群组成起到重要作用[16]。而羊栖菜酵素灌胃组拟杆菌、幽门螺杆菌等有害菌在肠道中的比例降低,这表明,羊栖菜酵素能够显著改善小鼠肠道菌群组成,抑制有害菌生长,并有益于优势肠道菌群的繁殖。
3.2 代谢通路的变化
3.2.1 嘌呤和嘧啶代谢 嘌呤和嘧啶代谢在胃肠道中具有显著影响[17]。本研究中,羊栖菜酵素能够升高小鼠粪便中肌苷、次黄嘌呤及黄嘌呤的含量,恢复机体嘌呤代谢的稳态。肌苷为生物体的正常成分,是腺嘌呤的前体,能够参与体内核酸代谢、能量代谢和蛋白质的合成。有研究表明,肌苷含量上调,表明肌苷能直接透过细胞膜进入体细胞,活化丙酮酸氧化酶类,从而使处于低能缺氧状态下的细胞能继续顺利进行代谢,改善生物体能量代谢与蛋白质的合成[18]。肠道菌群也参与嘌呤和尿酸的代谢,如负责嘌呤氧化代谢的关键酶黄嘌呤脱氢酶能够由肠道细菌中的大肠杆菌分泌产生;肠道中的乳酸菌属和假单胞菌属的细菌能够合成与尿酸分解代谢有关的一些酶;此外,肠道中的一些细菌还能够分泌尿酸转运蛋白。研究表明,黄嘌呤含量上调,表明大肠杆菌分泌产生了大量的黄嘌呤脱氢酶,参与尿酸代谢,改善肠道菌群[19]。
本研究中还观察到粪便内容物中尿嘧啶水平降低、次黄嘌呤水平升高。尿嘧啶和次黄嘌呤是嘧啶和嘌呤衍生物,有研究表明, 尿嘧啶和次黄嘌呤水平的上调,表明肠道中菌群种类和数量的升高[20]。这表明,肠道菌群改善还会促进核苷酸代谢的改善。有研究表明,动物在进食期间,血浆中的尿苷水平会下降,该过程与肝脏中胆汁的分泌有关,肝脏可将血液中的尿苷运送到胆汁中,胆汁则会被转移到胆囊,然后被输送到肠道,而肠道中的尿苷有助于葡萄糖的吸收[21]。本研究中,羊栖菜酵素能使小鼠粪便中的尿苷含量下调,表明尿苷实际上参与了葡萄糖的调节。此外,肠道中的尿苷还参与胆汁的再循环,得到重复利用,而不再返回至血液中。
3.2.2 氨基酸代谢 谷氨酸与蛋白质及氨基酸代谢有关。谷氨酸缺乏是引起肠黏膜萎缩的主要原因,谷氨酸与精氨酸、脯氨酸等能经过器官间复杂的新陈代谢实现相互转换[22]。本研究中,羊栖菜酵素能使小鼠粪便中的中谷氨酸含量下调,推测小鼠体内谷氨酸吸收充足,蛋白质氨基酸代谢改善,能量代谢改善,肠道的完整性和免疫功能受到有益影响。胃肠道能够在无中枢神经系统支配条件下完成蠕动、分泌反射,该过程与氨基酸的代谢物密切相关[23]。有研究表明, 小鼠肠道中氨基酸含量升高,表明肠道菌群失调导致炎症发生[24]。本研究中,酪氨酸含量下降,表明粪便中代谢物发生显著变化, 氨基酸吸收良好,氨基酸代谢得到改善。
3.2.3 糖代谢 肠道内皮细胞间隙通透性可以通过黄腐酚修复和再生予以治疗。在肠道中,黄腐酚具有强烈的抗炎作用,其不仅修饰炎症激酶有利于抗氧化途径,还可以阻断肿瘤坏死因子等细胞损伤性炎症通路中的激酶。此外,黄腐酚对肠黏膜的再生也较有帮助。本研究中,羊栖菜酵素能使小鼠粪便中的黄腐酚含量上调,表明黄腐酚及其衍生物改善了葡萄糖耐量,同时对胆汁酸分泌、组织炎症和肠道微生物组成具有一定影响[25]。
以拟杆菌为代表的菌类, 能分解多种糖苷键[26]。本研究中,羊栖菜酵素能使小鼠粪便中的葡萄糖、核糖含量水平下降,这些单糖对某些肠道菌群来说是重要的能源物质,单糖水平的变化表明了肠道菌群发生改善,本试验结果提示,小鼠肠道对糖类吸收功能明显升高,表明酵素能够改善小鼠体内存在糖类和能量代谢的紊乱。
麦芽三糖可以快速进入肠道,并产生大量益生菌[27]。本研究中,羊栖菜酵素能使小鼠粪便中的麦芽三糖含量上调,说明麦芽三糖可以维持小鼠肠道中益生菌的平衡,且能让肠道中形成健康环境,可抑制有害病菌在肠道中繁殖,从而减少多种肠道病变的发生。
4 结论
1) 不同灌胃组小鼠肠道菌群中起主要作用的微生物菌群不同,在羊栖菜酵素组中乳杆菌、双歧杆菌比例升高,且为优势菌群。
2) 羊栖菜酵素能够显著改善小鼠肠道菌群组成,抑制拟杆菌、幽门螺杆菌等有害菌生长,并有益于优势肠道菌群的繁殖。
3) 羊栖菜酵素对小鼠肠道菌群的调节机制与嘌呤代谢,丙氨酸、天冬氨酸和谷氨酸代谢,嘧啶代谢,半乳糖代谢,精氨酸和脯氨酸代谢等代谢通路有关。
