坛紫菜膳食纤维的响应面优化超声复合酶法提取及其对鱼糜凝胶强度的影响
2021-11-17陈丽饶杰赵永强杨贤庆魏涯李春生王悦齐
陈丽,饶杰,赵永强,杨贤庆,魏涯,李春生,王悦齐
(1.江苏海洋大学,江苏 连云港 222005; 2.中国水产科学研究院南海水产研究所 农业部农村水产品加工重点实验室,广东 广州 510300; 3.江苏省海洋生物产业技术协同创新中心,江苏 连云港 222005)
坛紫菜Porphyrahaitanensis,俗称紫菜、乌菜,是中国特有的一种可人工栽培的海藻[1]。藻体单层,局部双层[2],色素体单一或少数具双,基部细胞呈圆头形,雌雄异株,少数同株,属暖温带性种类,为中国浙江、福建和广东沿海的主要栽培藻类[3]。坛紫菜富含蛋白质、多糖和维生素,可供食用或药用。此外,坛紫菜中还富含较高的膳食纤维成分,膳食纤维又有“人体第七营养素”之称[4]。膳食纤维按照其溶解性分为可溶性膳食纤维(soluble dietary fiber,SDF)和不可溶性膳食纤维(insoluble dietary fiber,IDF)[5],SDF在生理功能方面比IDF更为出色,具有缓解糖尿病[6]、降低高血压血脂[7]、预防心血管疾病等功能[8]。
目前,SDF的提取方式主要有粗分离法、化学提取法[9]、酶法[10]等,粗分离法是利用液体悬浮法和气流分级法,将原料中各成分的相对含量改变,从而提高膳食纤维含量,此方法得到的膳食纤维纯度不高,一般可作为原料的预处理;化学提取法包括水法、酸法、碱法[11]及絮凝法,该方法得到的膳食纤维纯度较高,也比较适用于工业化生产,但酸和碱不仅会在一定程度上破坏膳食纤维结构,且对设备要求高,也会对环境造成污染;酶法[12]是用一种或多种酶去除原料中除膳食纤维外的其他成分,通过浓缩、过滤、干燥得到膳食纤维,酶法提取专一性强,作用条件温和,操作方便,有利于环境保护,得到的膳食纤维纯度高[13]。植物多糖提取时常采用超声波破碎处理提高其提取率,但目前联合使用超声波及蛋白酶酶解提取海藻膳食纤维鲜见报道。本试验中,在酶法提取基础上采用超声波破碎仪[14]对坛紫菜细胞结构进行破坏,使酶能够更充分地接触物料,从而提高水溶性膳食纤维的提取率,为提升坛紫菜资源高值化利用率提供科学参考。
1 材料与方法
1.1 材料
试验用坛紫菜购自福建东山,罗非鱼鱼片购自广州禄仕食品有限公司。
试验试剂:无水乙醇、氢氧化钠、丙酮及其他试剂(分析纯,广州化学试剂厂);α-淀粉酶(活性≥10 000 U/g,Solarbio);糖化酶(活性≥100 000 U/g,北京奥博星生物技术有限责任公司);中性蛋白酶(活性≥60 000 U/g,北京奥博星生物技术有限责任公司)。
试验仪器:电热恒温鼓风干燥机(上海一恒科技有限公司);真空抽滤机(力辰科技有限公司);粉碎机(永康红太阳机电有限公司);超声波破碎仪(上海沪析实业有限公司);高速离心机(美国贝克曼库尔特公司);旋转蒸发仪(上海亚荣生化仪器厂);QTS-25型质构仪(英国CNS FARNELL公司);Phenom Pro型桌面式扫描式电子显微镜(美国赛默飞世尔科技公司)。
1.2 方法
1.2.1 提取步骤 参考孟爽爽[15]的方法,略做改进。将坛紫菜样品放入粉碎机粉碎后,过245 μm筛密封备用,取坛紫菜粉按一定质量比加入蒸馏水于超声波破碎仪破碎,调节pH为5后加入α-淀粉酶、糖化酶反应,沸水浴10 min灭酶活,冷却后调节pH为7,加入中性蛋白酶反应,再次沸水浴10 min灭酶活,之后以10 000 r/min离心10 min,取上清液加入4倍体积的乙醇(体积分数为95%),沉淀24 h后抽滤,置于60 ℃下烘干,得到SDF。
1.2.2 单因素试验设定 准确称取5.0 g坛紫菜粉末,按照质量比1∶25加入蒸馏水。先于超声波破碎仪中破碎,再进行酶解,最后进行离心、醇沉(条件同上)。为了更好地探究各因素对坛紫菜水溶性膳食纤维提取的影响,在查阅相关文献后[16-17],设置5个影响单因素,分别是超声功率(270、360、450、540、630 W),超声时间(20、30、40、50、60 min),中性蛋白酶添加量(0.1%、0.5%、1.0%、1.5%、2.0%,均为质量分数,下同),酶解温度(30、40、50、60、70 ℃),酶解时间(20、40、60、80、100 min)。试验结果以水溶性膳食纤维提取率为衡量指标,提取率(%)计算公式为

1.2.3 响应面优化提取条件 采用Dsign-Expert 8.0.6.1软件,按照Box-Behnken试验设计[16],在单因素基础上选取酶解温度(A)、超声时间(B)、超声功率(C)3个因素作为自变量,提取率为响应值[18],进行响应面分析设计试验(表1)。
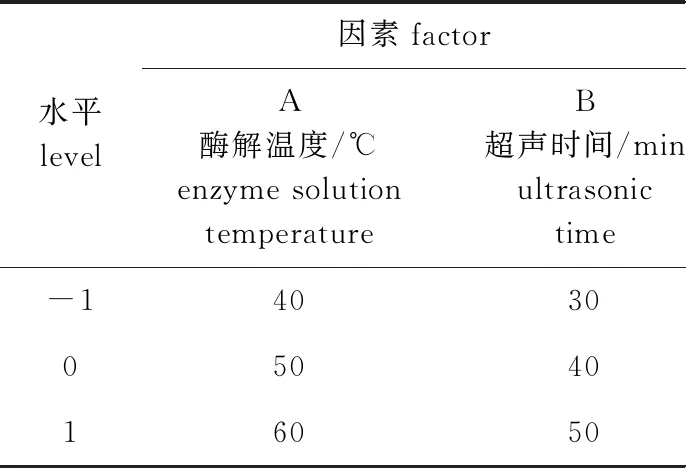
表1 Box-Behnken试验设计因素水平及编码表
1.2.4 坛紫菜SDF理化性质测定 持水性(g/g)、膨胀力(mL/g)、持油性(g/g)、阳离子交换力(mmol/g)计算公式[16-17]分别为
持水率=[离心后离心管质量(g)-干燥
离心管质量(g)]/SDF干质量(g),
(2)
膨胀力=[吸水后体积(mL)-初始体积
(mL)]/SDF质量(g),
(3)
持油率=[样品结合油后质量(g)-样品
干质量(g)]/样品干质量(g),
(4)
阳离子交换力=[消耗NaOH体积(mL)-
空白体积(mL)]/样品质量(g)×NaOH
浓度(mol/L)。
(5)
1.2.5 SDF对冻藏鱼糜凝胶强度的影响 分别将质量分数为0.1%、0.2%、0.3%的坛紫菜SDF干样与罗非鱼鱼片斩拌15 min后,制成混合鱼糜,置于-20 ℃条件下冻藏,并设置空白组。将冻藏下的鱼糜解冻,搅碎后加入质量分数2.5%的NaCl擂溃5 min,灌入肠衣待用。然后在40 ℃下加热30 min,再于90 ℃下加热15 min,二段加热使其凝胶化,冷却至室温后置于4 ℃冰箱过夜,待测[11]。将过夜样品取出切成25 mm高的圆柱体,用质构仪测定凝胶强度。质构仪参数设置为:球形探头直径为5 mm,下压位移为15 mm,触发值为5 g,测试速率为1.0 mm/s。凝胶强度(g·mm)计算公式为
凝胶强度=凝胶破断强度(g)×凹陷
深度(mm)。
(6)
1.2.6 扫描电镜观察 将鱼糜样品切成3 mm×3 mm×3 mm小块,用PBS溶液冲洗3次,每次15 min,然后放入体积分数2%的戊二醛液内,4 ℃下固定24 h。然后分别用体积分数为30%、50%、70%、90%、100%的乙醇溶液进行梯度洗脱,每次10 min。洗脱后进行冷冻干燥,得到的样品置于干燥皿中保存,最后将样品进行离子溅射仪喷金,扫描电镜观察。
2 结果与分析
2.1 单因素试验
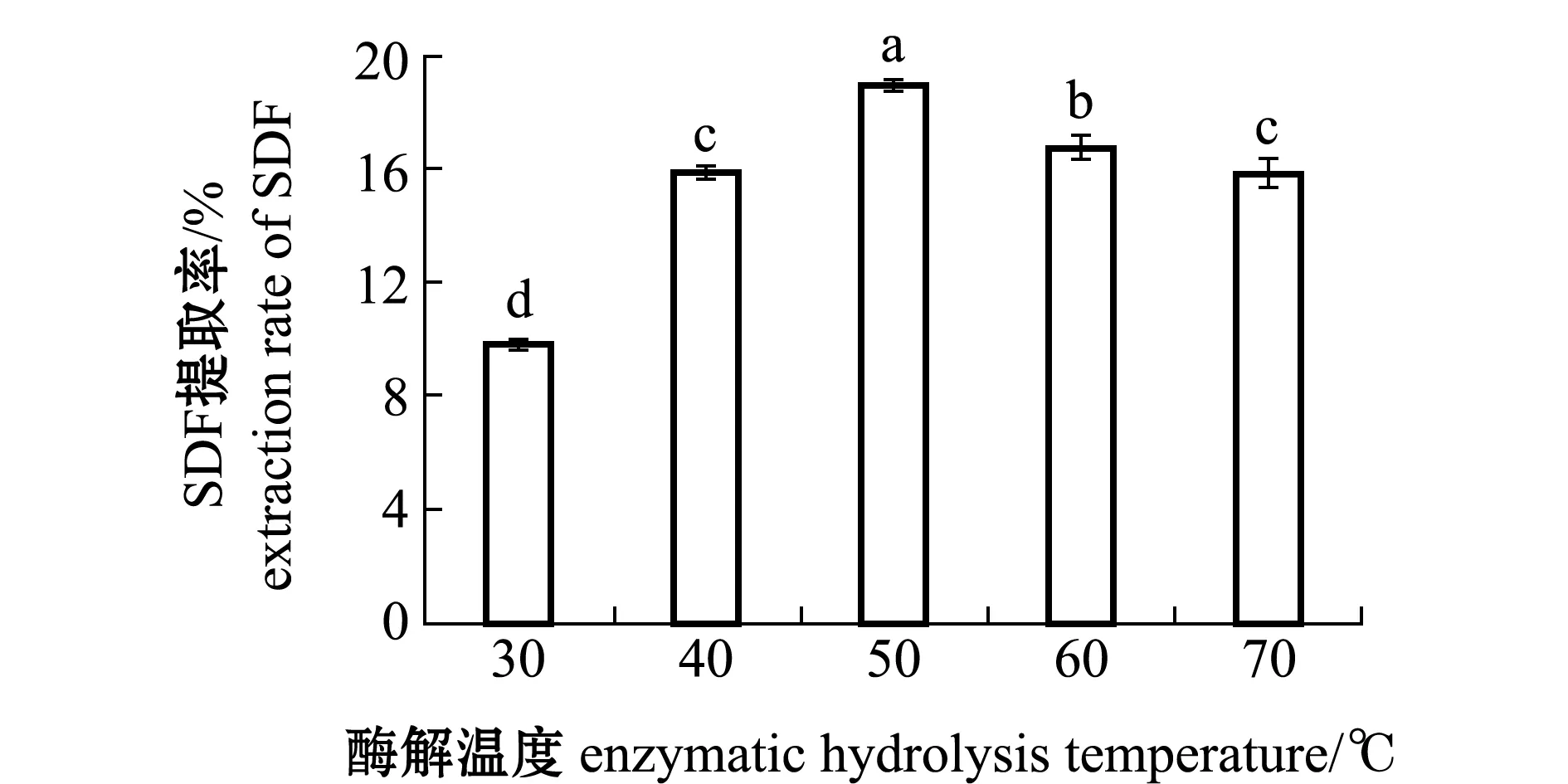
2.1.1 酶解温度对SDF提取率的影响 从图1可见:随着温度的升高,SDF提取率呈现先上升后下降趋势,在50 ℃时出现最高提取率(18.90%)(P<0.05);当温度由30 ℃上升至50 ℃时,SDF提取率呈显著性提升(P<0.05),SDF提取率从9.8%提高到18.9%,其原因可能是酶在温度影响下空间结构缓慢打开,暴露处有更多的作用基团与底物结合,加快了反应的进行;当温度高于50 ℃后,SDF提取率出现显著性下降(P<0.05),SDF提取率从18.9%下降到15.9%,其原因可能是温度过高,抑制反应酶活力,反应开始变慢。因此,本试验条件下50 ℃为蛋白酶的最适反应温度。
标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05),下同。
2.1.2 酶添加量对SDF提取率的影响 从图2可见:当酶用量小于1.0%时,SDF提取率呈现显著上升趋势,在1.0%时达到最高提取率(18.30%)(P<0.05);当酶添加量超过1.0%时,SDF提取率无显著性变化(P>0.05),其原因可能是随着蛋白酶用量增加后,在酶用量为1.0%时蛋白酶空间结构与底物已经充分接触,达到饱和状态。因此,从经济成本考虑,蛋白酶用量为1.0%时较好。
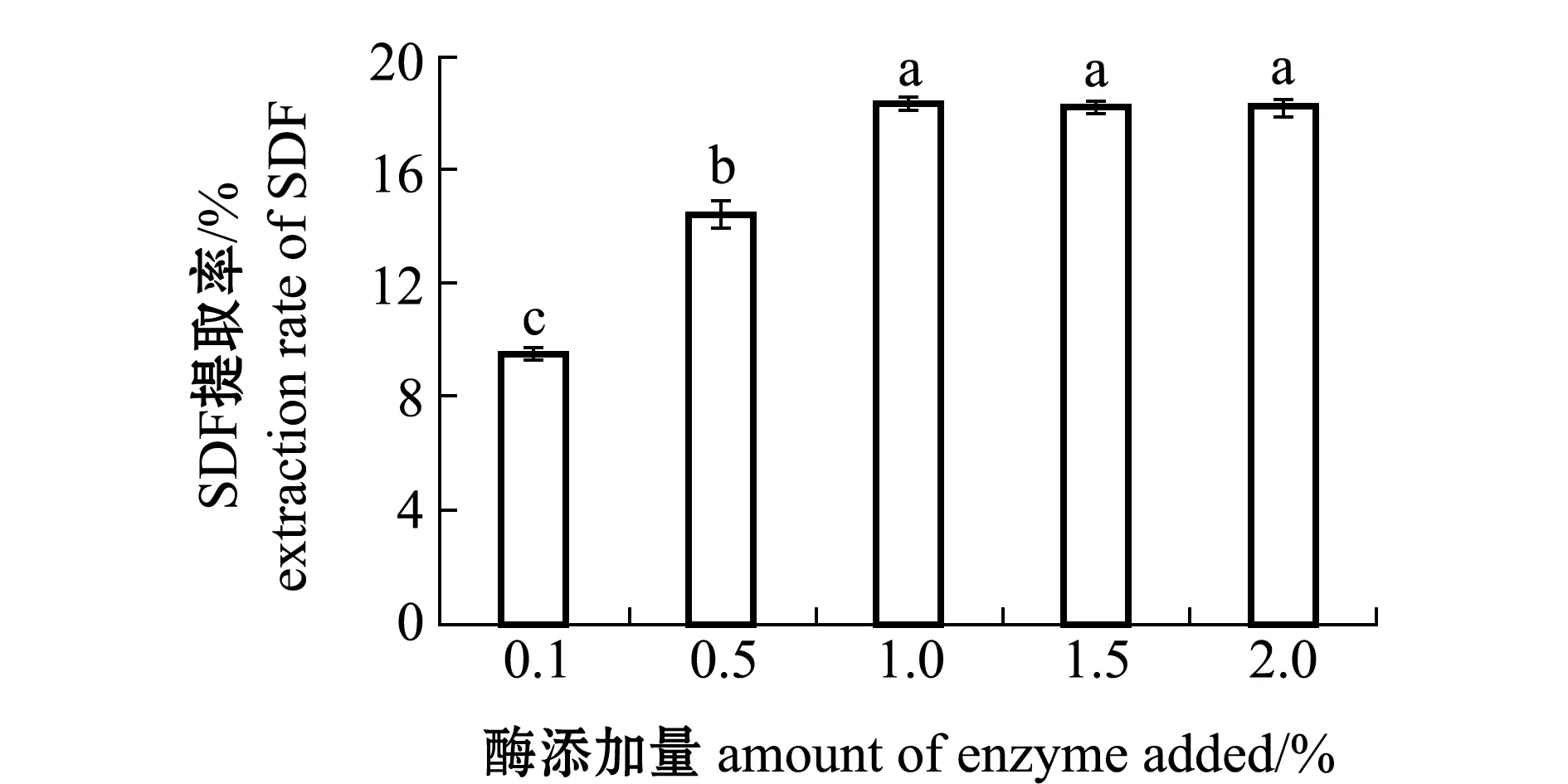
图2 不同酶添加量对坛紫菜SDF提取率的影响
2.1.3 酶解时间对SDF提取率的影响 从图3可见:随着酶解时间延长,SDF提取率出现显著性上升(P<0.05),在60 min时达到最高提取率(20.10%)(P<0.05);60 min后提取率趋于平稳(P>0.05)。其原因可能是20~60 min时酶与底物充分接触,反应高效进行,提取率一直处于增长状态,达到60 min后,与蛋白酶发生反应的底物可能已反应完毕,所以提取率未明显增加或者减少,处于平稳状态[17]。因此,本试验条件下酶解时间60 min为反应最适时间。
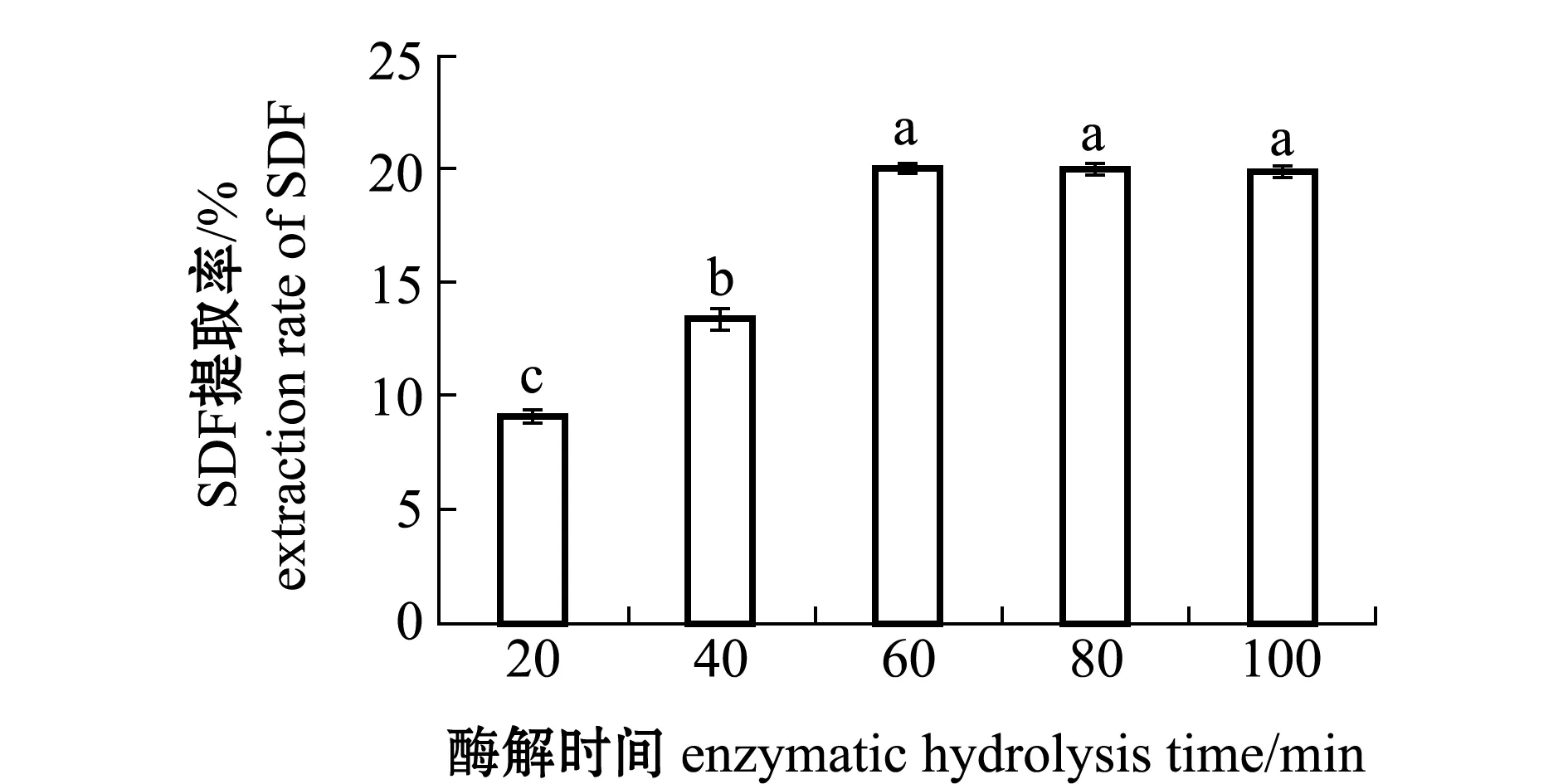
图3 不同酶解时间对坛紫菜SDF提取率的影响
2.1.4 超声功率对SDF提取率的影响 从图4可见:当超声功率为270~450 W时,SDF提取率呈现显著上升的趋势(P<0.05),这可能是超声波破碎了坛紫菜的细胞结构,使得SDF能轻易暴露出来;当超声功率达到450 W时,SDF的提取率最高(21.81%)(P<0.05);当超声功率超过450 W时,提取率处于下降状态,可能是超声的功率过大,破坏了膳食纤维原本的空间结构[19],形成小分子糖,未被醇沉下来。因此,选取超声功率在450 W时效果较好。
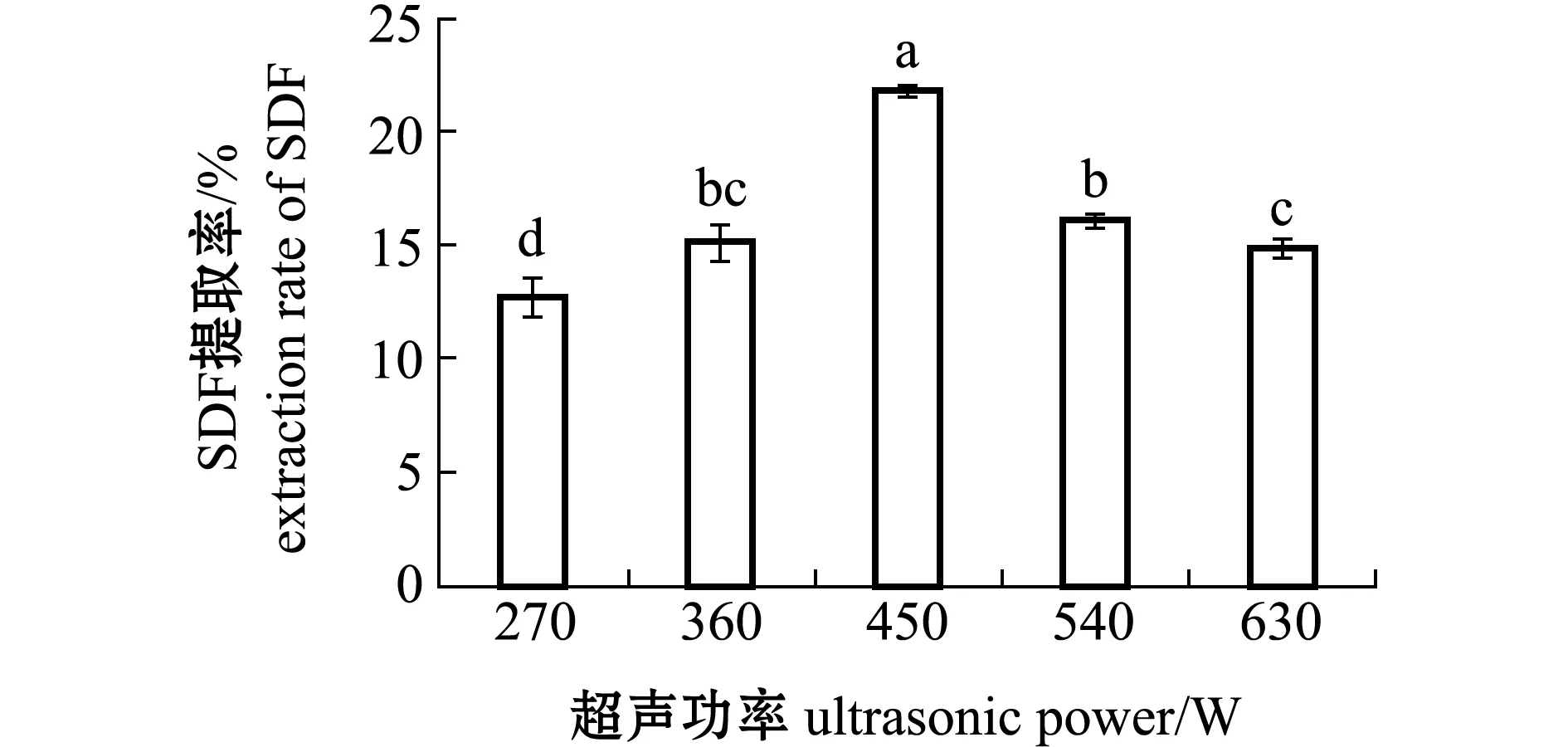
图4 不同超声功率对坛紫菜SDF提取率的影响
2.1.5 超声时间对SDF提取率的影响 从图5可见:随着超声时间的延长,提取率呈先上升后下降的趋势,超声时间为40 min时,提取率最高(22.13%)(P<0.05);当超声时间小于40 min时,随着超声时间延长,坛紫菜在超声波下被破碎,使得反应进行得更彻底,故提取率处于显著上升趋势(P<0.05);当超声时间大于40 min后,提取率出现显著下降趋势(P<0.05),这可能是坛紫菜细胞结构已被破碎完全,膳食纤维结构被超声波震碎,变成小分子物质[20],故提取率下降。因此,选取超声时间为40 min为最优条件。
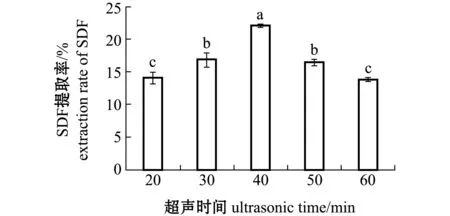
图5 不同超声时间对坛紫菜SDF提取率的影响
2.2 响应面优化分析
2.2.1 模型建立及方差分析 根据单因素试验结果,随着酶添加量和酶解时间因素水平的增加,坛紫菜SDF提取率均呈先上升再趋于平缓的趋势,因此,综合考量选取了酶解温度(A)、超声时间(B)、超声功率(C)3个因素作为自变量,提取率为响应值(Y),进行响应面分析设计试验。采用Dsign-Expert 8.0.6.1软件,按照Box-Behnken试验设计,建立3因素3水平试验(表2)。
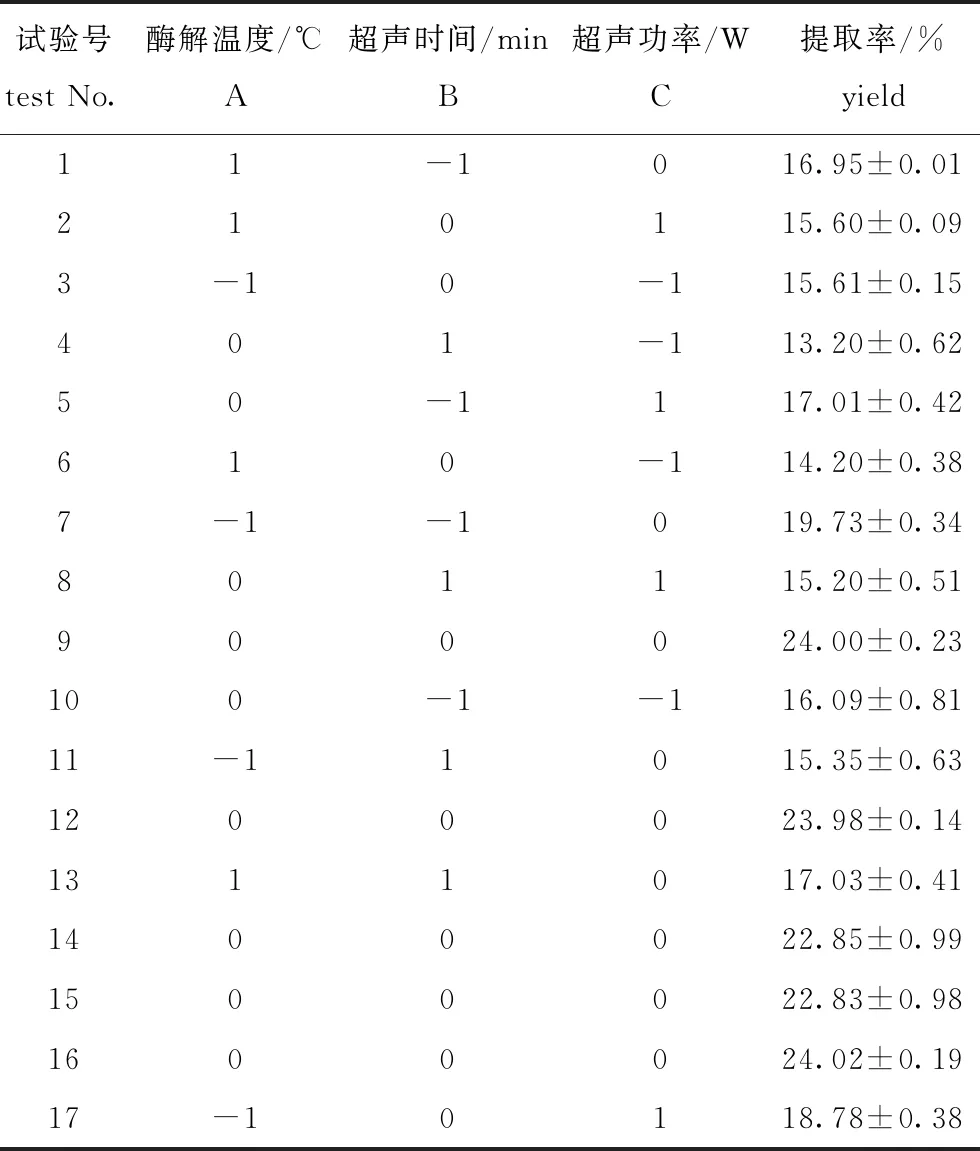
表2 响应面试验设计及试验结果
经多元拟合,得到坛紫菜SDF提取率的二次多项回归方程为
Y=23.54-0.72A-1.13B+0.94C+1.11AB-0.44AC+0.27BC-2.80A2-3.48B2-4.69C2。
提取率的方差分析结果如表3所示,其中,P值表示影响因素对模型的显著性,该模型的P值小于0.01,失拟项P值为0.331 7,大于0.05,表明该模型回归方程拟合度较高,误差较小,可以对不同条件下的提取效果进行分析和预测。一次项中A为显著影响因素,B和C均为极显著影响因素,二次项中AB为显著影响因素,A2、B2、C2均为极显著影响因素,说明3个因素对坛紫菜水溶性膳食纤维提取率的影响处于显著以上。通过F值可知各因素的影响程度,依次为F(超声时间B)>F(超声功率C)>F(酶解温度A),即对试验提取效果影响最大的因素是超声时间,其次是超声功率,酶解温度影响最小。
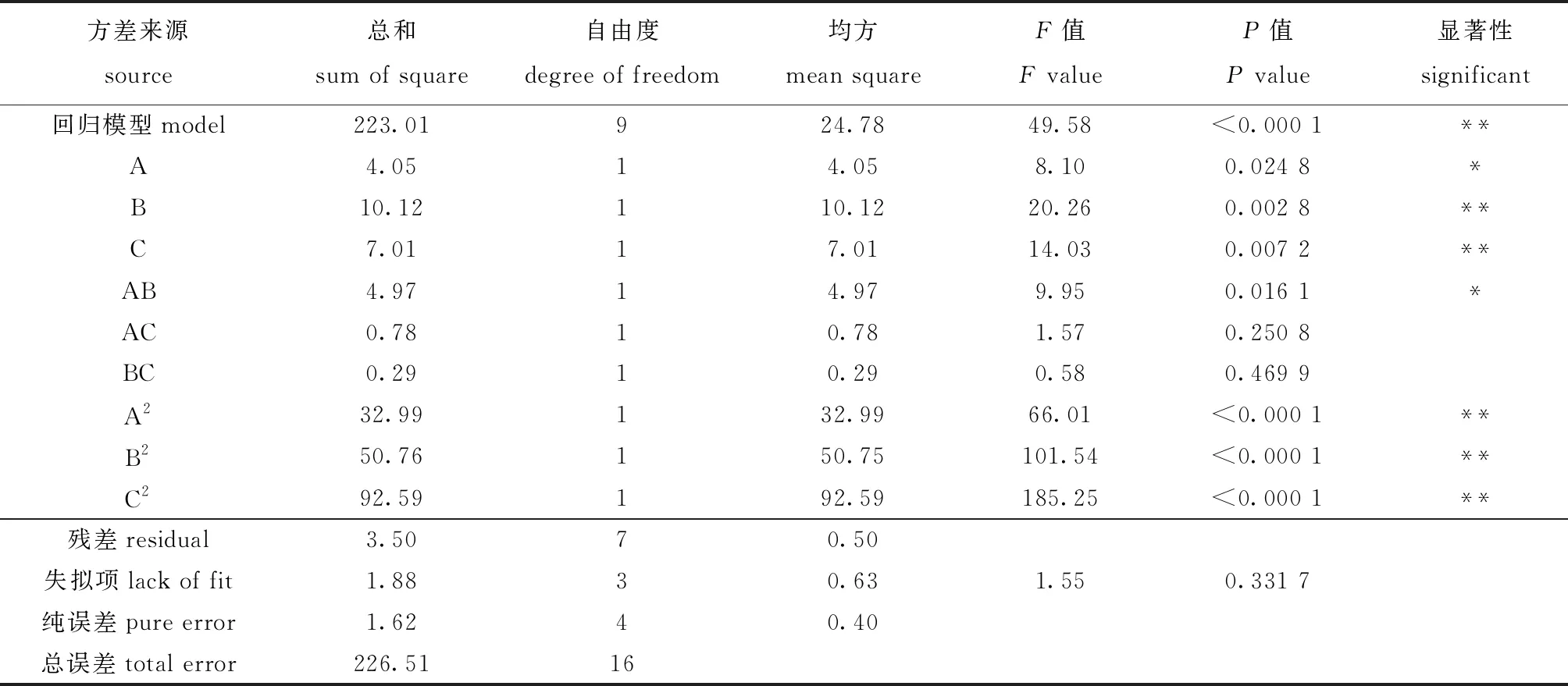
表3 SDF提取率方差分析结果
2.2.2 响应面模型图分析 各因素交互作用响应面图及等高线如图6所示,从3D模型图可知,随着超声功率、超声时间、酶解温度3个因素的增大,SDF提取率呈先上升后下降趋势,这与单因素试验的结果是一致的,3D图均有陡峭,说明因素间影响较为显著。等高线图可用来呈现因素交互的结果,椭圆形等高线图,说明两个因素间交互作用较为明显,圆形等高线图,说明两者交互作用较弱[21]。从图6来看,AC间的等高线呈现椭圆形,说明酶解温度与超声功率间的交互影响较强,而BC间的等高线呈现圆形,说明超声时间与超声功率间的交互影响微弱。
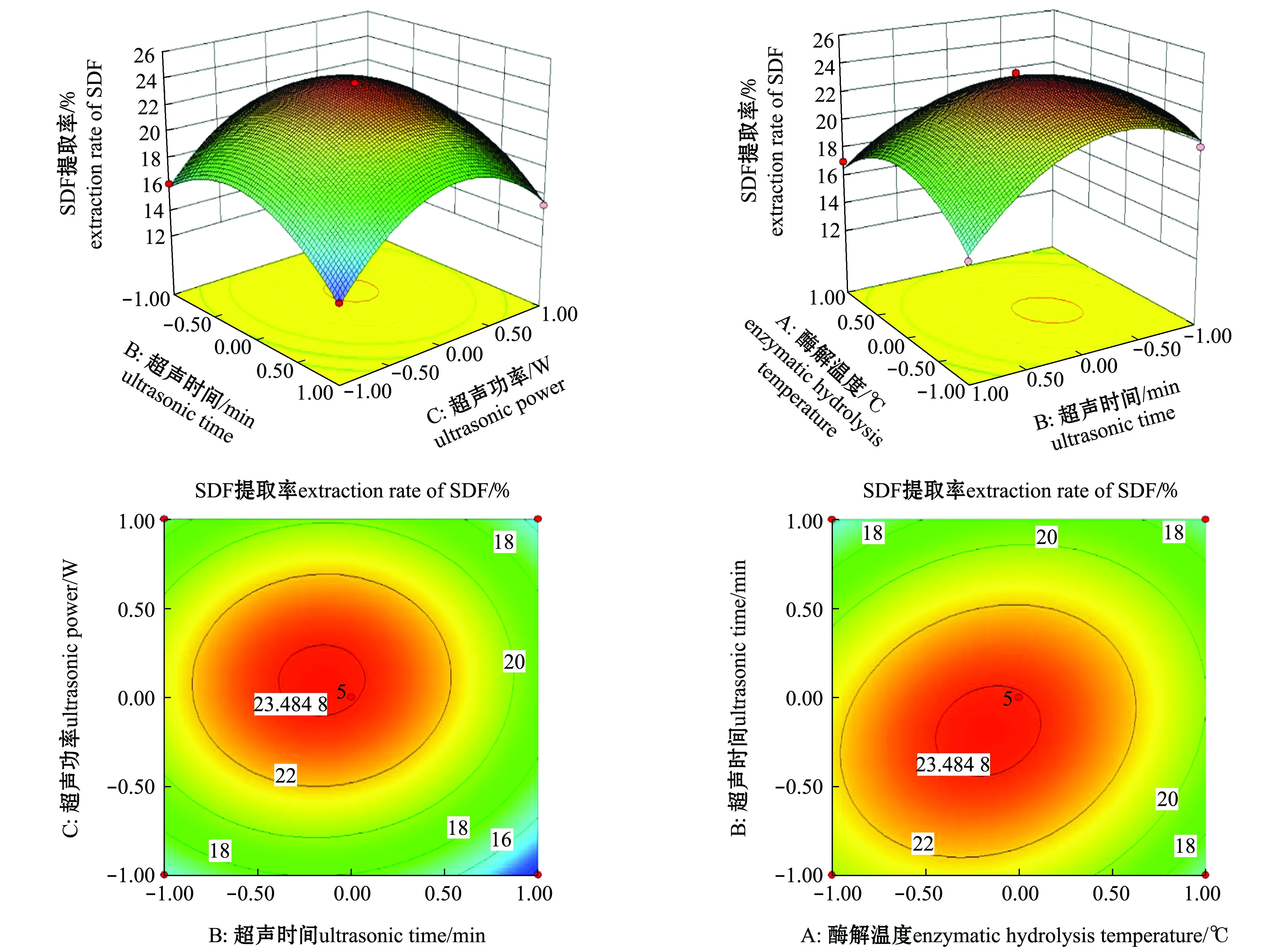
图6 交互作用的响应面图和等高线图
2.2.3 模型验证 利用软件分析得出的最佳提取条件是酶解温度48.28 ℃、超声时间38.15 min、超声功率459.23 W,最佳提取率为23.75%,与单因素试验得出的最佳提取条件酶解温度50 ℃、超声时间40 min、超声功率450 W,最佳提取率为20.01%相比,单因素试验高出软件分析值2.80%,为了验证试验的可行性,结合实际试验的客观可操作性,按照酶解温度为48 ℃、超声时间为38 min、超声功率为450 W进行3次平行试验,坛紫菜可溶性膳食纤维的提取率为23.96%±0.80%,与模型预测结果基本相同,说明该模型能够较好地模拟坛紫菜水溶性膳食纤维的提取过程和预测膳食纤维的提取率。
2.3 坛紫菜SDF的理化性质
对提取获得的坛紫菜SDF理化性质的测定结果如表4所示,坛紫菜SDF的持水率为(4.68±0.08)g/g,膨胀力为(2.11±0.11) mL/g,说明SDF具有良好的持水性和膨胀能力,SDF的阳离子交换力为(1.28±0.13)mmol/g,说明SDF的阳离子交换力良好。

表4 坛紫菜SDF理化性质
2.4 SDF对冻藏鱼糜凝胶强度的影响
不同添加量SDF对冻藏罗非鱼鱼糜凝胶强度的影响结果如图7所示,各组罗非鱼鱼糜凝胶强度随冻藏时间的延长呈下降的趋势,空白组凝胶强度从4 501.22 g·mm下降至920.11 g·mm,降幅为79.55%,其中添加了SDF的鱼糜组,从第2周到第6周下降速率变缓,之后下降速率加快,SDF组中凝胶强度降幅最小为0.2%添加量组,凝胶强度从4 512.05 g·mm下降至2 201.11 g·mm,降幅为51.21%,0.1%及0.3%添加量组鱼糜凝胶强度降幅分别为53.44%、55.69%。膳食纤维因其具有良好的持水性,能够较好地吸收鱼糜中一部分水,使冻藏过程中冰晶的形成减少,鱼糜蛋白能够形成良好的空间结构,从而减缓凝胶强度的衰退[22]。因此,添加质量分数为0.2% 的SDF可有效抑制冻藏期间罗非鱼鱼糜凝胶强度下降的程度,提升冷冻鱼糜品质。
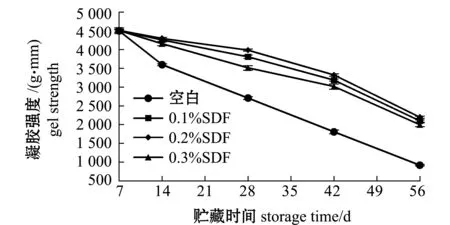
图7 坛紫菜SDF对冻藏罗非鱼鱼糜凝胶强度的影响
2.5 添加SDF的冻藏鱼糜扫描电镜观察
对冻藏8周后不同SDF添加量的罗非鱼鱼糜进行扫描电镜观察,结果如图8所示,空白组鱼糜凝胶结构组织松散,间隙较大,而添加SDF组的鱼糜凝胶结构肌原纤维较为聚集,组织结构较为致密,说明添加SDF对罗非鱼鱼糜凝胶能起到增加空间结构的作用。当SDF添加量为0.2%时,鱼糜凝胶结构肌原纤维最为聚集,组织最为致密,优于0.1%和0.3%添加组,由扫描电镜结果观察可知,不同SDF添加量对罗非鱼鱼糜凝胶空间结构组织致密性影响效果排序为0.2%添加组>0.1%添加组>0.3%添加组>空白组,该结果与前述不同SDF添加量对罗非鱼鱼糜凝胶强度的影响结果一致。
3 讨论
3.1 超声波辅助对坛紫菜SDF提取率的影响
本研究表明,采用超声波辅助复合酶(α-淀粉酶、糖化酶、中性蛋白酶)从坛紫菜中提取的SDF,经响应面Box-Behnken法优化后,极大地提高了SDF提取率,当按照添加量为1.0%配制复合酶,在超声功率450 W、酶解温度50 ℃、超声时间40 min条件下,得到最优提取率为23.96%±0.80%。本研究团队赖蓓蕾等[17]之前以坛紫菜为原料,采用淀粉酶、纤维素酶、中性蛋白酶复合酶法提取SDF,在酶添加量1.1%、酶解温度55 ℃条件下,得到SDF最优提取率为9.80%±0.12%。在此基础上,本试验中采用超声波破碎仪辅助对坛紫菜进行预处理,破坏原料细胞结构,使酶能够尽可能地接触反应底物,显著提高了提取效率,通过响应面试验分析,最终SDF提取率达到23.96%±0.80%。但本试验中还发现,使用超声波破碎装置时间和功率不宜过长和过大,当超声功率大于450 W、超声时间大于40 min后,SDF提取率明显降低,这说明超声波破碎装置在对坛紫菜细胞结构进行破碎完全后,随着功率加大和时间延长,也会对SDF结构有破坏作用,形成小分子物质,从而不被醇沉下来收集到,还有可能是超声波使水产生自由基,引起氧化还原反应[22],使得部分酶失去活性反应无法顺利进行,从而导致提取率降低。
3.2 坛紫菜SDF的理化性质
SDF持水性、膨胀力、持油性及阳离子交换力可较好地反映膳食纤维生理功能[23]。SDF的持水性和膨胀力可以增加饱腹感,使人体不易感到饥饿,并且还具有加速排便的效果,减少毒素在人体的滞留时间[24]。因SDF在肠道中可以吸附油脂,且能够在一定程度上起到保护肠道的作用[23],持油性的强弱取决于SDF表面的亲油基团,亲油基团越多持油性越强。SDF化学结构中含有羧基和羟基类等活性基团,可与阳离子进行交换,当SDF进入肠道后,可与肠道中Na+、K+离子交换,降低其在血液中的含量,起到降低血压的效果[25]。
在本试验条件下提取的SDF持水性为(4.68±0.08)g/g,膨胀力为(2.11±0.11)mL/g,持油率为(3.06±0.05)g/g,阳离子交换力为(1.28±0.13)mmol/g,在理化性质上优于赖蓓蕾等[17]采用淀粉酶、纤维素酶、中性蛋白酶复合酶法提取的坛紫菜SDF(持水性为2.76 g/g,膨胀力为1.97 mL/g),但与其他藻类膳食纤维理化性质相比略低,如谭姣姣等[26]测定海带中膳食纤维的持水力为2 450%,膨胀力为50 mL/g;戚勃等[27]测定江蓠藻中膳食纤维持水力为541.6%,膨胀力为10.21 mL/g。原因可能是不同藻类膳食纤维组成成分不同,形成不同的空间结构,从而表现出不同强弱的理化性质[28]。一般来说,藻类物质提取的膳食纤维理化性质是强于谷类和水果中膳食纤维的[29]。周淑仪等[19]以百香果果皮为原料,采用纤维素酶酶法提取的SDF持油率为(0.88±0.08)g/g,阳离子交换力为(1.04±0.05)mmol/g;仝文玲等[23]以碱法提取的胡麻渣SDF持水性为(4.65±0.18)g/g,膨胀力为(9.31±0.14)mL/g,持油率为(1.85±0.17)g/g,阳离子交换力为(0.06±0.05)mmol/g。这说明,本试验中采用超声波辅助酶法提取坛紫菜SDF,不仅提高了提取效率,也提升了SDF理化性质,反映出提取的坛紫菜SDF品质良好。
3.3 坛紫菜SDF对鱼糜冻藏过程凝胶强度的影响
鱼糜制品在冻藏过程中,随着冻藏时间的延长,会产生大量的冰晶,引起蛋白质空间结构与疏水性发生变化,导致蛋白质变性,因此,凝胶强度会显著地减弱[30]。本研究中将不同量的坛紫菜SDF添加至罗非鱼鱼糜中,并考察其对罗非鱼糜冻藏过程中凝胶强度的影响,结果表明,相比于空白组,SDF各组凝胶强度衰退程度均较小,这也与孟爽爽[15]将麸皮膳食纤维加入白鲢鱼糜后冻藏过程中测定的凝胶强度结果一致,空白组第1周凝胶强度与SDF组相差不大,之后呈直线下降,说明SDF组在抵抗凝胶强度衰退上是有良好效果的,而之所以SDF具有较好的抗冻性,应该与鱼糜凝胶空间结构交联有关,空白鱼糜主要是水、蛋白质两者相互结合形成的较单一的空间交联结构,而添加了SDF的鱼糜组,在空白组的基础上会形成水、蛋白质、纤维三者相互交联的多种空间构造[30],使得凝胶结构更为紧实致密,从而使凝胶强度得到提升。此外,不仅SDF添加量对鱼糜凝胶强度有影响,SDF粒径过大也会造成鱼糜凝胶强度下降。涂晓琴[31]使用大豆膳食纤维添加到白鲢鱼糜中,当粒径大于245 μm时,凝胶强度下降至空白组一半左右,而本试验中SDF制备过程中均过245 μm筛网,贮藏末期每组的凝胶强度均是空白组的2倍以上。
扫面电镜试验结果表明,与空白组相比,SDF添加组鱼糜凝胶空间结构致密、均匀,这与张花[32]对鱼糜进行的扫描电镜结果相似,鱼糜凝胶空间构造的致密和均匀程度依次为添加量0.2%SDF>0.1%SDF>0.3%SDF,鱼糜致密均匀的空间结构,有助于凝胶化后水分及凝胶强度的保持,扫面电镜结果与鱼糜凝胶强度的测量结果相同。
袁悦[20]在基于植物多酚与多糖的新型冷冻罗非鱼鱼糜抗冻剂的抗冻效果研究中表明,添加4%蔗糖、4%山梨醇和0.3%多聚磷酸盐混合物的商业抗冻剂的罗非鱼鱼糜在10周贮藏期间,凝胶强度下降幅度为43.5%,商业抗冻剂抗冻效果略优于0.2%的坛紫菜SDF(降幅为51.21%)。本研究中坛紫菜SDF添加量仅为0.2%,且为单一组分,与以高热量的蔗糖、山梨醇等为主的传统商业抗冻剂相比,膳食纤维除具有添加量低、热量值低且对鱼糜制品风味影响较小的优点外,还具有较好的生理功能特性,不仅能改善肠道菌群环境,还具有降血糖[33]及预防心血管疾病等生理活性,具备成为开发新型冷冻鱼糜抗冻剂配方的潜力,在鱼糜产业中的应用前景广阔。
4 结论
1) 本研究中采用的超声波辅助酶法提取坛紫菜SDF,在单因素试验基础上,设置响应面试验优化SDF提取条件,得到最佳提取条件为酶解温度50 ℃、超声功率450 W、超声时间40 min,在此条件下坛紫菜可溶性膳食纤维提取率为23.96%±0.80%,有效提高了SDF的提取率。
2) 测定提取的SDF理化性质,其持水率为(4.68±0.08)g/g,膨胀力为(2.11±0.11) mL/g,持油率为(3.06±0.05)g/g,且阳离子交换力良好,为(1.28±0.13)mmol/g,与他人提取的同类型膳食纤维理化性质结果相比,本试验中提取的膳食纤维理化性质均表现优良,更优于果蔬类膳食纤维的理化性质,而与部分藻类的膳食纤维相比则略显不足,可能是由于不同藻类间的膳食纤维组成成分不同所致。
3) 将提取的SDF应用在罗非鱼鱼糜中,通过8周的冻藏试验,测定其凝胶强度并进行扫面电镜观察,结果显示,添加SDF的鱼糜凝胶空间结构致密、均匀,明显可以改善鱼糜的凝胶强度,缓解凝胶强度衰减,特别是添加量为0.2%的SDF,鱼糜凝胶空间结构最为致密、均匀,抵抗凝胶强度衰减效果最为明显,且与其他在鱼糜中同样添加膳食纤维并进行冻藏的结果相比较,本试验中提取的SDF效果更为优良。
