基于Bcl-2/Bax/Caspase-3信号通路探讨三七总皂苷对自身免疫性心肌炎模型大鼠心肌凋亡影响的研究
2021-11-16周雪
周 雪
(沈阳医学院附属第二医院,辽宁 沈阳 110000)
1 材料与方法
1.1 材 料
1.1.1 研究对象:Lewis大鼠55只,SPF级,均为雄性,周龄为8周,体重200~220 g,平均(213.24±4.66) g,由广东省医学实验动物中心提供[许可证号:SCXK(粤)2018-0002]。饲养在动物房中,温度21~23 ℃,相对湿度50%~60%,定时通风换气保持空气洁净,噪音<50 dB,大鼠于笼内自由活动进食,饲以全价营养颗粒饲料和无菌过滤水,定期打扫鼠笼并消毒。饲养5 d使其适应环境。
1.1.2 主要药品与试剂:纯化猪心肌肌球蛋白,美国Sigma公司产品,采用0.3 mol/L氯化钾溶液溶解并配制为浓度10 mg/ml的猪心肌肌球蛋白溶液,-80 ℃保存备用;完全弗氏佐剂,美国Sigma公司产品;灭活结核杆菌H37Ra,购自碧迪医疗器械(上海)有限公司。三七总皂苷,CAS号:88105-29-7,纯度:UV≥95%,货号:YDS0054,规格:每瓶10 mg,购自无锡云萃生物科技有限公司,用蒸馏水溶解制成三七总皂苷溶液,浓度分别调整成10、20 mg/ml;甲氨蝶呤片,规格:每片2.5 mg,国药准字H31020644,批号:20190112,上海上药信谊药厂有限公司生产,使用时采用蒸馏水溶解配制成浓度为0.1 mg/ml的甲氨蝶呤混悬液,现用现配。苏木素伊红(HE)染色试剂盒、TUNEL细胞凋亡检测试剂盒(一步法)、4’,6-二脒基-2-苯基吲哚(4’,6-diamino-2-phenylindole,DAPI)染色液,购自南京凯基生物科技发展有限公司;RIPA裂解液(含苯甲基磺酰氟)、磷酸盐缓冲液(Phosphate buffer,PBS)、TBST缓冲液,购自北京索莱宝科技有限公司;二喹啉甲酸(Bicinchoninic acid,BCA)法蛋白定量检测试剂盒、SDS-PAGE凝胶制备试剂盒,购自福州飞净生物科技有限公司;Bcl-2、Bax、Caspase-3免疫组化试剂盒、二氨基联苯胺(DAB)法显色试剂盒,购自北京伊塔生物科技有限公司;兔抗Bcl-2、Bax、Caspase-3、肌动蛋白(β-actin)多克隆抗体、山羊抗兔二抗、ECL发光试剂盒,购自翌圣生物科技(上海)有限公司。
1.1.3 主要仪器设备:超高分辨率小动物超声影像系统(加拿大Visual Sonics,Vevo2100型);离心机[德国Hettich,Universal 320(R)型];光学显微镜(日本Nikon,Eclipse Ci型);倒置式荧光显微镜(日本Nikon,Ti-E型);电泳仪(美国Bio-rad,Power Pac 3000型);全自动图像工作站(美国Kodak,IS4000R型)。
1.2 实验方法
1.2.1 造模及实验方法[6]:大鼠分成对照组(n=11)和造模组(n=44)。将10 mg/ml的猪心肌肌球蛋白溶液与完全弗氏佐剂(含灭活结核杆菌H37Ra 10 mg/ml)等体积混匀,在4 ℃条件下反复进行抽推,制成油包水状态黏稠乳浊液,且经鉴定乳化完全。分别于第1天、第8天,造模组大鼠给予猪心肌肌球蛋白乳浊液0.2 ml后足垫皮下注射,对照组给予完全弗氏佐剂0.2 ml后足垫皮下注射;继续喂养3 周,采用超声心动图检测大鼠心功能以明确是否成功建立实验性自身免疫性心肌炎模型。
模型建立成功的大鼠被分成模型组、三七总皂苷低、高剂量组和甲氨蝶呤组各11只。模型组、对照组分别灌胃给予蒸馏水10 ml/kg,每日1次;三七总皂苷低、高剂量组分别灌胃给予10、20 mg/ml三七总皂苷溶液10 ml/kg,每日1次;甲氨蝶呤组灌胃给予0.1 mg/ml甲氨蝶呤混悬液10 ml/kg,每周1次。各组大鼠均连续给药4周。
(1)信息的沟通应该涵盖各个单位的各个层次人员的交流。比如设计工程师、建设单位专业人员以及施工单位、监理人员与专业监理工程师的交流与沟通。信息沟通的工作可以以监理会议纪要、监理月报等形式进行。对项目的全过程进行监理控制,是为了使全过程成为一个有机的整体。依据施工中的不同环节的工作内容和特点制定不同的管理手段和措施,使各个工作能够环环相扣,这是监理工程师在对项目的全过程进行监理的重要方式。
1.2.2 超声心动图测定大鼠心功能[6]:末次给药12 h后,采用异氟烷吸入麻醉大鼠,仰卧位固定于检查台,胸前区常规备皮,用小动物超声影像系统行超声心动图检查,测定左室舒张末内径(Left ventricular end diastolic diameter,LVIDd)、左室收缩末内径(Left ventricular end systolic diameter,LVIDs)、左室射血分数(Left ventricular ejection fraction,LVEF)及左室短轴缩短率(Left ventricular short axis shortening rate,LVFS)。
1.2.3 标本采集与处理:超声心动图结束后,采用10%水合氯醛4 ml/kg腹腔注射麻醉大鼠,然后打开胸腔,将心脏完整取出,分离心尖组织,用10%甲醛固定,经脱水、透明、石蜡包埋之后,用全自动切片机连续切制2 μm切片,贴于防脱载玻片上(经3-氨基丙基三乙氧基硅烷处理),37 ℃干燥16 h后室温保存,以备HE染色、TUNEL染色、免疫组化染色观察;其他心肌组织用液氮速冻,转移至-80 ℃冰箱,以用于Western blot法检测。
1.2.4 HE染色法观察心肌组织病理学变化[7]:取心肌组织切片,常规脱蜡水化,按照HE染色试剂盒说明书操作,依次采用苏木素染色5 min、自来水洗片1 min、1%盐酸酒精分化20 s、自来水洗片10 min、自来水返蓝30 min、自来水洗片10 min、1%伊红染色3 min、自来水洗片30 s,之后将切片分别浸入70%、80%、90%、95%酒精5 min以脱水、浸于二甲苯Ⅰ、Ⅱ溶液内分别5 min以透明,晾干,中性树脂封片。
于200倍显微镜下,每张切片随机采集5个不重复视野,根据炎症浸润程度对心肌组织进行病理学评分。标准为,0分:无炎症细胞浸润;1分:炎症细胞浸润面积不足5%;2分:5%≤炎症细胞浸润面积<10%;3分:10%≤炎症细胞浸润面积<20%;4分:炎症细胞浸润面积≥20%;各视野评分平均值即为该切片心肌组织病理学评分。
1.2.5 TUNEL染色法观察心肌组织细胞凋亡情况[8]:取心肌组织石蜡切片,常规脱蜡、水化,PBS洗5 min×3次,然后滴加蛋白酶K工作液100 μl,37 ℃反应20 min,PBS洗5 min×3次,滴加DNA酶反应液100 μl,37 ℃反应30 min,按照TUNEL染色试剂盒说明书配制末端脱氧核苷酸转移(TdT)酶反应液,并取50 μl低于切片上,37 ℃湿盒内反应30 min,PBS洗5 min×3次,滴加异硫氰酸荧光素标记的链霉亲和素工作液50 μl,37 ℃湿盒内反应30 min,PBS洗5 min×3次,之后滴加DAPI染色液,室温避光染色5 min,洗去染液后甘油封片。
在荧光显微镜下观察并拍照,凋亡细胞核被染成绿色,正常细胞核被染成蓝色。每张切片随机采集5个未重叠视野,统计凋亡细胞以及总细胞数量,计算凋亡细胞率,各视野平均值即为该切片凋亡细胞率。
1.2.6 免疫组化染色法观测心肌组织Bcl-2、Bax、Caspase-3表达水平[8]:取心肌组织石蜡切片,常规脱蜡、水化,PBS洗5 min×3次,然后置于0.3%过氧化氢中10 min以灭活内源性过氧化物酶,无菌蒸馏水洗3次,置于PBS内微波炉加热煮沸以修复抗原,滴加5%牛血清白蛋白,37 ℃反应30 min,之后参照试剂盒说明书滴加Bcl-2、Bax、Caspase-3一抗,4 ℃反应18 h,PBS洗10 min×3次,滴加生物素标记的山羊抗兔IgG,37 ℃反应30 min,PBS洗10 min×3次之后,用DAB试剂盒显色及苏木素复染,常规封片。
于400倍显微镜下,每张切片随机采集5个未重叠视野,通过Image-pro plus 6.0软件分析各视野细胞阳性率,计算平均值。
1.2.7 Western blot法检测大鼠心肌组织Bcl-2、Bax、Caspase-3蛋白表达水平[8]:将-80 ℃保存的心肌组织剪碎,与RIPA裂解液混合,冰上静置10 min,充分研磨后采用超声破碎仪破细胞壁,4 ℃,14000 r/min×10 min离心,取上清液,用BCA蛋白定量试剂盒测定蛋白浓度;然后配制SDS-PAGE分离胶和积层胶,放入电泳槽内;取适量蛋白质样品与5×上样缓冲液4∶1混匀,于沸水中处理20 min使蛋白变性;上样,电泳(恒压80 V 25 min,恒压120 V 90 min)至溴酚蓝跑到分离胶下缘;将目的蛋白转至硝基纤维素(NC)膜上,5%脱脂牛奶摇床封闭1 h,NC膜放入1∶1000稀释的Bcl-2、Bax、Caspase-3、β-actin一抗中,4 ℃反应16 h后,TBST洗10 min×3次;NC膜置于羊抗兔二抗工作液(1∶2000稀释)内,37 ℃反应1 h后,TBST洗10 min×3次;最后采用ECL发光试剂盒显影。
采用全自动图像工作站采集图像,对分离获得的蛋白条带的灰度值进行分析,计算Bcl-2、Bax、Caspase-3蛋白相对内参β-actin的表达量。
1.3 统计学方法 采用SPSS 22.0统计学软件进行分析,计量资料以均数±标准差表示,多组之间的比较用单因素方差分析,组间多重比较分析用LSD-t检验。P<0.05表示差异具有统计学意义。
2 结 果
2.1 各组大鼠心功能指标比较 见表1。模型组LVEF、LVFS水平明显低于对照组,LVIDd、LVIDs水平显著高于对照组(P<0.05)。与模型组比较,三七总皂苷低、高剂量组和甲氨蝶呤组大鼠LVEF、LVFS水平较高,LVIDd、LVIDs水平较低,差异有统计学意义(P<0.05),且三七总皂苷干预组呈现一定量效关系。
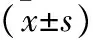
表1 各组大鼠LVIDd、LVIDs、LVEF及LVFS水平比较
2.2 各组大鼠心肌组织病理学观察结果 HE染色结果显示,对照组心肌细胞结构完整,排列规整,极少见炎症细胞浸润;模型组大鼠心肌细胞排列松散,有大量炎性细胞浸润间质、肌束间,存在小血管扩张充血,少量心肌细胞脂肪变性;三七总皂苷低、高剂量组及甲氨蝶呤组心肌细胞排列紧密,炎症细胞浸润情况较模型组不同程度改善,偶见小血管扩张充血,其中三七总皂苷高剂量组及甲氨蝶呤组改善最明显(图1)。

A:对照组; B:模型组; C:三七总皂苷低剂量组; D:三七总皂苷高剂量组; E:甲氨蝶呤组图1 各组大鼠心肌组织病理学改变(HE染色,×200)
2.3 各组大鼠心肌组织病理学评分比较 见表2。模型组的心肌组织病理学评分高于对照组(P<0.05)。与模型组比较,三七总皂苷低、高剂量组和甲氨蝶呤组大鼠心肌组织病理学评分较低,差异有统计学意义(P<0.05),且三七总皂苷干预组呈现一定量效关系。

表2 各组大鼠心肌组织病理学评分比较(分)
2.4 各组大鼠心肌组织细胞凋亡率比较 见表3(图2)。TUNEL染色结果显示,与对照组比较,模型组大鼠心肌组织细胞凋亡率显著升高,差异有统计学意义(P<0.05)。与模型组比较,三七总皂苷低、高剂量组和甲氨蝶呤组大鼠心肌组织细胞凋亡率较低,差异有统计学意义(P<0.05),且三七总皂苷干预组呈现一定量效关系。

表3 各组大鼠心肌组织细胞凋亡率比较(%)
2.5 各组大鼠心肌组织Bcl-2、Bax、Caspase-3表达免疫组化检测水平比较 见表4(图3~5)。免疫组化检测结果显示,模型组心肌组织Bcl-2表达水平低于对照组,Bax、Caspase-3表达水平高于对照组(P<0.05)。与模型组比较,三七总皂苷低、高剂量组和甲氨蝶呤组大鼠心肌组织Bcl-2表达水平较高,Bax、Caspase-3表达水平较低,差异有统计学意义(P<0.05),且三七总皂苷干预组呈现一定量效关系。

A:对照组; B:模型组; C:三七总皂苷低剂量组; D:三七总皂苷高剂量组; E:甲氨蝶呤组图2 各组大鼠心肌组织细胞凋亡情况(TUNEL染色,×200)

表4 各组大鼠心肌组织Bcl-2、Bax、Caspase-3表达免疫组化检测水平比较(%)
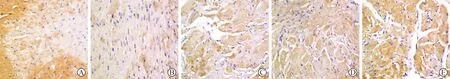
A:对照组; B:模型组; C:三七总皂苷低剂量组; D:三七总皂苷高剂量组; E:甲氨蝶呤组图3 各组大鼠心肌组织Bcl-2表达情况(免疫组化染色,×400)
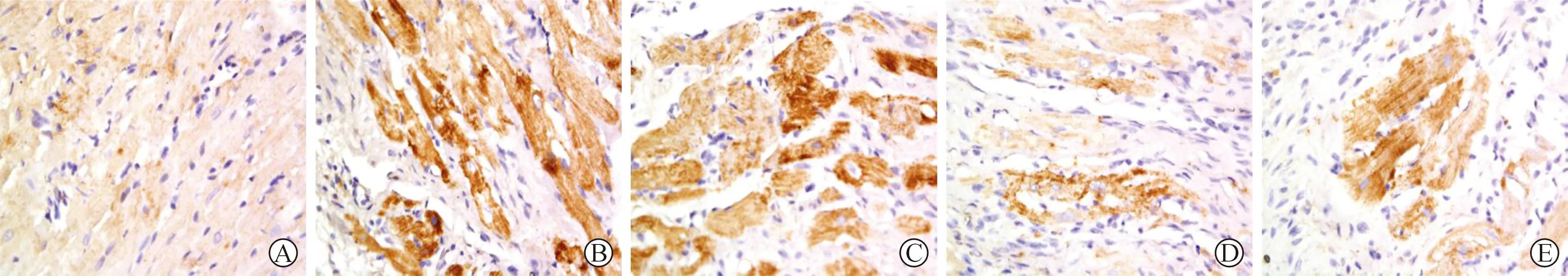
A:对照组; B:模型组; C:三七总皂苷低剂量组; D:三七总皂苷高剂量组; E:甲氨蝶呤组图4 各组大鼠心肌组织Bax表达情况(免疫组化染色,×400)

A:对照组; B:模型组; C:三七总皂苷低剂量组; D:三七总皂苷高剂量组; E:甲氨蝶呤组图5 各组大鼠心肌组织Caspase-3表达情况(免疫组化染色,×400)
2.6 各组大鼠心肌组织Bcl-2、Bax、Caspase-3表达Western blot检测水平比较 见表5(图6)。模型组心肌组织Bcl-2表达低于对照组,Bax、Caspase-3表达水平高于对照组(P<0.05)。与模型组比较,三七总皂苷低、高剂量组和甲氨蝶呤组大鼠心肌组织Bcl-2表达水平较高,Bax、Caspase-3表达水平较低,差异有统计学意义(P<0.05),且三七总皂苷干预组呈现一定量效关系。
表5 各组大鼠心肌组织Bcl-2、Bax、Caspase-3表达水平Western blot检测比较

A:对照组; B:模型组; C:三七总皂苷低剂量组;D:三七总皂苷高剂量组; E:甲氨蝶呤组图6 Western blot法检测大鼠心肌组织Bcl-2、Bax、Caspase-3表达结果
3 讨 论
心肌炎最常见的类型为病毒性心肌炎,该病发生的第一阶段为早期病毒直接刺激心肌细胞导致心肌损伤和功能障碍,第二阶段则是自身免疫阶段,病毒持续感染过度激活机体抗原-抗体反应,肌球蛋白等自身抗原促进B细胞释放抗心磷脂抗体、抗肌球蛋白等自身抗体,使心肌细胞发生免疫损伤,进一步发展为以进行性心衰为特征的DCM,即第三阶段,影响预后[9]。可见,自身免疫反应是诱发DCM的重要机制[10]。有研究称,在自身免疫反应心肌细胞损伤及转变为以进行性心衰为特征的DCM过程中,凋亡起着十分重要的作用[11]。所以,抗细胞凋亡有可能成为减轻免疫性心肌炎损伤,抑制心肌炎发展为DCM的作用靶点之一。中医认为,该病属于“风温”“心悸”“心瘅”“胸痹”等疾病范畴,多因素体虚弱,心气不足,温邪侵袭伤及于心所致,心主血脉,外邪侵袭可使血性不畅,阻于脉内,形成血瘀,需用活血化瘀之法通利血脉,恢复血行。三七味甘、微苦,性温,归心、肝、脾经,有化瘀止血,活血定痛之效,为常用的活血化瘀中药,也是治疗病毒性心肌炎常用的有效单味中药之一。三七总皂苷是三七中三七皂苷R1、人参皂苷Rb1和Rg1等成分的总称,可以发挥抑制炎症反应、免疫调节、延缓纤维化、抑制心肌缺血、抗氧化应激等多方面功效[12-13],在心脑血管系统、免疫系统中的应用较多。有研究发现[14],三七总皂甙可能通过抑制膜型基质金属蛋白酶-1表达,来对病毒性心肌炎小鼠发挥治疗作用;有学者[15]进行的体外研究则认为,三七总皂苷通过调控Bcl-2/Bax表达来抑制血管紧张素Ⅱ诱导的心肌细胞凋亡,起到心肌损伤保护作用。这些研究的结果为本次研究三七总皂苷对EAM大鼠Bcl-2/Bax/Caspase-3信号通路的影响提供了一定的理论支持。
EAM动物模型是研究自身免疫性心肌炎及病毒性心肌炎自身免疫反应发病机制、诊断、治疗等的重要基础,常用的诱导方法有心肌自身抗原、心肌自身抗原表位、活化自身免疫细胞等[16],不同的诱导方式在病理改变和病情严重程度方面有所差异。有日本学者采用猪的心肌球蛋白成功诱导了EAM大鼠模型[17],其发展进程与人巨细胞性心肌炎类似,且可进展为DCM,是较为理想的模型。本次研究即采用这种方法,给予Lewis大鼠纯化的猪心肌肌球蛋白乳浊液皮下注射,结果发现,模型组大鼠心功能指标LVEF、LVFS水平明显降低,LVIDd、LVIDs水平显著升高,HE染色结果也显示心肌大量炎性细胞浸润间质、肌束间,存在小血管扩张充血,提示EAM模型建立成功,而经三七总皂苷干预后,上述的心功能指标均得到明显改善,心肌组织病理学评分也较模型组显著降低,表明三七总皂苷确实能够减轻EAM大鼠炎症改变,促进心脏功能恢复,并且治疗作用与药物剂量有关。
细胞凋亡是引起心肌损伤的方式之一。细胞凋亡涉及到内源性、外源性两条重要的途径,其中Bcl-2蛋白家族主要调控的线粒体介导内源性凋亡途径在细胞凋亡研究中最受重视。Bcl-2蛋白家族包括两类蛋白,Bcl-2主要在神经和淋巴系统表达,具有抑制细胞凋亡的作用;而Bax在各种组织广泛表达,不仅能拮抗Bcl-2抑制凋亡的作用,还能直接加速细胞凋亡。有研究称[18-21],免疫性心肌炎过程中有心肌细胞凋亡存在,而多种心脏病心肌细胞凋亡的调控与Bcl-2和Bax有关。本次研究结果中模型组心肌组织Bcl-2表达水平较对照组降低,Bax表达水平和细胞凋亡率较对照组升高也证实了这一观点。Caspase-3为凋亡途径关键效应分子[22-25],两条细胞凋亡途径最后都会引起Caspase-3活化,剪切多聚(ADP-核糖)聚合酶PARP,使核小体间的DNA裂解而引起细胞凋亡,也标志着细胞凋亡浸入不可逆阶段[26-29]。本研究结果显示,与模型组比较,三七总皂苷低、高剂量组和甲氨蝶呤组大鼠心肌组织细胞凋亡率较低,心肌组织Bcl-2表达水平较高,Bax、Caspase-3表达水平较低,且三七总皂苷干预组呈现一定量效关系,表明三七总皂苷能有效促进EAM大鼠心肌组织抗凋亡蛋白Bcl-2表达,抑制促凋亡蛋白Bax、Caspase-3表达,减少心肌细胞凋亡,促进心肌损伤减轻。
综上所述,三七总皂苷能剂量依赖性的改善EAM大鼠心功能,减轻心肌炎症病理变化,抑制细胞凋亡,其作用可能与调节Bcl-2/Bax/Caspase-3信号通路中凋亡相关蛋白表达有关。
