基于BDNF-Trk B信号通路探讨和血生络方对脑缺血大鼠认知功能的影响及机制研究
2021-11-16倪广晓段春巧周宏斌王晓青
倪广晓,段春巧,周宏斌,孟 然,王晓青,王 璞
(河北医科大学第二医院,河北 石家庄 050000)
脑卒中已经成为导致人类死亡的首位因素,其中缺血性脑卒中约占80%左右,其带来的功能障碍严重影响生存质量[1]。神经再生是恢复缺血性脑卒中后神经功能障碍的关键,神经功能的改善是以认知功能的恢复为基础的,因此,改善脑缺血损伤后的认知功能成为关注的焦点,认知功能主要包括记忆、学习、空间感知等[2-4]。在成年哺乳动物及人类中,海马齿状回颗粒细胞下层也是神经再生的主要区域之一[4-5]。在齿状回颗粒细胞下层神经干细胞能够维持不断的自我更新、增殖,分化为成熟神经细胞,维持大脑功能的正常运转[5-7]。脑缺血损伤能够刺激齿状回颗粒细胞下层内源性神经再生[8-9],然而这种内源性的神经再生对于弥补神经功能缺损还是杯水车薪。因此,促进内源性神经再生成为研究的热点。本课题组的前期研究发现和血生络方能够对脑缺血再灌注损伤大鼠发挥脑保护作用,并促进脑缺血再灌注损伤后的血管新生[10]。前期的临床研究表明和血生络方能够改善缺血性脑卒中患者的肢体运动功能和平衡功能,并且能够促进外周血中脑源性神经营养因子(BDNF)的表达[11]。BDNF在中枢神经系统与其特异性受体酪氨酸激酶受体B(Trk B)结合,BDNF-Trk B信号通路与大脑中神经再生过程密切相关。在此基础上,我们通过建立脑缺血大鼠模型,进一步探讨和血生络方是否通过调控BDNF-Trk B信号通路促进脑缺血后齿状回颗粒细胞下层神经再生从而改善认知功能障碍。
1 材料与方法
1.1 实验动物 SPF级成年雄性SD大鼠,体重260~280 g,购自北京维通利华实验动物技术有限公司,动物合格证号:SCXK(京)2016-0011。实验室通风良好,维持室温(22±3)℃、相对湿度(60±5)%,大鼠自由进食水及活动,适应性饲养7 d后开始实验。
1.2 和血生络方制备 和血生络方组成及制备:黄芪、人参、天麻、川芎、当归、丹参、红景天、白芍、熟地、黄芩,以8∶1∶2∶1.5∶2∶1∶2∶1.5∶1∶1的干重比例混合,制备成浓缩水提液,终浓度2 g/ml,4 ℃冰箱保存。根据《药理实验方法学》中人与大鼠体表面积折算等效剂量比值为0.018换算公式drat=dhuman×0.018/0.2 kg,我们确定大鼠的剂量为18.9 g/(kg·d)。大鼠于造模麻醉清醒后开始灌胃给药。
1.3 主要仪器 SW-CJ-2FD 型超净工作台,Kopf 脑立体定位仪,Morris 水迷宫(上海吉量软件科技公司);Olympus 生物显微镜IX73型、低温离心机5417R型、Bio-Rad定量PCR 仪;Bio-Rad 电泳仪、Bio-Rad 半干转膜仪及UVP 凝胶成像系统。
1.4 试剂和药品 5-溴脱氧尿嘧啶核苷(Brd U)(Sigma公司);兔抗巢蛋白(Nestin)多克隆抗体(Abcam公司);大鼠抗双皮质素(DCX)多克隆抗体(Santa Cruz Biotechnology 公司);兔抗Trk B 单克隆抗体(Abcam公司);大鼠抗5-溴脱氧尿嘧啶核苷(Brd U)单克隆抗体(Bio Legend公司);BDNF单克隆抗体(Proteintech公司);Dy Light 488标记山羊抗兔IgG(Abbkine公司);Dy Light 549 标记山羊抗大鼠IgG(Abbkine 公司);兔抗β-actin多克隆抗体(万类生物科技公司)。
1.5 实验方法
1.5.1 动物模型制作:参照改良Zea-Longa大脑中动脉缺血造模方法(MCAO)。具体步骤如下:麻醉成功后将大鼠仰卧位固定于操作台上。颈部备皮,常规消毒铺手术巾,取颈部正中切口,长约1 cm,切开皮肤,钝性分离颈部筋膜及颈阔肌,小心分离胸锁乳突肌和胸骨舌骨肌,显露右侧颈三角,暴露右颈总动脉,仔细游离右侧颈总动脉(CCA)及迷走神经。将颈外动脉(ECA)远心端结扎,近心端轻轻结扎备用,在距CCA分叉近端0.5 cm处动脉夹完全夹闭CCA,动脉夹完全夹闭颈内动脉(ICA),沿着ECA远端结扎处剪以V型小口,将ECA残端沿着ICA拉直,将一根直径0.2 mm头端圆钝尼龙丝线插入动脉,经颈总动脉分叉处通过颈内动脉入颅至大脑中动脉的起始部以阻断大脑中动脉血流,插入深度为(18.5±0.5) mm,结扎ECA进线处,放松CCA动脉夹,止血,缝合皮肤,外留1 cm长线栓,将大鼠侧卧置于笼内,保证大鼠可以自由摄食水。大鼠清醒前均给予白炽灯(100 W)照射,保持肛温36 ℃左右。假手术组只分离、暴露血管,不做任何损伤血管操作。和血生络方+抑制剂组先将大鼠麻醉,固定并进行右侧侧脑室立体定位灌注(以前囱为基点,前:0.8 mm,右侧:1.5 mm,深:3.5 mm),采用微量注射器20 min匀速注入5 μl k252a(k252a溶于1% 二甲基亚砜溶液中稀释至浓度为25 mmol/L)。注射完毕后,将针头与注射器留置2 min,取下针头,用骨蜡封闭颅骨孔,缝合皮肤,然后行MCAO操作。
1.5.2 MCAO大鼠模型的评价:参照“Zea-Longa”评分标准进行神经功能缺损评分,0分:无神经功能缺损;1分:病灶对侧前爪不能完全伸展;2分:向病灶对侧自发性旋转;3分:向病灶对侧倾倒;4分:无自发性行走且出现意识丧失。1~3分者视为有效模型,0分及4分者予以剔除,动物出现死亡及造模不成功时随时进行补充。
1.5.3 动物分组:假手术组动物接受假手术和等体积的0.9%氯化钠溶液;模型组:动物接受MCAO处理;和血生络方组:动物接受MCAO处理;和血生络方+抑制剂组:动物接受脑室注射k252a后行MCAO处理。k252a是BDNF-Trk B信号通路的特异性抑制剂[12],它通过降低Trk B磷酸化水平并抑制BDNF的分泌,从而使神经干细胞的增殖减少[13]。高浓度k252a可抑制BDNF-Trk B信号通路,低浓度k252a可促进内源性BDNF分泌[13]。本实验采用5 μl高浓度k252a注入大鼠侧脑室。
1.5.4 给药方法和途径:假手术组和模型组灌胃0.9%氯化钠溶液4 ml/(kg·d),1次/d,共14 d。和血生络方组与和血生络方+抑制剂组灌胃给予和血生络方18.9 g/(kg·d),1次/d,共14 d。MCAO术后,给予腹腔注射Brd U 50 mg/(kg·d),连续14 d,假手术组大鼠也给予相同操作。
1.6 检测指标
为了满足能耗越小、旅行时间差越小和个体适应度越大的需要,选择以下适应度函数Fit进行多列车遗传优化算法的研究:
1.6.1 脑梗死体积百分比测定:采用TTC染色法测定脑梗死体积。分别于MCAO术后(Post MCAO day,PMD) 1、3、7 d进行,将大鼠麻醉后断头并快速完整取出脑组织。将取出的脑组织放入-20 ℃冰箱中冷冻10 min,然后从额极开始连续等距切取5个冠状脑片(厚度2 mm),置于2%的TTC染色溶液中避光孵育15 min。待脑片均匀着色后放入4%多聚甲醛溶液中固定24 h。数码相机拍照,然后应用Image-Pro Plus 5.1软件进行图像分析。计算水肿修正后梗死体积百分比(%)= [总梗死体积-(梗死侧半球体积-梗死对侧半球体积)]/梗死对侧半球体积×100%[14]。
1.6.2 mirror水迷宫实验:所有大鼠在MCAO术后第3天开始进行水迷宫实验。水迷宫为直径145 cm圆柱形水池,水温保持在(22±0.5) ℃,保持周围环境安静。第1天为适应性训练,第2~5天作为正式实验。
1.6.3 定位巡航行实验:每日上午同一时间点将大鼠从4个不同象限放入水中,训练4次,每次间隔15~20 min,连续5 d。检测时间设置为60 s,记录大鼠寻找并爬上柱状平台的时间(逃避潜伏期)。每日计算各组大鼠从4个不同象限入水的逃避潜伏期的平均值。
1.6.4 空间探索实验:在定位巡航行实验结束后,移除柱状平台,将大鼠从东南象限池壁弧形中点放入水中,记录各组大鼠在120秒内穿越柱状平台位置的次数。
1.6.5 免疫荧光染色:在PMD3、PMD7、PMD14,大鼠麻醉后灌注取脑,经多聚甲醛固定后蔗糖溶液梯度脱水,冰冻切片机进行连续冰冻切片,片厚10 μm。切片在4 ℃下用以下一抗孵育过夜:山羊抗Nestin(1∶50)、山羊抗DCX(1∶100)和小鼠抗Brd U(1∶150),在4 °C下过夜。然后在暗室内加入Dylight 488大鼠抗山羊(1∶200)和Dylight 594 IgG兔抗小鼠(1∶200)孵育2 h后DAPI重染细胞核。显微镜观察齿状回颗粒细胞下层Brd U+/Nestin+和Brd U+/DCX+细胞表达并拍摄图像。用Image-Pro Plus 6.0软件对图像进行分析。
1.6.6 细胞计数:由1名对实验设计不了解的观察者进行细胞计数。应用Olympus共焦激光扫描显微镜在放大400倍条件下分析双标切片。每个切片中随机选择10幅图像,间隔大于1 μm,用Image J软件对Brd U+/Nestin+细胞和Brd U+/DCX+细胞进行计数,并计算每幅图的平均数。
1.6.7 逆转录定量PCR(RT-PCR) 检测齿状回颗粒细胞下层中Nestin、DCX、BDNF和Trk B的mRNA表达:在PMD3、PMD7、PMD14,将大鼠麻醉后迅速断头取脑,于冰上分离出齿状回颗粒细胞下层组织,保存液氮之中。冷冻后的齿状回颗粒细胞下层组织用1 ml三唑试剂和超声仪匀浆。将匀浆在室温下孵育5 min以分离核蛋白复合物。然后加入0.2 ml氯仿,剧烈摇晃匀浆,室温孵育5 min,然后在4 ℃10000 g离心10 min,将含有RNA的水相与0.5 ml异丙醇混合,室温下孵育10 min,在4 ℃下10000 g离心10 min,再悬浮于75%乙醇中,3500 g于4 ℃离心5 min,干燥后溶于20 μl 0.1%DEPC水(用焦碳酸二乙酯处理过并经高温高压消毒的去离子水,其pH值约为7.4)中。室温下加入30 μl无核糖核酸酶ddH2O 2 min,混匀,沉淀完全溶解,得到样品总RNA。逆转录为cDNA 后,以β-actin 为内参,在实时荧光定量PCR仪上扩增进行反应,引物序列见表1,引物由生工生物工程(上海)有限公司合成。记录CT值作为统计参数,用比较2-△△CT法计算mRNA相对表达水平。

表1 基因及其引物序列
1.7 统计学方法 采用SPSS 18.0统计学软件进行分析。计量资料以均数±标准差表示,用t检验。P<0.05表示差异具有统计学意义。
2 结 果
2.1 和血生络方对MCAO大鼠脑梗死体积的影响 见表2。 TTC染色结果分析显示,在PMD1和PMD3,接受和血生络方治疗的MCAO大鼠的脑梗死体积明显小于模型组大鼠(均P<0.05)。在PMD1、PMD3和PMD7,和血生络方组、和血生络方+抑制剂组的脑梗死体积比较无统计学差异(均P>0.05)。

表2 各组大鼠脑梗死体积比较(mm3)
2.2 和血生络方对MCAO大鼠认知功能的影响 水迷宫实验结果显示随着训练天数的增加,各组大鼠的逃避潜伏期逐渐缩短。与模型组比较,和血生络方组大鼠在第2、3、4、5 天的逃避潜伏期均显著缩短(P<0.05)。并且,和血生络方组大鼠逃避潜伏期也显著低于和血生络方+抑制剂组(P<0.05)。空间探索实验结果显示模型组大鼠穿越平台次数较假手术组显著减少(P<0.05);给予和血生络方干预的MCAO大鼠的穿越平台次数显著增加(P<0.05),而和血生络方+抑制剂组大鼠的穿越平台次数显著低于和血生络方组。见表3。
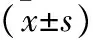
表3 大鼠水迷宫实验结果
2.3 和血生络方对MCAO大鼠齿状回颗粒细胞下层神经再生的影响 见表4(图1~3)。免疫荧光结果显示,在PMD3、PMD7和PMD14,与模型组和和血生络方+抑制剂组比较,和血生络方组显著增加了Brd U+/Nestin+细胞和Brd U+/DCX+细胞在齿状回颗粒细胞下层的表达(P<0.05)。 RT-PCR结果表明,在PMD3、PMD7和PMD14,与模型组相比,和血生络方组大鼠齿状回颗粒细胞下层DCX的mRNA表达水平均显著增高(P<0.05),而和血生络方+抑制剂组DCX的mRNA表达水平均显著低于和血生络方组。Western blot结果显示,在PMD3、PMD7和PMD14,和血生络方组大鼠DCX蛋白表达水平显著高于模型组和和血生络方+抑制剂组,与RT-PCR结果显示出相似的趋势。
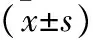
表4 各组大鼠DCX蛋白及DCX mRNA表达水平比较
2.4 和血生络方对BDNF-Trk B-LIMK信号通路表达的影响 见表5、6(图3)。为了进一步明确和血生络方影响脑缺血大鼠齿状回颗粒细胞下层神经再生的机制,应用Western blot和RT-PCR检测MCAO大鼠患侧齿状回颗粒细胞下层组织中BDNF和Trk B表达水平。结果显示,脑缺血后刺激内源性BDNF的表达水平增加。与模型组相比,在PMD3、PMD7和PMD14,和血生络方组显著增加齿状回颗粒细胞下层的 BDNF和Trk B表达(P<0.05),而和血生络方+抑制剂组的BDNF和Trk B表达水平均明显低于和血生络方组(P<0.05)。
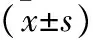
表5 各组大鼠BDNF、Trk B蛋白表达水平比较
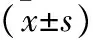
表6 各组大鼠BDNF、Trk B mRNA表达水平比较

A:假手术组;B:模型组;C:和血生络方组;D:和血生络方+抑制剂组。蓝色为细胞核,绿色为Nestin,红色为Brd U,绿色和红色重叠的细胞为Brd U/Nestin+细胞图1 各组大鼠不同时间点齿状回颗粒细胞下层Brd U/Nestin+细胞(免疫荧光染色,×400)

A:假手术组;B:模型组;C:和血生络方组;D:和血生络方+抑制剂组。蓝色为细胞核,绿色为DCX,红色为Brd U,绿色和红色重叠的细胞为Brd U/DCX+细胞图2 各组大鼠不同时间点齿状回颗粒细胞下层Brd U/DCX+细胞(免疫荧光染色,×400)

A:假手术组;B:模型组;C:和血生络方组;D:和血生络方+抑制剂组图3 各组大鼠不同时间点齿状回颗粒细胞下层Nestin、DCX、BNDF、Trk B蛋白表达
3 讨 论
缺血性卒中属于中医学中风病范畴。中医学对中风病的描述最早见于《黄帝内经》,认为中风病的发生与“正气不足,外受风邪”有关。汉代张仲景的中风理论重在外感“虚邪贼风,邪客半身”。唐代以前医家均认为中风病病机为内伤正虚,外风入侵。宋金元时期,风、火、痰、湿“内风”致病论兴起。
而明清时期的中风病病机又发生了变化,《景岳全书·非风》中记载:“内伤积损,颓败而然”,重视内伤导致中风。清代王清任在《医林改错》中记述:“元气既虚,必不能达于血管,血管无气,必停留而瘀”,由此开创了“益气活血”法治疗中风病,对近现代影响较大,近代医家也有许多针对脑卒中病因病机的总结[15]。本研究的和血生络方组方依据《素问·脉要精微论》:“脉为血之府” “血之精为络”和《素问·调经论》:“病在脉,调之血;病在血,调之络”以及《灵枢·本脏》中 “血和则经脉流行”等理论,认为中风病位在脑脉,中风后的病机为气血失和、脑中脉络失于濡养,中风日久,则气血俱虚。治疗应着重养血活血,辅以益气生血行血。因此,提出“和血生络法”治疗中风,和血生络法“生” “通”并用,其中“和血”意在养血、活血,使新血及新络生而瘀血去,益气能够统血固血,使血行有度,新血络的生成也使气行有道。因此,通过养血活血益气,促进中风后脑络损伤的修复和新血、新络的生成,这也与促进脑卒中后侧支循环建立为神经再生搭建桥梁的现代医学研究热点不谋而合。基于上述理论,我们在补阳还五汤的基础上化裁出和血生络方。
认知功能障碍是缺血性脑卒中的常见功能缺陷,认知功能的改善也是神经功能恢复的基础和前提。本研究采用MCAO模型大鼠更接近于临床中的缺血性脑卒中,大脑中动脉供血减少会引起海马神经细胞的凋亡和坏死。海马属于原始皮层,在学习、记忆及空间感知方面发挥重要作用[16-17]。海马的CA1区对缺血缺氧尤其敏感,因此,MCAO大鼠海马CA1区的神经细胞容易出现损伤,并引起一系列神经功能障碍[5,18-19]。研究发现缺血性脑卒中后认知功能障碍的严重程度与海马区受损神经细胞的数目密切相关[20]。脑缺血能够诱发中枢神经系统自身修复机制,启动内源性神经再生,在哺乳动物和人类中,海马的齿状回颗粒细胞下层是神经再生的主要部位之一[21-23]。
本研究应用和血生络方对MCAO大鼠进行干预,应用TTC染色法观察和血生络方对脑缺血大鼠梗死体积的影响,结果显示和血生络方显著降低MCAO的梗死体积,发挥脑保护作用。水迷宫实验检测结果显示模型组逃避潜伏期延长,跨越平台次数显著减少,和血生络方组MCAO大鼠的逃避潜伏期和跨越平台次数接近假手术组。与和血生络方组比较,和血生络方+抑制剂组 MCAO大鼠的逃避潜伏期显著增加,跨越平台次数明显减少。可见,和血生络方能够显著改善MCAO大鼠的认知功能。免疫荧光结果发现,和血生络方能够促进MCAO大鼠齿状回颗粒细胞下层Brd U+/Nestin+和Brd U+/DCX+细胞的表达,在PMD3至PMD14呈逐渐上升趋势。和血生络方+抑制剂组MCAO大鼠齿状回颗粒细胞下层Brd U+/Nestin+和Brd U+/DCX+细胞的表达明显低于和血生络方组,说明k252a抑制了和血生络方调控BDNF-Trk B信号通路的作用。RT-PCR和Western blot检测结果发现,Nestin和DCX的mRNA表达和蛋白表达显示出相似的趋势。
BDNF在中枢神经系统广泛表达,而Trk B是BDNF在中枢神经系统中的特异性受体。BDNF与Trk B的特异性结合在维持中枢神经系统自我更新过程中发挥重要作用。k252a是BDNF-Trk B信号通路的特异性抑制剂,能够降低Trk B磷酸化的程度,Trk B的磷酸化程度降低又能抑制内源性BDNF的分泌[12-13]。有研究表明,高浓度的k252a可以抑制BDNF-Trk B通路表达,而低浓度的k252a可以促进内源性BDNF的分泌。本研究应用高浓度的k252a干预MCAO大鼠,结果显示BDNF和Trk B的表达同时降低。Colino等[24]研究发现,敲除BDNF基因小鼠的大脑中神经干细胞增殖率显著低于正常小鼠,并且还发现神经干细胞在分化和成熟前大量凋亡。Fang等[25]发现,敲除Trk B基因的小鼠,其大脑神经干细胞的增殖和分化速度显著降低。本研究结果表明,和血生络方显著增加了MCAO大鼠齿状回颗粒细胞下层BDNF和Trk B的表达,在和血生络方和k252a的共同干预时,BDNF-Trk B信号通路表达明显受到抑制。
综上所述,和血生络方可以改善脑缺血大鼠的学习、记忆和空间定位能力,其作用机制与其调控BDNF-Trk B信号通路表达,促进海马齿状回颗粒细胞下层神经再生水平密切相关。
