甘草地上部分指标性成分的确认及含量测定研究△
2021-11-16冯鑫杜裕邵会涵刘益江于冰莉方永晟侯俊玲王文全刘永刚
冯鑫,杜裕,邵会涵,刘益江,于冰莉,方永晟,侯俊玲,2,王文全,2,3,刘永刚*
1.北京中医药大学 中药学院,北京 102488;2.中药材规范化生产教育部工程研究中心,北京 100102;3.中国医学科学院 北京协和医学院 药用植物研究所,北京 100193
甘草地上部分约占整株的1/3,生物量占比较大[1],但目前多以燃料或者畜牧饲料的方式对其进行处理,造成了较大的资源浪费。经研究,甘草地上部分中黄酮类成分含量高[2-4],并有较好的药理活性。在我国的新疆地区,很早就有以甘草叶泡茶饮用来预防和治疗前列腺炎的传统,也得到了相关实验的证实[5-7],推测甘草叶水提物中的黄酮类物质发挥了主要作用[7]。此外,甘草地上部分还具有一定的抗糖尿病作用[1]。有研究者对甘草地上部分的安全性也进行了初步评价,急性毒性分级属无毒级,相当于成年人的日致死剂量>500 g[8]。
本课题组以乌拉尔甘草地上部分为研究对象,对其进行提取分离,得到并且鉴定了15 个单体化合物,包括芦丁、刺甘草查耳酮、乔松素等,其中多为黄酮类成分,而关于甘草地上部分中指标性成分含量测定的研究几乎为空白。因此,本研究借助网络药理学对这15 个单体成分抗前列腺炎的作用进行探究,选取其中重要的单体成分作为指标性成分,建立地上部分含量测定的方法,以期实现甘草地上部分的质量控制。
1 材料
1.1 仪器
岛津SPD-M20A 型高效液相色谱仪,光电二极管阵列紫外-可见光检测器;KH-250 型速控超声波清洗器(昆山禾创超声仪器有限公司);BT25S型十万分之一电子天平、BSA124S-CW 型万分之一电子天平(赛多利斯公司)。
1.2 试药
甘草地上部分采自甘肃省酒泉市瓜州县河东乡,经中国医学科学院药用植物研究所王文全教授鉴定为甘草Glycyrrhiza uralensisFisch.的地上部分,编号为S1~S3;对照品芦丁、刺甘草查耳酮、乔松素均为本课题组自制,通过核磁共振氢谱(1H-NMR)、核磁共振碳谱(13C-NMR)、质谱(MS)等手段确证了其结构,高效液相色谱法(HPLC)检测纯度>98%(面积归一法);水为娃哈哈饮用纯净水;乙腈、甲酸、甲醇(色谱级,美国Fisher公司)。
2 方法与结果
2.1 基于网络药理学分析所得单体成分抗前列腺炎作用
2.1.1 化合物靶点与前列腺炎靶点交集的韦恩分析 通过PubChem 数据库(https://pubchem.ncbi.nlm.nih.gov/)检索各化合物英文名,获得并下载其3D 化学结构。运用SwissTargetPrediction 数据库(http://www.swisstargetprediction.ch/index.php)得到15 个单体成分(分别为β-谷甾醇、邻苯二甲酸二丁酯、甘草次酸、刺甘草查耳酮、大豆苷元、木犀草素、山柰酚、对羟基苯甲酸、槲皮素、异甘草素、乔松素、异槲皮苷、水仙苷、芦丁和短叶松素)可能作用的靶点。通过DigSee(http://210.107.182.61/geneSearch/)和 GeneCards(https://www.genecards.org/)数据库获得前列腺炎疾病的作用靶点。
由于检索到的靶点可能存在命名不规范等问题,运用UniProt(https://www.uniprot.org/)筛选出物种为“人”的靶点,并且将检索到的蛋白名校正为官方名称(official symbol),获得相关靶点信息。利用Venny 2.1.0(https://bioinfogp.cnb.csic.es/tools/venny/)获得15 个单体成分作用靶点与前列腺炎疾病相关靶点的交集。
2.1.2 抗前列腺炎交集靶点的相互作用网络 所得交集靶点上传至在线STRING 11.5 数据库(https://string-db.org/),得到交集蛋白质-蛋白质相互作用(PPI)网络。将PPI 网络导入Cytoscape 3.7.2 软件,使用软件中的“Network Analysis”功能获得各节点的介度中心性(BC)、接近中心性(CC)和度(degree)。
2.1.3 抗前列腺炎靶点的基因本体(GO)功能和京都基因与基因组百科全书(KEGG)通路富集分析 将抗前列腺炎靶点输入OmicShare(https://www.omicshare.com/)和 DAVID 6.8(https://david.ncifcrf.gov/)平台,分别进行GO 功能富集分析与KEGG通路富集分析。
2.1.4 结果
2.1.4.1 所得化合物抗前列腺抗炎作用的靶点 运用SwissTargetPrediction数据库得到15个化合物可能作用的靶点,去重后得到297 个;通过DigSee 和GeneCards 数据库获得前列腺炎疾病的作用靶点436 个;利用Venny 2.1 获得15 个成分抗前列腺炎疾病相关靶点45个(图1)。
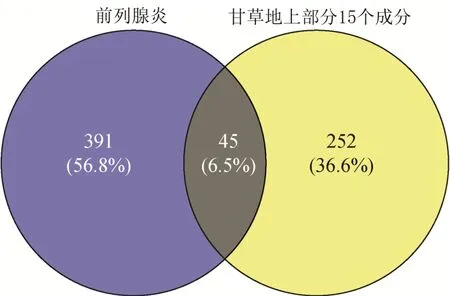
图1 甘草地上部分成分靶点与前列腺炎交集靶点韦恩图
2.1.4.2 抗前列腺炎交集靶点的PPI 网络 将2.1.4.1 项下得到的45 个靶点导入STRING 11.5 数据库,采用Cytoscape 3.7.2 软件绘制PPI 网络(图2),并对网络进行分析。PPI 网络共有45 个节点、357条边,平均度为15.9,平均介度中心性为0.017 6,平均接近中心性为0.587 6。其中度值最高的靶点为蛋白激酶B1(Akt1),其次为表皮生长因子受体(EGFR)、哺乳动物雷帕霉素靶蛋白(mTOR)、雌激素受体1(ESR1)、原癌基因酪氨酸蛋白激酶(SRC)、磷脂酰肌醇3-激酶催化亚基α(PIK3CA)、前列腺素G/H 合酶2(PTGS2)、肿瘤坏死因子(TNF)、基质金属蛋白酶-9(MMP-9)、MMP-2(均大于平均度、介度中心性、接近中心性),以上所述靶点均可能为抗前列腺炎的关键靶点(表1)。核心靶点(前11 个)与成分之间的映射见图3,可以看出山柰酚、槲皮素、乔松素可能发挥了抗前列腺炎的重要作用。

图2 甘草地上部分成分靶点与前列腺炎交集靶点PPI网络

图3 甘草地上部分成分-核心靶点PPI网络

表1 甘草地上部分成分抗前列腺炎核心靶点及其拓扑参数
2.1.4.3 抗前列腺炎靶点的GO 功能和KEGG 通路富集分析 依据P<0.001 筛选出GO 条目377 个,其中生物过程(biology process)341 个、分子功能(molecular function)22个、细胞组成(cellular component)14个。如图4所示,生物过程主要涉及细胞增殖、刺激反应、生物调节过程等;分子功能涉及催化活性、分子功能调节、抗氧化活性等;细胞组成主要涉及细胞器、细胞膜、腔上包膜等。进一步富集发现GO 条目主要聚集在细胞凋亡、增殖、代谢等,反映了这些化合物在抗前列腺炎作用的过程中涉及体内多个生物过程(图5)。
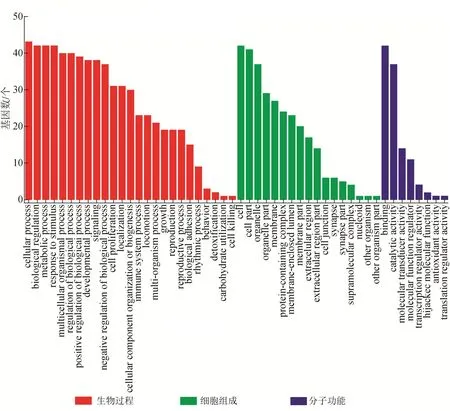
图4 甘草地上部分成分抗前列腺炎作用靶点的GO功能分析
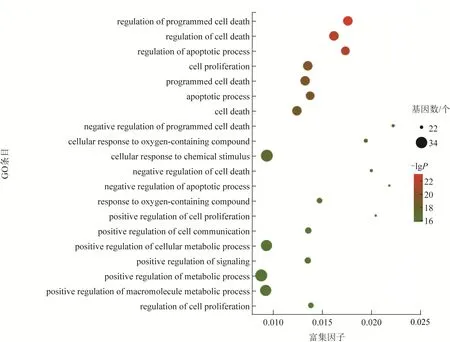
图5 甘草地上部分成分抗前列腺炎作用靶点的GO功能富集
依据P<0.05 筛得抗前列腺炎靶点KEGG 通路76 条,依P值升序排列且在该通路下的靶点降序排列的前20 条通路见图6,包括癌症通路(pathways in cancer)、PI3K-Akt 信号通路(PI3K-Akt signaling pathway)、癌症蛋白聚糖(proteoglycans in cancer)等通路。

图6 抗前列腺炎作用靶点的通路富集
2.2 指标性成分含量测定
2.2.1 混合对照品溶液制备 依据本课题组前期对地上部分提取分离的结果,乔松素与芦丁得到量较多;刺甘草查耳酮为甘草属特有,故以芦丁、刺甘草查耳酮、乔松素为指标性成分。分别精密称取对照品芦丁、刺甘草查耳酮、乔松素适量,加甲醇制得质量浓度分别为3.26、3.02、4.96 mg·mL-1的单组分对照品储备溶液;精密吸取上述溶液各1.0 mL,用甲醇定容至100 mL,制得含芦丁32.6 μg·mL-1、乔松素49.6 μg·mL-1、刺甘草查耳酮30.2 μg·mL-1的混合对照品溶液。
2.2.2 供试品溶液制备 取乌拉尔甘草粗粉(过0.7 mm 筛)约2.0 g,精密称定,置具塞锥形瓶中,精密加入70%甲醇水溶液50 mL,密塞,称量,加热回流1 h,放冷,称量,用70%甲醇水溶液补足减失的质量,摇匀,滤过。精密量取续滤液25 mL,蒸干,残渣加10 mL 水溶解,置于分液漏斗中,加入等量乙酸乙酯萃取,至乙酸乙酯层变无色,合并乙酸乙酯萃取液,蒸干,残渣加甲醇适量使其溶解并转移至2 mL 量瓶,加甲醇稀释至刻度,摇匀,过0.45 μm微孔滤膜,即得。
2.2.3 色谱条件 采用Agilent ZORBAX Eclipse Plus C18色谱柱(150 mm×4.6 mm,5 μm),柱温为35 ℃,以乙腈(B)-0.1%甲酸(A)为流动相,梯度洗 脱(0~9 min,10%~27%A;9~10 min,27%~30%A;10~15 min,30%~33%A;15~18 min,33%~36%A;18~22 min,36%~37%A;22~30 min,37%A;30~32 min,37%~42%A;32~37 min,42%~60%A);流速为1.0 mL·min-1,检测波长为289 nm,进样量为10 μL。混合对照品溶液及供试品溶液的色谱图见图7。

图7 混合对照品及甘草地上部分样品色谱图
2.2.4 方法学考察
2.2.4.1 线性关系考察 精密吸取2.2.1 项下混合对照品溶液1.0、2.0、3.0、4.0、5.0 mL,用甲醇溶液定容至10 mL,混匀,制成系列质量浓度的线性关系考察混合对照溶液。分别进样10 μL,按2.2.3 项下色谱条件进行分析,记录峰面积。以进样量为横坐标(X),峰面积为纵坐标(Y),得3 个成分的回归方程,见表2。

表2 甘草地上部分中3个成分的线性关系
2.2.4.2 精密度试验 精密吸取混合对照品溶液10 μL,按2.2.3 项下色谱条件连续进样6 次,依次测定峰面积,结果显示,芦丁、刺甘草查耳酮和乔松素峰面积的RSD 分别为0.20%、0.45%、0.32%,表明仪器精密度良好。
2.2.4.3 稳定性试验 精密吸取供试品溶液10 μL,按2.2.3项下色谱条件,于0、1、2、4、8、12、24 h分别进样测定,结果显示,芦丁、刺甘草查耳酮和乔松素峰面积的RSD 分别为1.90%、1.20%、1.60%,表明供试品溶液在24 h内稳定。
2.2.4.4 重复性试验 取同一批甘草地上部分6份,按2.2.2 项下方法制备供试品溶液,并按2.2.3项下色谱条件进样测定,记录峰面积,测得芦丁、刺甘草查耳酮和乔松素峰面积的RSD 分别为1.13%、0.89%、1.10%,表明重复性良好。
2.2.4.5 加样回收率试验 精密称取2.2.4.4 项下已测含量的甘草地上部分粗粉6 份,每份约0.50 g,分别加入芦丁、刺甘草查耳酮、乔松素对照品,按2.2.2 项下方法制备供试品溶液,按2.2.3 项下色谱条件进样测定,记录峰面积,计算样品中3 个成分的平均加样回收率及RSD,结果见表3。

表3 甘草地上部分成分加样回收率试验
2.2.5 样品含量测定 取3 批乌拉尔甘草地上部分样品,按2.2.2 项下方法制备供试品溶液,按2.2.3项下色谱条件进样测定,计算样品中3 个成分的含量,结果见表4。
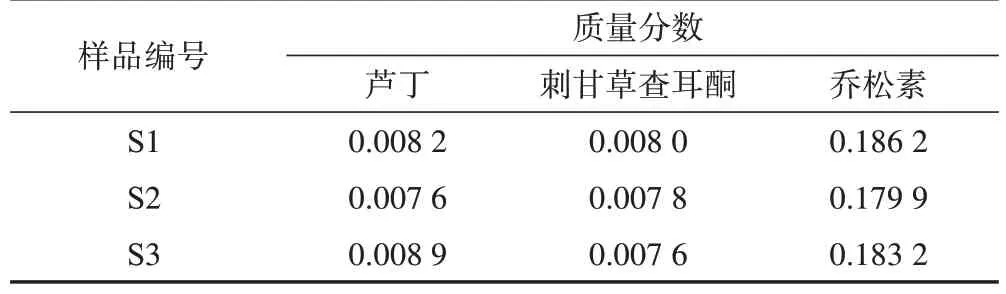
表4 甘草地上部分样品中3个成分含量测定结果mg·g-1
3 讨论
3.1 基于网络药理学的甘草地上部分成分抗前列腺炎可能作用机制探讨
基于SwissTargetPrediction 数据库,乔松素可能作用mTOR、ESR1、SRC、PIK3CA、PTGS2 等多个核心靶点来发挥抗前列腺炎的作用。mTOR 是一种丝氨酸苏氨酸蛋白激酶,是Akt 最重要的底物之一,而Akt处于PI3K/Akt信号转导通路的核心部位,在细胞的增殖、生存及凋亡和细胞恶变的产生中扮演重要角色。Kinkade 等[9]报道Akt/mTOR 信号通路与前列腺癌的进展及转移相关。从表2 可看出,Akt1 度值最高,为核心靶点之一。另外,从图6 看出,PI3K/Akt 信号传导通路富集明显,是细胞内重要的信号传导途径之一,通过多种重要相关因子调节前列腺癌细胞的生长、增殖,促进细胞运动、侵袭,抑制细胞凋亡,促进血管生成,进而治疗前列腺炎。有研究指出,与前列腺增生的发生、发展有关的生长因子主要包括表皮生长因子(EGF)、碱性成纤维生长因子(b-FGF)、胰岛素样生长因子-1(IGF-1)、转化生长因子-β(TGF-β)、血管内皮生长因子(VEGF)[10],从图3 中可以看出山柰酚、异甘草素、槲皮素对EGF 可能具有一定作用。
3.2 指标性成分的含量测定
3.2.1 样品提取方法的选择 采用甲醇为提取溶剂,分别考察了超声提取和回流提取方法,发现回流提取含量较高。考察了30%甲醇、70%甲醇、甲醇、30%乙醇、70%乙醇、乙醇6 种溶剂对提取率的影响,结果发现70%甲醇提取率最高,故选用70%甲醇作为提取溶剂。
3.2.2 流动相的确定 考察了乙腈-水、乙腈-0.1%磷酸、乙腈-0.1%甲酸、甲醇-0.1%甲酸4 个溶剂系统。结果显示,以乙腈-0.1%甲酸为流动相,所得色谱峰峰形较好,分离效果最佳。
3.2.3 指标性成分的确定 网络药理结果显示,山柰酚、槲皮素、乔松素为发挥抗前列腺炎的重要成分,但在本课题组前期对地上部分含量测定研究中发现,山柰酚、槲皮素含量低,不易测得,且两者在药用植物中广泛存在,而刺甘草查耳酮为甘草属特有。依据本课题组前期对地上部分提取分离的结果,乔松素得到量最多,这也是选取其作为地上部分指标性成分的原因之一。
