蛋白二、三级结构对鱼糜凝胶质构和持水力的影响及其测定方法研究进展
2021-11-16梁恽红张香美
梁恽红,卢 涵,张香美
(河北经贸大学生物科学与工程学院,石家庄 050061)
鱼体经去头、去内脏、采肉、漂洗、脱水、斩拌等工艺可制成鱼糜(Surimi),斩拌后鱼糜加入食盐等调味料擂溃成黏稠鱼肉糊后再加热,成为弹性凝胶体,即鱼糜凝胶。鱼糜凝胶中最主要的蛋白质是肌原纤维蛋白(Myofibrillar protein,MP),对凝胶形成贡献最大,因此肌原纤维蛋白结构对鱼糜凝胶形成和品质具有重要影响[1]。
肌原纤维蛋白是一种盐溶性蛋白,需在离子强度>0.5的中性盐溶液中溶解,主要由肌球蛋白(Myosin)、肌动蛋白(Actin)、原肌球蛋白(Tropomyosin)及肌钙蛋白(Troponin)构成,肌原纤维蛋白结构是维持鱼肉肌肉及相关制品质构及持水力重要原因[2]。肌原纤维蛋白二级结构是指多肽主链骨架原子空间相对盘绕、折叠,主要形式包括α-螺旋、β-折叠、β-转角及无规则卷曲,氢键是维持蛋白二级结构主要作用力;肌原纤维蛋白三级结构是二级结构通过侧链基团借助次级键维系进一步卷曲、折叠所形成的特定空间构象,主要是疏水相互作用、氢键、离子键、二硫键共同作用[3],如图1所示。鱼糜凝胶形成与α-螺旋和β-折叠结构含量、蛋白质三级结构展开和聚集密切相关,因鱼糜凝胶是肌原纤维蛋白在氢键、疏水相互作用、离子键、二硫键共同作用下相互交联聚集形成的凝胶网状结构,作用力变化影响鱼糜凝胶质构和持水力。
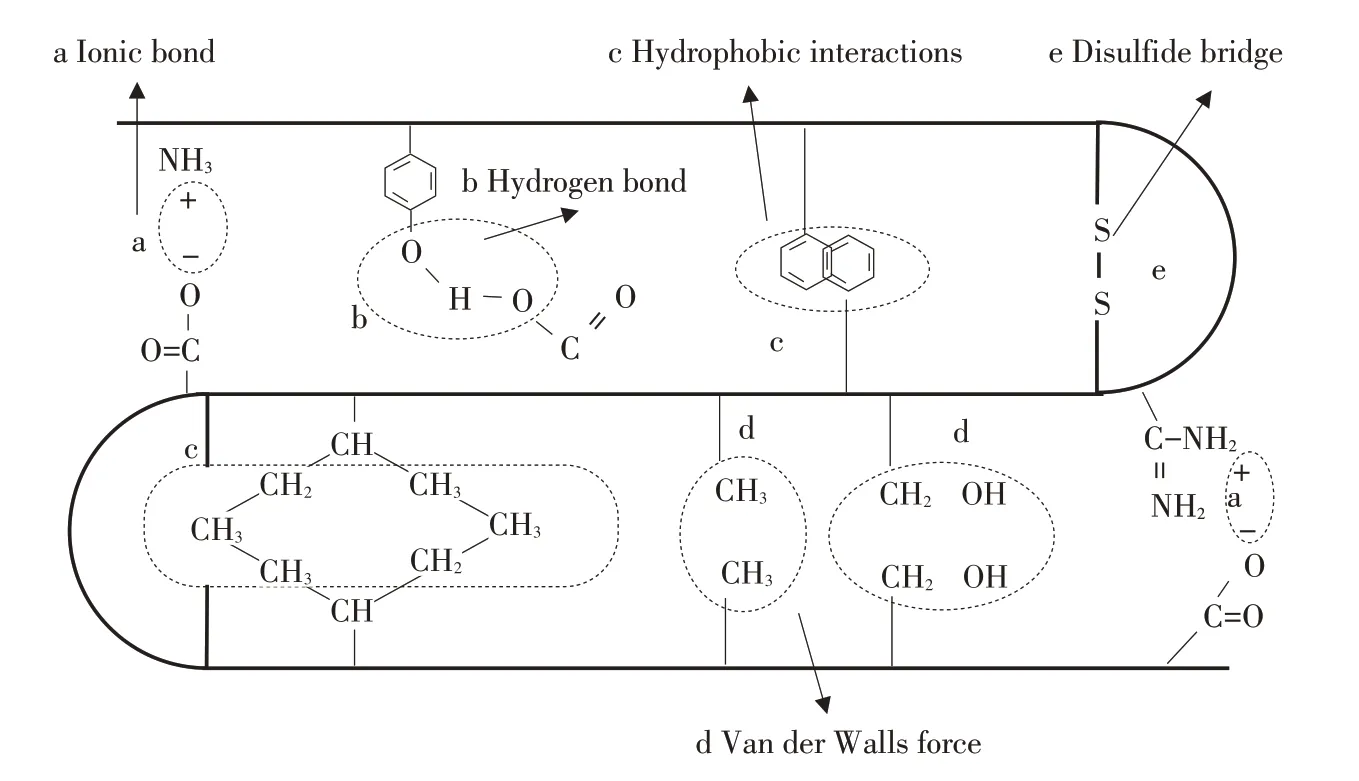
图1 蛋白质分子间作用力[3]Fig.1 Intermolecular forces of proteins
在鱼糜加工制作及运输贮藏过程中,除去鱼肉自身酶作用[4],肌原纤维蛋白不可避免受外部环境(如温度、压力、pH、环境中氧气、斩拌速度等)影响而发生结构和构象变化,而肌原纤维蛋白结构变化在很大程度上影响鱼糜凝胶品质。质构和持水力是评定鱼糜凝胶品质两个重要指标。质构特性体现鱼糜制品新鲜度和鱼糜凝胶内部特性细微变化,表现为硬度、内聚性、弹性、咀嚼性、回弹性和黏附性等参数;持水力指蛋白质凝胶保持水分能力,受凝胶微观结构、蛋白质和水之间相互作用等因素影响[5]。另外,根据凝胶强度与硬度相似性,凝胶强度也可用于反映鱼糜凝胶品质[6]。Andersen等报道,当肌原纤维结构被破坏,造成肌原纤维蛋白无序聚集,使形成的凝胶网络孔隙不均、大小不一,破坏鱼糜凝胶质构与持水力[7]。仪淑敏等试验结果表明,高压破坏蛋白质空间结构,重新缔结成具有均匀网络结构的蛋白凝胶体,同时更多自由水与蛋白质形成结合水,增强凝胶强度和持水性能[8]。但肌原纤维蛋白结构对凝胶质构及持水力的影响机制尚不清楚。
本文从蛋白分子间作用力角度出发,从氢键、疏水相互作用、离子键及二硫键等方面阐述肌原纤维蛋白结构变化对鱼糜凝胶质构及持水力影响,并简要介绍比较鱼糜凝胶蛋白二、三级结构测定方法,如图2所示,揭示肌原纤维蛋白结构变化对鱼糜凝胶质构及持水力影响机制,为改进鱼糜及鱼糜制品品质,选择更适合的结构测定方法提供理论参考。
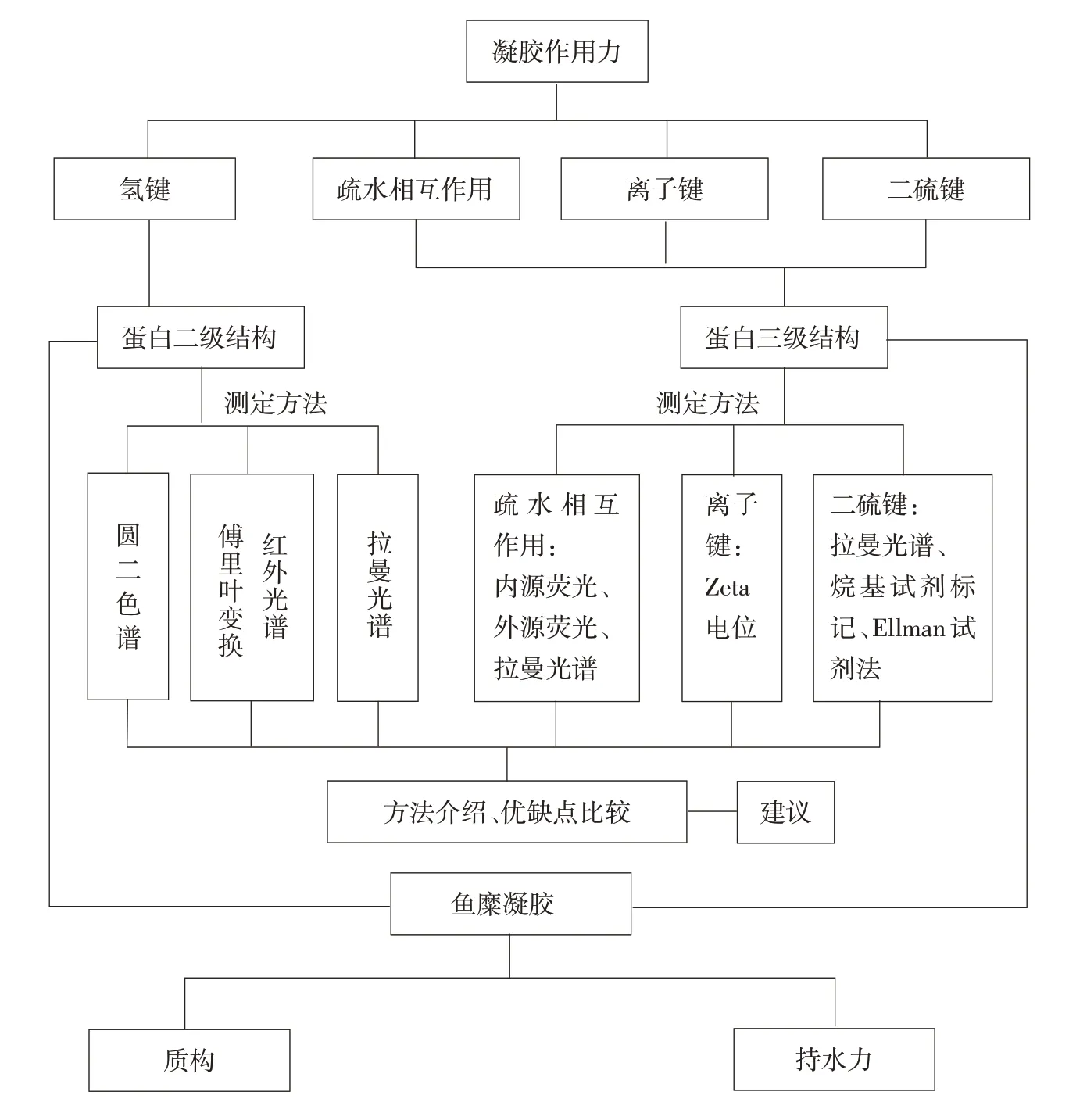
图2 文章结构内容示意Fig.2 Structure and content of paper
1 氢键对鱼糜凝胶质构和持水力的影响
1.1 氢键与鱼糜凝胶质构和持水力关系
氢键是维持蛋白质二级结构主要作用力,也是鱼糜凝胶有较好硬度和持水力原因之一。刘芳芳等认为,氢键在蛋白质受热变性时发生断裂,鱼糜凝胶冷却后重新形成,起稳定结合水、提高凝胶硬度的作用[9]。Wang等发现氢键含量显著升高时,凝胶保水性也显著增加[10]。张小燕等研究显示,氢键含量增加时凝胶强度也增加,对维持凝胶网络结构有积极作用[11]。因此,蛋白中氢键含量越高,对维持鱼糜凝胶质构、持水力越有利。
1.2 二级结构与鱼糜凝胶质构和持水力的关系
蛋白质二级结构主要有α-螺旋、β-折叠、β-转角及无规则卷曲4种形式,不同形式间可互相转化,其作用力主要由氢键维持。不同形式二级结构对鱼糜凝胶质构和持水力影响有所不同。α-螺旋结构主要通过氨基酸C=O和N-H形成分子内氢键维持,如图3a所示。研究表明,α-螺旋是天然蛋白质中二级结构主要构象,在鱼糜加工制成鱼糜凝胶时,α-螺旋结构部分解螺旋转化成β-折叠、β-转角或无规则卷曲[12]。β-折叠是有序平面结构,分为平行式和反平行式两种,主要通过氨基酸分子之间形成的氢键维持,如图3b所示。β-转角表现为回转结构,无规则卷曲是指无一定规律的松散肽链结构,通过氢键维持其构象[3]。β-转角和无规则卷曲相较于α-螺旋和β-折叠结构更无序[13],α-螺旋向有序的β-折叠结构转化更有利于形成规则的凝胶网络,使鱼糜凝胶质构和持水力较好,而α-螺旋向β-转角和无规则卷曲转化,导致鱼糜凝胶质构和持水力较差[14]。Wang等研究显示,β-折叠含量最高时,凝胶具有更均匀的微观结构,凝胶强度与持水力也更大[10]。Zhang等提出高温下形成的鱼糜凝胶无规则卷曲含量最高,肌原纤维蛋白分子无序聚集,降低蛋白质间交联程度,从而凝胶网状结构不均匀、粗糙、孔大,降低鱼糜产品凝胶强度[15]。因此,肌原纤维蛋白分子中氢键更多表现为α-螺旋或β-折叠时,对维持鱼糜或鱼糜凝胶结构、增强鱼糜凝胶质构和持水力有利。
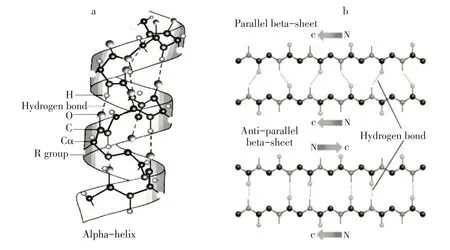
图3 α-螺旋、β-折叠结构[3]Fig.3α-helix andβ-sheet structure
1.3 氢键及蛋白二级结构测定
1.3.1 氢键测定
拉曼光谱在830 cm-1和850 cm-1处峰值变化比值(I850/I830)可用于判断酪氨酸残基包埋程度及体系氢键含量,I850/I830值为0.9~1.45表示酪氨酸酚羟基基团与水分子形成氢键,比值为0.7~1.0表示与蛋白质中其他基团形成氢键[16]。Zhang等测得当压力为0.1~200 MPa时,比值为0.965~1.029,表明酪氨酸残基暴露,并与水分子形成氢键,此时凝胶持水力较高;当压力大于300 MPa时,比值下降到0.705,表明酪氨酸中酚羟基与蛋白质分子产生氢键,有助于凝胶结构形成及凝胶强度增加[17]。
1.3.2 蛋白二级结构测定
蛋白质二级结构主要包括α-螺旋、β-折叠、β-转角及无规则卷曲4种形式,其中α-螺旋和β-折叠结构对鱼糜凝胶形成贡献最高。目前,科研人员普遍采用圆二色谱、拉曼光谱以及傅里叶变换红外光谱技术测定蛋白质二级结构,表1概括介绍3种方法。圆二色谱与波长有关,α-螺旋圆二色谱峰处于208~222 nm,β-折叠、无规则卷曲色谱峰为190~206 nm[18]。Cao和Xiong采用圆二色谱法检测到氧化后肌原纤维蛋白在220 nm处螺旋发生显著衰减,表明肌原纤维蛋白α-螺旋结构朝无规则卷曲结构转化,使肌原纤维蛋白无规则聚集,对凝胶形成不利[19]。

表1 氢键蛋白二级结构测定方法总结Table 1 Summary of hydrogen bond and protein secondary structure determination methods
拉曼光谱通常用于表征二级结构的是酰胺Ⅰ区,区域范围1 600~1 700 cm-1,具体各表征不同二级结构区域随选用测定仪器不同有细微差别[20]。Jia等采用拉曼光谱测定肌原纤维蛋白二级结构对凝胶特性的影响,结果显示,α-螺旋结构减少,β-折叠结构增加,表示α-螺旋向β-折叠转化,凝胶强度较高[21]。
在傅里叶变换红外光谱(FT-IR)中,大多通过酰胺I区(1 600~1 700 cm-1)光谱变化分析二级结构及其内部氢键结合情况[22]。赵冰等利用FT-IR法测定氧化对肌原纤维蛋白二级结构与凝胶关系,发现当α-螺旋和β-折叠部分遭到破坏,转化成不规则β-转角和无规卷曲结构时,蛋白质结构由稳定向不稳定转变,进而造成凝胶结构松散,无法形成致密稳定的网状结构,降低蛋白质凝胶强度和持水力[23]。
1.4 蛋白二级结构测定方法比较
圆二色谱、拉曼光谱与傅里叶变换红外光谱对肌原纤维蛋白二级结构测定结果一致,即α-螺旋大部分转化成β-折叠,形成的凝胶具有较好硬度与持水力,当α-螺旋和β-折叠氢键断裂,形成较多β-转角和无规卷曲时,凝胶硬度和持水力较差。但需注意的是,这3种方法各有利弊,详见表2。

表2 蛋白二级结构测定方法比较Table 2 Comparison of protein secondary structure determination methods
2 疏水相互作用对凝胶质构和持水力的影响
2.1 疏水相互作用与凝胶质构和持水力的关系
疏水相互作用作为维持凝胶结构另一主要非共价作用力,由肌原纤维蛋白侧链基团上某些特定疏水氨基酸残基暴露于极性环境形成[24]。Du等研究发现,肌原纤维蛋白中部分掩盖疏水氨基酸残基随三级结构展开而暴露,随后由于蛋白质重新聚合,暴露的疏水氨基酸残基又重新进入肌原纤维蛋白内部,疏水相互作用呈先增后降趋势[25]。
适当的疏水基团暴露在极性环境中有利于蛋白质重新聚集,蛋白质重排形成孔隙均匀的网状结构,凝胶具有较好质构和持水力[26],如图4a~b所示,适当增加微波加热频率(300~500 W)使蛋白质结构展开,更多疏水基团暴露,增强蛋白质间相互作用,使其重新聚集形成更均匀凝胶网络[27]。Yu等研究不同键断裂剂对鱼糜凝胶特性和蛋白构象的影响,结果显示,在键断裂剂SDS浓度较低时,蛋白质三级结构部分展开,疏水侧链暴露,疏水相互作用增强,凝胶硬度和凝胶弹性增加[28]。Li等研究结果表明,疏水相互作用形成和二硫键增强凝胶网状结构,因此更多的水分子可固定于凝胶结构,凝胶持水力增强[29]。而过度疏水基团暴露在极性环境中预示蛋白质结构过度展开,使形成凝胶所必需的交联被破坏,也不利于水分子保留于凝胶,导致凝胶的质构和持水力较差,如图4c所示,当微波加热频率从500 W升至800 W时,蛋白质结构被破坏,无法有序重新聚集,导致凝胶网络结构不均匀,孔隙粗大且无序[27]。Chen等通过向肌原纤维蛋白中添加疏水基团,证实引入过多疏水基团时,蛋白质分子间形成凝胶所必需的交联可能被破坏,导致凝胶网络劣化,凝胶硬度和弹性均降低[30]。薛思雯等研究报道,过多暴露包埋的疏水基团可能对凝胶持水力起反作用,可能是因为肌原纤维蛋白分子过度展开而难以再形成致密凝胶网络,不利于水分子包埋于凝胶网络,导致凝胶持水力下降[31]。

图4 不同微波加热频率下肌原纤维蛋白凝胶微观结构[27]Fig.4 Microstructure of myofibrillar protein gel under different microwave heating power(SEM)
2.2 疏水相互作用测定
通常采用荧光光谱法和拉曼光谱法检测鱼糜凝胶中疏水相互作用的变化。其中内源荧光光谱法是通过检测色氨酸荧光强度变化,表征蛋白质内部极性环境变化[32]。Wei等研究发现,适当暴露色氨酸残基,使疏水相互作用增加,内源荧光强度降低,肌原纤维蛋白凝胶形成均匀致密的网络结构,这预示肌原纤维蛋白疏水相互作用增强蛋白质间的相互作用,凝胶微观网状结构较好,具有良好弹性和持水力[27]。
另外,疏水残基可与荧光探针结合,产生荧光效应。根据这一原理,可采用外源荧光光谱法加入荧光探针检测肌原纤维蛋白中疏水性残基。用于作为荧光探针的有8-苯胺基-1-萘磺酸(ANS)、溴酚蓝[19]等。Xiao等采用ANS作为荧光探针检测不同位置鳄鱼肉中肌原纤维蛋白表面疏水性,结果显示,尾部较肢体和腿部肌原纤维蛋白暴露的疏水基团更多,表面疏水性更强,因此尾部肌原纤维蛋白更易聚集,网状结构更均匀致密,形成的凝胶强度及持水力显著高于其他部位[33]。
芳香族氨基酸侧链如色氨酸具有拉曼光谱特征吸收峰,可采用拉曼光谱法表征疏水基团变化情况。760 cm-1处特征峰归因于色氨酸残基环振动,当疏水微环境中掩埋的色氨酸残基暴露于极性环境时,760 cm-1附近峰强度可能减少[34]。Wang等采用拉曼光谱测得肌原纤维蛋白凝胶中疏水相互作用变化,并表示色氨酸嵌入疏水环境中可能形成有序的凝胶网络,有利于保持持水力[16]。这也表示过多疏水基团暴露可能不利于凝胶网络和凝胶形成较好持水力。
2.3 疏水相互作用测定方法比较
将内源荧光光谱、外源荧光光谱、拉曼光谱3种方法作比较,具体如表3所示。

表3 疏水相互作用测定方法比较Table 3 Comparison of hydrophobic interaction determination methods
3 离子键对凝胶质构和持水力的影响
3.1 离子键与凝胶质构和持水力关系
在鱼糜正常pH下,肽链上谷氨酸和天冬氨酸羧基基团带负电,而赖氨酸和精氨酸氨基基团带正电,这些基团间形成离子键,又称为盐桥。离子键有助于维持蛋白质三级结构,其形成加强蛋白质间交联,通常在维持凝胶质构和持水力方面起辅助增强作用[35]。在肌原纤维蛋白形成鱼糜凝胶过程中,通常添加氯化钠以破坏蛋白质间离子键,使蛋白质解离,蛋白质解离对于热凝胶弹性结构形成是必需的,解离后蛋白质又通过蛋白质间离子键、蛋白质与氯化钠之间离子键共同作用增强鱼糜凝胶强度[36]。
鱼糜正常pH下肌原纤维蛋白净电荷呈负电性,阳离子可通过形成蛋白质-阳离子-蛋白质桥加速蛋白质间相互作用,从而提高凝胶硬度和持水力,如图5所示。励建荣等研究表明带正二价的钙离子在相邻蛋白质之间结合负电基团可形成离子键,有助于增加鱼糜凝胶强度[36]。Arfat和Benjakul研究发现,Zn2+也可与蛋白质负电荷结构域之间形成盐桥,而后蛋白质通过盐桥交联,改善蛋白质凝胶性质[37]。Wang等也表示,当肌原纤维蛋白凝胶中离子键含量达到最大时,凝胶具有最高含水率,原因可能是随静电相互作用增加,凝胶持水力提高[10]。
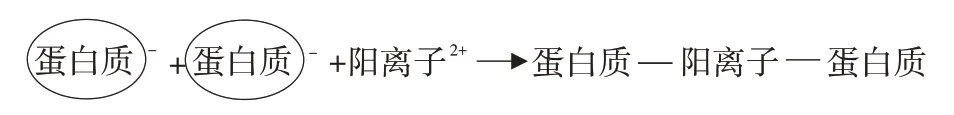
图5 阳离子在蛋白质间作用过程Fig.5 Interaction process of cations between proteins
3.2 Zeta电位测定离子键
离子键可采用Zeta电位变化表示。具有高Zeta电位(绝对值)蛋白质胶体稳定,而具有低Zeta电位蛋白质倾向于凝聚或絮凝[38]。从目前研究结果看,较高Zeta电位绝对值可能增加蛋白结构稳定性,但Zeta电位值过高是否对蛋白结构稳定性造成不利影响还有待于进一步探究。Zhang等测定在不同压力下Zeta电位变化,结果显示,随压力增加(0.1~200 MPa),肌原纤维蛋白加热成胶时,Zeta电位绝对值逐渐升高,蛋白质开始聚集成大分子聚合物,随后蛋白质聚合物之间空间变大,具有更多负电荷,有助于吸引水分子;形成的凝胶由均匀小孔洞组成,有利于提高凝胶强度,且水分子被牢牢锁在凝胶网络中,使其具有更高硬度和较好持水力[17]。杨玉玲等通过研究氧化对凝胶质构和持水力影响发现,随氧化程度增加,Zeta电位逐渐降低,预示离子键作用降低,凝胶网状结构出现孔径变大、胶束不均现象,进而影响凝胶超微结构和凝胶弹性[39]。
4 二硫键对凝胶质构和持水力的影响
4.1 二硫键与凝胶质构和持水力关系
二硫键形成被认为和巯基(-SH)变化高度相关,凝胶强度随巯基含量增加而降低,巯基含量越低,凝胶强度越大,巯基含量减少主要由于蛋白质三级结构展开,位于肌原纤维蛋白内部的巯基暴露,游离的巯基受氧化作用形成二硫键[40]。蛋白质三级结构展开使巯基暴露,这与疏水相互作用形成过程中疏水基团暴露过程相似,且巯基氧化形成二硫键又加强蛋白质之间交联,说明二硫键形成有助于凝胶强度增加,二硫键对凝胶结构形成有重要贡献[11]。
适量二硫键可使鱼糜凝胶有较好质构和持水力,但过量二硫键对鱼糜凝胶持水力产生负面影响。郑红等研究表明,二硫键含量与鳝鱼肉弹性、咀嚼性、回复性等质构特性之间呈显著正相关(P<0.05),二硫键含量越低,蛋白结构越松散[41]。Chen等表示压力处理后凝胶网状结构不规则,二硫键含量增加可补偿这一现象,从而使鱼糜凝胶具有良好凝胶性能和网络结构[42]。但过多二硫键并不能使鱼糜凝胶有良好持水力,因为大量二硫键形成阻止肌原纤维蛋白最佳重排,形成的凝胶虽硬度较高但因不均一性和孔径尺寸增加而导致持水力下降[43]。
4.2 二硫键测定
拉曼谱带500~550 cm-1处是二硫键特征峰,且半胱氨酸巯基拉伸振动在2 550~2 580 cm-1区域产生弱拉曼带,因此可采用拉曼光谱测定二硫键[16]。Wang等采用拉曼光谱检测到位于525 cm-1附近拉曼光谱强度先增后降[44],因为蛋白质结构展开,使巯基暴露并形成二硫键(t-g-g构象),随肌原纤维蛋白结构变化,二硫键又向其他两种构象(t-g-t位于543 cm-1和g-g-g位于510 cm-1)[34]转化,使S-S在525 cm-1处伸缩振动减弱。
相较于拉曼光谱,研究人员常用化学试剂检测二硫键,这种方法优点在于可使二硫键形成来源及过程显示更清楚。二硫键发生在一级或高级结构中相邻半胱氨酸残基之间,可在非还原条件下用碘乙酰胺(IAM)标记蛋白质中原有自由半胱氨酸,在加入还原剂打开二硫键后,再用N-乙基马来酰亚胺(NEM)等其他烷基化试剂封闭新产生的自由巯基,通过烷基化标签的质量数差异质谱分析其中的二硫键[45]。Lin等采用Ellman试剂法检测二硫键含量[46],根据还原二硫键前后试剂DTNB与巯基结合显色效果,二硫键增加使凝胶网络结构更稳定,提高鱼糜凝胶强度。
4.3 二硫键测定方法比较
拉曼光谱可反映蛋白中多个基团变化情况,但也因其包含信息量大,具有一定分析难度。烷基化试剂和Ellman试剂法均是通过将二硫键还原成巯基检测,常被用于定量分析,同时可显示出巯基与二硫键变化相关性,但检测步骤较复杂,有一定操作难度。具体差异如表4所示。

表4 二硫键测定方法比较Table 4 Comparison of disulfide bonds determination methods
5 结论与展望
综上,氢键是维持蛋白质二级结构主要作用力,二级结构中α-螺旋向β-折叠结构转化有利于凝胶形成。疏水相互作用、离子键、二硫键均在蛋白三级结构中起作用。适当疏水相互作用及二硫键有利于鱼糜凝胶质构和持水力,但过量疏水相互作用及二硫键对凝胶质构及持水力带来不利影响。因而控制鱼糜凝胶形成条件(盐浓度、温度、压力、氧化强度等),使肌原纤维蛋白结构不被过度破坏,是改善鱼糜制品品质关键。
通过比较几种测定方法发现,拉曼光谱可应用范围最广,不仅可测定蛋白二、三级结构,还可检测一些化学键与基团,但其灵敏度和准确性较其他测定方法差。因此,结合实际情况,选取几种测定方法结合使用可使测定结果更加准确和全面。另外,除文章中所涉及测定结构方法外,扫描电镜(SEM)、低场核磁共振(LF-NMR)、凝胶电泳(SDS-PAGE)、蛋白组学等方法,可共同确定蛋白质变化及其对鱼糜凝胶质构及持水力的影响。
