SiO2/PAA 吸附剂的制备及其对Cu2+、Pb2+的吸附行为研究
2021-11-15屈佳廖志聪宗梦娜张富莹张华周聪楠龚伟宋月红
屈佳, 廖志聪, 宗梦娜, 张富莹, 张华, 周聪楠,龚伟, 宋月红
(1.商洛学院 化学工程与现代材料学院, 陕西 商洛 726000; 2.陕西省尾矿资源综合利用重点实验室,陕西 商洛726000; 3.陕西省矿产资源清洁高效转化与新材料工程研究中心, 陕西 商洛 726000)
吸附法因具有成本低、 效果好、 可操作性强等优点成为处理重金属离子废水的一种重要方法[1]。常用的吸附剂主要包括碳质吸附剂[2-3]、 矿物吸附剂[4-5]、 生物材料吸附剂[6-7]、 合成高分子吸附剂[8-9]等。 其中合成高分子材料因具有多孔、 比表面积较大、 机械强度较高、 物理化学稳定性高、 来源广泛、 易于修饰等特点, 被广泛用作重金属离子吸附材料的基体[10-11]。 聚丙烯酸系树脂吸附能力强, 无毒无害, 绿色环保, 属于环境友好型吸附剂[12]。 聚丙烯酸(PAA)中带有大量亲水羧基官能团, 可有效地与工业废水中有毒的重金属离子配位, 并将其去除[13-14], 但单纯的聚合物在吸附离子后与水体分离效果不佳。 受有机/无机杂化材料类吸附剂的文献启发[15-16], 以及根据前期研究积淀[17], 设计以表面功能化的无机SiO2为核, 进而表面引发羧基类单体聚合, 是实现重金属离子的高速、 高效去除的有效途径。
基于此, 本研究采用水溶液聚合法, 将水溶性单体丙烯酸接枝在被乙烯基三乙氧基硅烷改性的纳米SiO2上, 得到高速、 高效的SiO2/PAA 吸附剂。试验表征了SiO2/PAA 吸附剂的化学结构, 考察了pH 值和温度对水溶液中Cu2+、 Pb2+吸附量的影响,重点研究了SiO2/PAA 对Cu2+、 Pb2+的吸附动力学行为, 并通过红外光谱初步探寻了吸附剂的吸附机理, 为SiO2/PAA 吸附剂在水处理方面的应用提供了理论及实践基础。
1 材料与方法
1.1 试剂与仪器
试剂: 气相纳米SiO2, 98%; 乙烯基三乙氧基硅烷(VTES)、 丙烯酸、 过硫酸钾、 五水合硫酸铜、硝酸铅, 均为分析纯。
仪器: DF-101S 型集热式恒温加热磁力搅拌器, YM-080ST 型超声波清洗仪, PW20 型电动搅拌机, HC-3514 型离心机, SHZ-A 型水浴恒温振荡器, Nicolet-380 型傅里叶变换红外光谱仪, AA-7003 型原子吸收光谱仪。
1.2 SiO2/PAA 吸附剂的制备及结构表征
将气相纳米SiO2加入共溶剂(V水∶V乙醇=1 ∶1)中, 用NaOH 调节体系pH 值为9, 在冰水浴(5℃)条件下采用超声波联合机械搅拌法分散30 min,得到质量浓度为0.6 g/L 的纳米SiO2悬浮液。 在SiO2悬浮液中加入等物质的量预水解的VTES, 用乙酸调节体系pH 值为4, N2保护下于60 ℃回流2 h。 冷却、 离心, 将下层沉淀用乙醇洗涤3 次, 60℃真空干燥12 h, 碾细即得白色的VTES 改性SiO2粉体[17]。
将0.15 g VTES 改性SiO2粉体分散在50 mL 去离子水中, 超声波联合机械搅拌10 min, N2保护下升温到70 ℃, 再加入0.25 g 引发剂过硫酸钾,将25 g 丙烯酸单体和75 mL 水的混合溶液逐滴加入三颈烧瓶中, 滴加时间控制在3 h。 滴加完毕后,在70 ℃下保温反应4 h。 离心, 水、 乙醇交替洗涤, 60 ℃真空干燥12 h, 得到白色的SiO2/PAA 吸附剂。 利用称重法[17]测得单体转化率为81.6%。
采用KBr 压片法测试VTES 改性纳米SiO2、 SiO2/PAA 吸附剂的红外光谱, 测试范围为4 000 ~400 cm-1。
1.3 试验用水
用分析天平称取0.390 6 g 五水合硫酸铜以及0.159 9 g 硝酸铅, 分别用去离子水溶解, 定容到100 mL。 移取20 mL 溶液稀释到1 000 mL, 得到质量浓度为20 mg/L 的Cu2+或Pb2+溶液, 作为该吸附试验的基础液, 利用酸度计测得Cu2+溶液pH 值为4.95, Pb2+溶液pH 值为5.02。 吸附试验中利用1 mol/L HCl 或NaOH 调节体系pH 值。
1.4 试验方法
(1) SiO2/PAA 吸附剂的吸附试验研究。 取20 mg SiO2/PAA 吸附剂、 20 mg/L 的CuSO4或Pb(NO3)2溶液20 mL, 于一定温度和pH 值条件下, 以80 r/min 的 转 速 恒 温 振 荡 一 定 时 间(5、 10、 20、 30、60、 120、 240、 360、 480 min)。 再于4 000 r/min离心10 min。 取上层清液, 采用原子吸收光谱仪进行Cu2+、 Pb2+浓度检测。 吸附量Q 及离子去除率η计算公式如下:
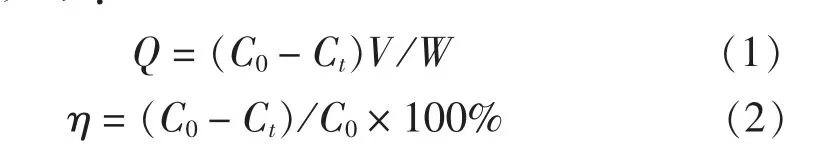
式中: Q 为吸附量, mg/g; C0为初始Cu2+或Pb2+质量浓度, mg/L; Ct为吸附后Cu2+或Pb2+质量浓度, mg/L; V 为处理水量, L; W 为吸附剂干重, g。
(2) 吸附动力学研究。 对SiO2/PAA 吸附剂吸附Cu2+或Pb2+的吸附动力学数据进行准一级动力学方程和准二级动力学方程拟合, 方程表达式如下[14]:
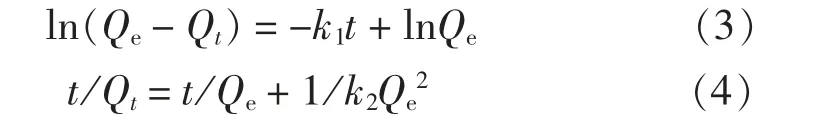
式中: Qe和Qt分别为平衡吸附量和t 时刻吸附量, mg/g; t 为吸附时间, min; k1和k2分别为准一级和准二级吸附速率常数。
1.5 分析方法
重金属离子浓度采用原子吸收光谱法测定。
2 结果与讨论
2.1 吸附剂的结构表征
纳米SiO2、 VTES 改性纳米SiO2、 SiO2/PAA 的红外光谱如图1 所示。
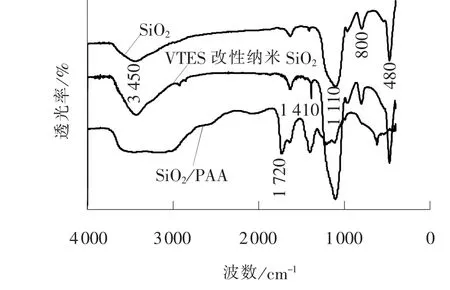
图1 SiO2、 VTES 改性纳米SiO2、 SiO2/PAA 的红外光谱Fig. 1 IR spectra of SiO2, VTES modified SiO2 and SiO2/PAA
由图1 可知, 3 450 cm-1处为SiO2的Si—OH反对称伸缩振动吸收峰, 1 110 cm-1处为Si—O—Si反对称伸缩振动吸收峰, 800 cm-1和480 cm-1处为Si—O—Si 对称伸缩振动吸收峰。 经过VTES 改性的纳米SiO2在1 410 cm-1处出现C===C 面内弯曲振动吸收峰, C===C 的存在为引发丙烯酸单体在SiO2表面进行自由基共聚反应提供了条件。 SiO2/PAA在3 500 ~3 200 cm-1出现缔合—OH 的伸缩振动吸收峰, 在1 720 cm-1处出现C===O 伸缩振动吸收峰,且 仍 保 留1 110 cm-1、 800 cm-1和480 cm-1处 的Si—O—Si 特征吸收峰, 说明聚丙烯酸确以化学键的形式有效接枝在了纳米SiO2上, 得到了有机/无机杂化吸附剂SiO2/PAA。
2.2 重金属离子吸附试验研究
2.2.1 pH 值对吸附性能的影响
当吸附剂质量分数为0.1%、 振荡速率为80 r/min、 温度为25 ℃、 吸附时间为8 h 时, 考察pH 值对Cu2+、 Pb2+吸附效果的影响, 结果如图2 所示。
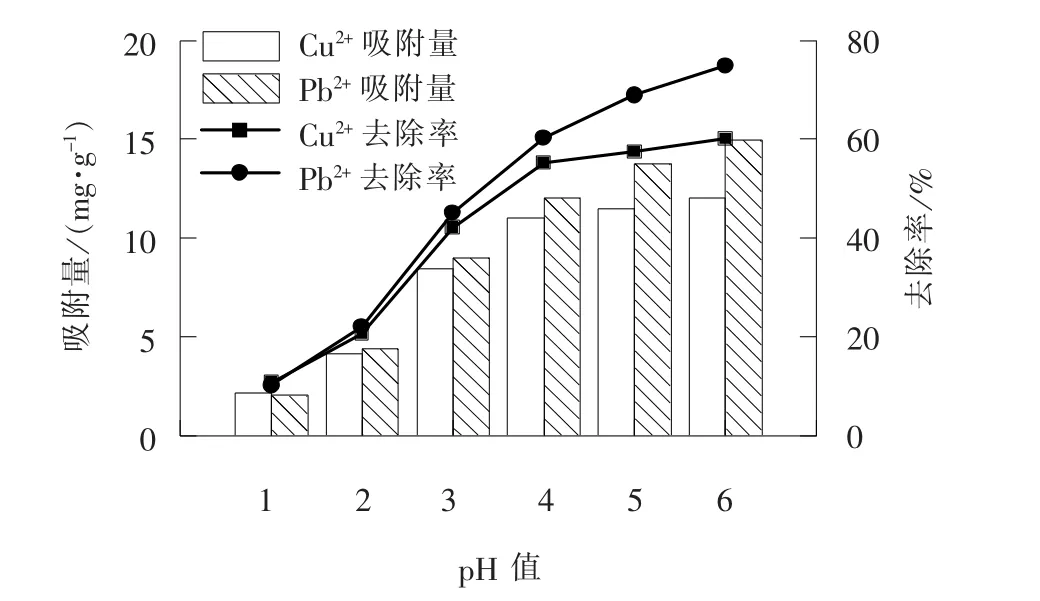
图2 pH 值对Cu2+、 Pb2+吸附量的影响Fig. 2 Effect of pH value on adsorption capacity of Cu2+and Pb2+
由图2 可见, 随着pH 值的增大, SiO2/PAA 吸附剂对重金属离子的吸附量明显增加。 这是因为pH值为1 ~2(pH <pKa=4.7 ~5.0[18-19])时, SiO2/PAA 吸附剂的有效官能团以—COOH 的形式存在[20], 对金属阳离子的吸附性能较差。 当pH 值为5 ~6(pH >pKa)时, SiO2/PAA 吸附剂的有效官能团以—COO-的形式存在[20], 对金属阳离子的吸附性能明显提升。 另一方面, 低pH 值条件下, 体系中较多的H+与金属阳离子之间存在一定的竞争吸附, 这也使得低pH 值条件下的吸附量较小。 按照溶度积常数及离子浓度计算[21]可知, 当pH 值大于6.1 时, Cu2+会以Cu(OH)2的形式开始沉淀; 当pH 值大于8.6时, Pb2+会以Pb(OH)2的形式开始沉淀。 因此, 本试验仅考察pH 值为1 ~6 时对Cu2+、 Pb2+吸附性能的影响。 综合考量, 确定最佳吸附pH 值为6。
2.2.2 温度对吸附性能的影响
当吸附剂质量分数为0.1%、 振荡速率为80 r/min、 pH 值为6、 吸附时间为8 h 时, 考察温度对Cu2+、 Pb2+吸附效果的影响, 结果如图3 所示。
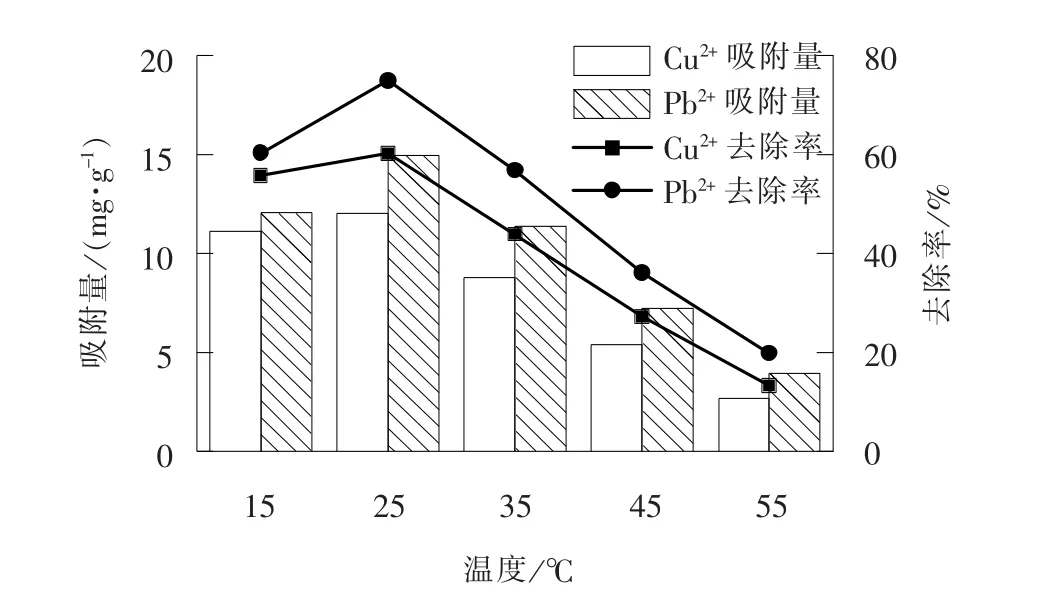
图3 温度对Cu2+、 Pb2+吸附量的影响Fig. 3 Effect of temperature on adsorption capacity of Cu2+and Pb2+
由图3 可见, 25 ℃时SiO2/PAA 吸附剂对重金属离子的吸附量最大。 这是因为温度太低, 吸附剂与重金属离子之间的碰撞频率较低。 Cu2+、 Pb2+在给定条件下自发吸附在SiO2/PAA 吸附剂上, 由热力学基本原理可知[21], 自发过程ΔG <0; 而离子被吸附, 体系混乱度降低, ΔS <0; 由吉布斯赫姆霍兹方程ΔG =ΔH-TΔS 可知, 吸附过程ΔH <0,SiO2/PAA 对Cu2+、 Pb2+的吸附是放热反应, 温度升高, 平衡向脱附方向移动, 吸附量下降。 综合考量, 确定最佳吸附温度为25 ℃。
2.2.3 吸附时间对吸附性能的影响
当吸附剂质量分数为0.1%、 振荡速率为80 r/min、 pH 值为6、 温度为25 ℃时, 考察吸附时间对Cu2+、 Pb2+吸附的影响, 结果如图4 所示。
由图4 可见, SiO2/PAA 对Cu2+、 Pb2+的吸附在0 ~30 min 速率最快, 对Cu2+的吸附量在120 min以后趋于平衡, 平衡吸附量的测试值为12.03 mg/g, Cu2+去除率为60.15%; 对Pb2+的吸附量在60 min 以后趋于平衡, 平衡吸附量的测试值为14.97 mg/g, Pb2+去除率为74.75%。
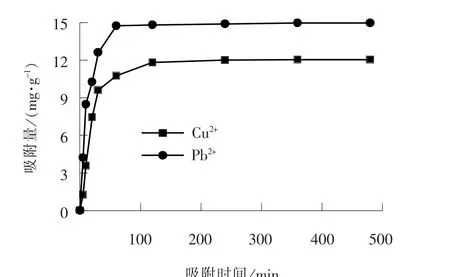
图4 SiO2/PAA 吸附剂对Cu2+、 Pb2+的吸附动力学曲线Fig. 4 Adsorption kinetic curves of Cu2+and Pb2+by adsorbent SiO2/PAA
2.3 吸附动力学研究
当吸附剂质量分数为0.1%、 振荡速率为80 r/min、 pH 值为6、 温度为25 ℃时, 在不同时间(5、10、 20、 30、 60、 120、 240、 360、 480 min)内, 2种离子的准一级、 准二级反应动力学拟合结果见图5 和表1。 就Cu2+、 Pb2+吸附结果而言, 准二级动力学方程拟合的Qe(12.68、 15.25 mg/g)更接近测试结果, 且具有更高的相关性系数R2(0.995 3、 0.999 6)。SiO2/PAA 对Cu2+、 Pb2+的化学吸附过程为速率决定步骤, 吸附速率及效果均为Pb2+>Cu2+。
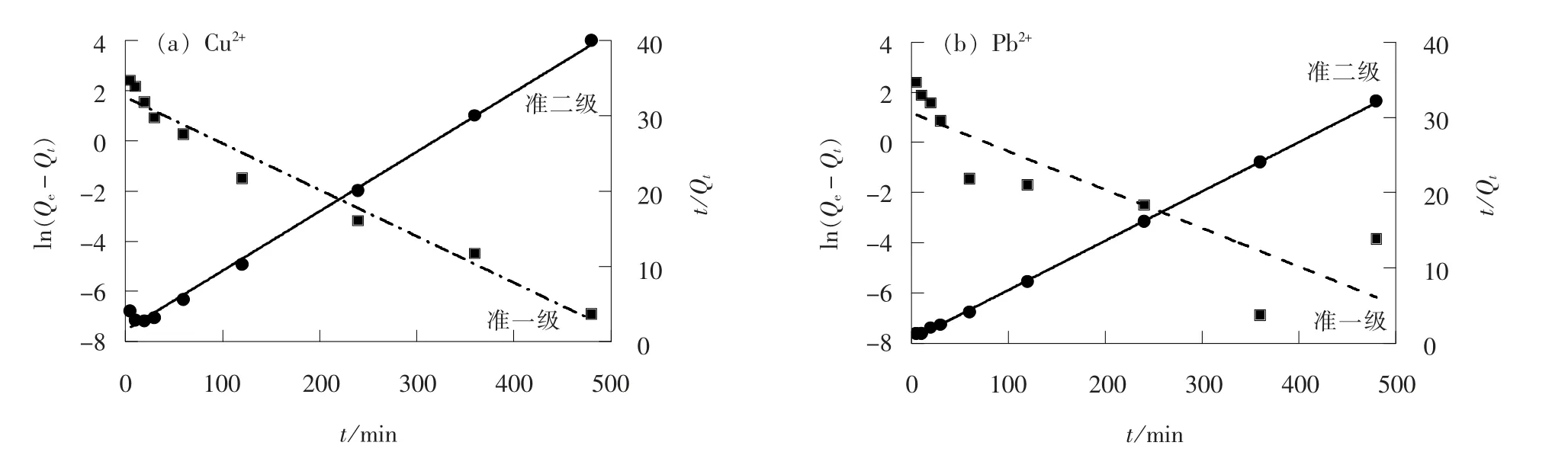
图5 SiO2/PAA 吸附剂对Cu2+、 Pb2+的吸附动力学拟合结果Fig. 5 Fitting curves of adsorption kinetics of Cu2+and Pb2+by adsorbent SiO2/PAA
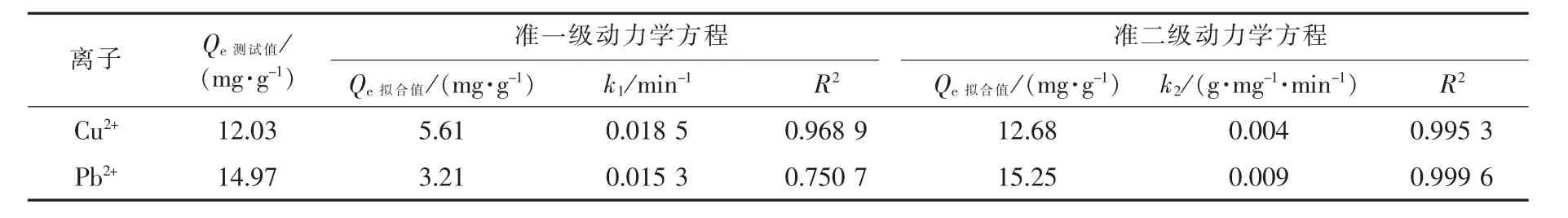
表1 SiO2/PAA 吸附剂对Cu2+、 Pb2+的吸附动力学模型拟合参数Tab. 1 Fitting parameters of adsorption kinetics of Cu2+and Pb2+by adsorbent SiO2/PAA
2.4 吸附机理分析
SiO2/PAA 吸附剂和吸附Cu2+、 Pb2+后所得吸附剂-离子络合物的红外光谱如图6 所示。 吸附剂-离子络合物在1 720 cm-1处的C===O 吸收峰强度明显比纯吸附剂的小, 说明C===O 断裂[17], 聚合物的羧羰基与重金属阳离子发生了配位作用。 羧羰基与离子的配位作用以及羧基负离子与金属阳离子的静电引力作用使得重金属离子与水体有效分离。吸附剂-Pb2+的C==O 吸收峰强度小于吸附剂-Cu2+,可见吸附剂与Pb2+的配位能力大于Cu2+。 Pb2+的电负性(2.33)大于Cu2+的电负性(1.90)[22], 因此Pb2+对羰基中π 电子的吸引力更强。
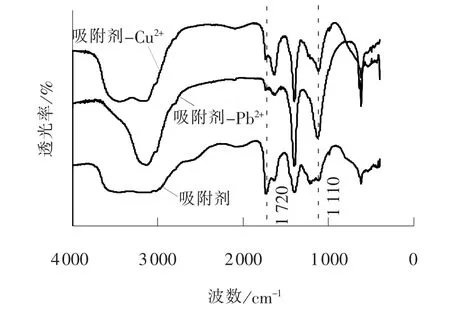
图6 吸附剂和吸附剂-离子络合物的红外光谱Fig. 6 IR spectra of adsorbent and adsorbent-iron complex
3 结论
(1) 当引发剂过硫酸钾的用量为单体质量的1%、 反应温度为70 ℃、 反应时间为4 h 时, 丙烯酸的单体转化率达到81.6%。 在吸附剂SiO2/PAA的质量分数为0.1%、 振荡速率为80 r/min、 pH 值为6、 温度为25 ℃、 吸附时间大于2 h 的条件下,吸附剂对Cu2+的平衡吸附量达到12.03 mg/g, Cu2+去除率达到60.15%, 对Pb2+的平衡吸附量达到14.97 mg/g, Pb2+去除率达到74.75%。
(2) SiO2/PAA 吸附剂对Cu2+、 Pb2+的化学吸附过程为速率决定步骤, 金属离子与吸附剂的配位作用是其能被有效去除的关键因素, 吸附速率及效果均为Pb2+优于Cu2+。
