青蒿琥酯通过NLRP3炎症小体抑制细胞焦亡减轻大鼠肾缺血-再灌注损伤
2021-11-15袁强申开文张瑞波王强吴玉婷沈俊
袁强 申开文 张瑞波 王强 吴玉婷 沈俊
肾缺血-再灌注损伤(ischemic-reperfusion injury,IRI)是一种严重的临床综合征,常见于肾移植手术,是影响肾移植受者术后恢复的主要因素之一[1-2]。炎症反应作为IRI主要发病机制之一,对于IRI导致的肾损伤具有重要意义。肾移植作为终末期肾病的重要治疗方式之一,可明显改善终末期肾病患者的生活质量。因此,通过减轻肾IRI中相关炎症反应,对于肾移植受者具有重要意义。然而,目前仍然缺乏通过减轻炎症反应治疗肾IRI的有效途径。研究表明,NOD样受体蛋白3(NOD-like receptor protein 3,NLRP3)、凋亡相关斑点样蛋白(apoptosis-associated speck-like protein containing CARD,ASC)和半胱氨酸天冬氨酸蛋白酶(cysteinyl aspartate specific proteinase,Caspase)-1 前体蛋白共同参与NLRP3炎症小体的组成,与炎症反应息息相关[3-4]。
青蒿琥酯作为由青蒿素衍生而来的水溶性半合成化合物,除具有强大的抗疟疾功效,还具有抗炎、抗氧化、抗肿瘤等多种药理作用[5-8]。近年来,因其显著的抗炎作用逐渐引起关注,有研究表明青蒿琥酯对于炎症具有积极的治疗作用[7-8]。目前仍缺乏青蒿琥酯在肾IRI中作用的相关报道,本研究旨在探讨青蒿琥酯对大鼠肾IRI的影响及其机制,为促进临床肾移植受者术后恢复提供参考。
1 材料与方法
1.1 实验动物与试剂
无特定病原体(specific pathogen free,SPF)级雄性SD大鼠25只,体质量200~220 g,购于辽宁长生生物技术股份有限公司。大鼠于40%~70%湿度、温度20~26 ℃、昼夜12 h明暗交替、自由饮水和进食条件下饲养。本实验获得贵州医科大学动物伦理委员会批准(2001317)。
青蒿琥酯购于江苏恒瑞医药股份有限公司,NLRP3炎症小体抑制剂INF39购于美国Selleck生物科技有限公司,苏木素-伊红(hematoxylin-eosin,HE)染液购于武汉阿斯本生物技术有限公司,高碘酸购于汕头西陇化工厂有限公司,碱性品红购于上海蓝季科技发展有限公司,血尿素氮(blood urea nitrogen,BUN)和血清肌酐(serum creatinine,Scr)测定试剂盒购于苏州格锐思生物科技有限公司,血清白细胞介素(interleukin,IL)-6和肿瘤坏死因子(tumor necrosis factor,TNF)-α检测试剂盒购于北京索莱宝科技有限公司。
免疫组织化学(免疫组化)抗体:IL-1β一抗购于美国GeneTex公司,二抗购于武汉阿斯本生物技术有限公司。免疫荧光抗体:Gasdermin D(GSDMD)一抗购于武汉爱博泰克(ABclonal)生物科技有限公司公司,NLRP3一抗购于江苏亲科(Affinity Biosciences)生物研究中心有限公司,Caspase-1一抗购于美国Santa Cruz公司,二抗购于武汉阿斯本生物技术有限公司。蛋白质印迹抗体:肾损伤分子(kidney injury molecule,KIM)-1一抗购于美国ThermoFisher公司,NLRP3、GSDMD、IL-1β一抗购于英国Abcam公司,Caspase-1购于江苏亲科(Affinity Biosciences)生物研究中心有限公司,二抗均购于武汉阿斯本生物技术有限公司。
1.2 模型建立与分组
将所有大鼠随机分为5组:假手术组(Sham组)、模型组(IRI组)、低剂量青蒿琥酯组(ART-L组)、高剂量青蒿琥酯组(ART-H组)和INF39组,每组5只。建模前2 h,ART-L组和ART-H组大鼠分别腹腔注射15 mg/kg、30 mg/kg 青蒿琥酯[9],INF39组大鼠腹腔注射7.5 mg/kg INF39[10],IRI组大鼠腹腔注射等量生理盐水。
根据大鼠的体质量,腹膜注射3%戊巴比妥钠(50 mg/kg)进行麻醉后,沿腹中线切开腹部,小心游离暴露双侧肾蒂后,用微动脉瘤夹钳夹住双肾蒂周围45 min后松开双侧夹钳。通过颜色变化监测缺血及再灌注是否成功。Sham组大鼠仅开腹游离暴露双侧肾蒂。用缝合线缝合腹部切口。手术后饲养24 h,对大鼠实施安乐死,收集血清和肾组织进行分析。
1.3 实验方法
1.3.1 大鼠肾功能检查 采用试剂盒检测各组大鼠BUN和Scr水平。
1.3.2 酶联免疫吸附试验 采用酶联免疫吸附试验(enzyme-linked immune absorbent assay,ELISA)试剂盒检测各组大鼠血清IL-6和TNF-α水平。
1.3.3 病理学检查 新鲜肾组织固定于4%多聚甲醛24 h以上,脱水后包埋在石蜡中。石蜡切片脱蜡水洗后进行HE染色和过碘酸-雪夫(periodic acid-Schiff,PAS)染色。
1.3.4 免疫组化染色 肾组织石蜡切片脱蜡后水洗,抗原修复,封闭。IL-1β一抗(1∶300)覆盖切片4 ℃孵育过夜,洗涤后辣根过氧化物酶(horseradish peroxidase,HRP)偶联的山羊抗兔二抗(1∶200)孵育,3,3'-二氨基联苯胺(3,3'-diaminobenzidine,DAB)在显微镜控制下染色,用光学显微镜CX-21观察和MicroPublisher获取图像,细胞核或细胞质染色呈黄褐色为阳性染色。
1.3.5 蛋白质印迹法 提取各组大鼠肾组织蛋白,检测KIM-1以及焦亡相关蛋白NLRP3、Caspase-1、GSDMD、IL-1β的表达。一抗覆盖聚偏氟乙烯膜4 ℃孵育过夜,洗涤后HRP偶联的二抗孵育1 h。使用化学发光对印迹进行检测,并通过Image J软件进行分析。
1.3.6 免疫荧光染色 肾组织石蜡切片脱蜡后水洗,抗原修复,封闭。载玻片滴加NLRP3一抗(1∶100)、Caspase-1一抗(1∶50)、GSDMD(1∶100)4 ℃孵育过夜,洗涤后荧光二抗孵育50 min,4',6-二脒基-2-苯基吲哚(4',6-diamidino-2-phenylindole,DAPI)染液孵育5 min,使用抗荧光淬灭剂封片。使用荧光显微镜IX51观察和MicroPublisher获取图像。
1.4 统计学方法
采用GraphPad Prism 7.01软件对数据进行统计学分析。符合正态分布的计量资料以均数±标准差表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 青蒿琥酯对大鼠肾IRI后肾损伤及血清学指标的影响
各组大鼠肾组织HE染色结果显示,与Sham组比较,IRI组肾组织损伤较重,部分肾小管萎缩变性,小管上皮出现颗粒变性或水样变性,细胞刷状缘脱落,可见蛋白管型、细胞管型改变及间质炎症充血表现(图1A)。各组大鼠肾脏组织PAS染色结果显示,与Sham组比较,IRI组大鼠肾组织部分肾小管上皮明显萎缩,刷状缘脱落,肾小管可见上皮细胞空泡化改变(图1B)。ART-L组、ART-H组及INF39组损伤较IRI组均减轻。

图1 各组大鼠肾组织病理学表现Figure 1 Renal histopathological features of rats in each group
IRI组的Scr和BUN水平较Sham组升高 ;ART-L组、ART-H组和INF39组Scr、 BUN水平较IRI组均下降,差异均有统计学意义(均为P<0.05,图2)。与Sham组比较,IRI组KIM-1蛋白表达水平升高;与IRI组比较,ART-L组、ART-H组及INF39组KIM-1蛋白表达水平均下降,差异均有统计学意义(均为P<0.05,图3)。

图2 各组大鼠肾功能血清学指标Figure 2 Serum indexes of renal function of rats in each group

图3 各组大鼠肾组织KIM-1蛋白表达水平Figure 3 The expression levels of KIM-1 protein in renal tissues of rats in each group
2.2 青蒿琥酯对大鼠肾IRI后肾组织及血清炎症因子的影响
免疫组化染色结果显示,与Sham组比较,IRI组、ART-L组、ART-H组及INF39组IL-1β表达增多;与IRI组比较,ART-L组、ART-H组和INF39组IL-1β表达均减少(图4)。ELISA检测结果显示,与Sham组比较,IRI组、ART-L组、ART-H组及INF39组TNF-α、IL-6水平均升高;与IRI组比较,ART-L组、ART-H组和INF39组TNF-α、IL-6水平均降低,差异均有统计学意义(均为P<0.05,图5)。

图4 各组大鼠肾组织IL-1β的表达情况Figure 4 Expression of IL-1β in renal tissues of rats in each group

图5 各组大鼠血清炎症因子的水平Figure 5 The levels of inflammatory factors in serum of rats in each group
2.3 青蒿琥酯对大鼠肾IRI后肾组织焦亡相关蛋白表达的影响
与Sham组比较,IRI组中NLRP3、Caspase-1、GSDMD及IL-1β蛋白表达水平均升高;与IRI组比 较,ART-L组、ART-H组 和 INF39组NLRP3、Caspase-1、GSDMD及IL-1β蛋白表达水平下降,差异均有统计学意义(均为P<0.05,图6A)。
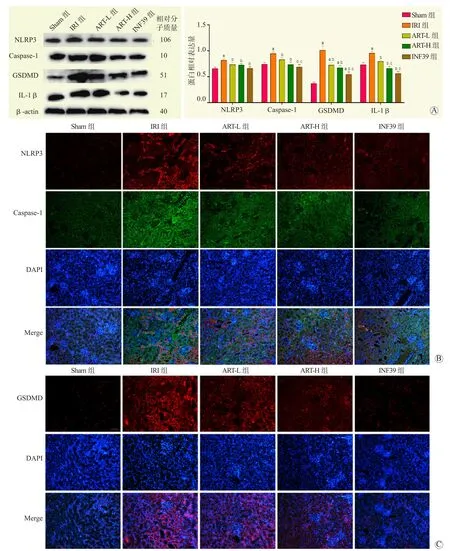
图6 各组大鼠肾组织焦亡相关蛋白的表达情况Figure 6 Expression of pyroptosis related proteins in renal tissues of rats in each group
免疫荧光染色结果(图6B、C)显示,与Sham组比较,IRI组NLRP3、Caspase-1及GSDMD蛋白表达均增多;与IRI组比较,ART-L组、ART-H组和INF39组NLRP3、Caspase-1及GSDMD蛋白表达均减少。
3 讨 论
肾IRI是一种常见的危重疾病,肾脏作为高灌注器官,对缺血缺氧十分敏感。目前,肾移植术中IRI的预后及转归效果常不能达到理想状态,显著增加了受者的住院时间。肾小管上皮细胞受损及炎症反应在肾IRI中扮演了重要角色,可加速慢性肾病的发展[11-12]。肾IRI中相关炎症反应主要病理过程表现为间质性炎症。肾IRI后,肾脏近曲小管、肾小球系膜细胞等可释放一系列促炎因子,经过血管内皮细胞到达损伤组织,进一步加重损伤[13]。
肾IRI过程会发生包括细胞焦亡在内的多种细胞死亡方式。细胞焦亡作为一种近年来发现的细胞死亡方式,其启动发生较细胞凋亡等更快,是一种受调控并同时伴有大量炎症介质释放的程序性细胞死亡方式,其特征是细胞肿胀、细胞膜上形成孔洞和释放促炎因子[14-15]。这一过程需要NLRP3炎症小体和GSDMD的参与[16]。一旦发生焦亡反应,GSDMD的N-端聚集并与脂类结合,在细胞膜上形成孔洞,细胞逐渐膨胀至细胞破裂,最终使包括IL-1β在内的大量细胞内含物释放,激活强烈的炎症反应[17-18]。
焦亡介导的炎症反应参与了肾IRI。NLRP3炎症小体及GSDMD在焦亡中发挥了重要作用,对于诱导炎症因子的产生至关重要,可反映炎症反应的程度。NLRP3炎症小体作为肾IRI中关键的因素,可在多种急性和慢性肾病的发病机制中发挥重要作用。大量研究表明,NLRP3炎症小体参与了肾脏炎症反应及肾损伤[19-22]。因此,抑制NLRP3炎症小体的表达对于肾IRI的防治具有巨大的潜力。NLRP3炎症小体在肾脏的足突细胞和肾小管上皮细胞中均可被激活,并增加相关炎症因子的表达[23]。然而,目前对于其治疗仍缺乏有效手段。本研究结果显示,大鼠肾IRI后,炎症因子的释放增加,肾损伤情况加重。而经青蒿琥酯预处理的大鼠,NLRP3炎症小体表达减少,相关炎症因子释放减少,肾组织损伤得到明显的改善,效果与INF39预处理相似,表明青蒿琥酯能够通过抑制肾IRI后NLRP3炎症小体诱导的细胞焦亡,减轻大鼠肾损伤。
青蒿琥酯作为青蒿素的衍生物,凭借其优越的抗炎作用被用于多种疾病的治疗,效果得到了广泛的认可。相关研究表明,青蒿琥酯可通过减轻炎症反应,在心脏IRI、脑IRI及糖尿病肾病中发挥保护作用[24-27]。有研究表明,青蒿琥酯可通过抑制NLRP3炎症小体发挥抗炎作用[24]。本研究发现,青蒿琥酯预处理后NLRP3炎症小体、GSDMD及相关炎症因子的表达明显减少,表明青蒿琥酯能在肾IRI中发挥显著的抗炎作用,减少焦亡相关蛋白的表达及肾组织损伤。
综上所述,青蒿琥酯可抑制NLRP3炎症小体诱导的细胞焦亡,减少肾IRI后焦亡相关蛋白的激活及炎症因子的释放,减轻肾IRI。
