谷子脂质转移蛋白基因SiLTP1的克隆及表达分析
2021-11-15孟凡花李臻王庆国刘炜
孟凡花,李臻,王庆国,刘炜
(1.山东师范大学生命科学学院,山东 济南 250014;2.山东省农业科学院湿地农业与生态研究所,山东 济南 250100)
脂质作为生物膜的主要组成成分,可通过形成疏水屏障将细胞与外界隔离,参与植物碳源和能量的储存、保护组织的形成、信号传导以及抵御病菌侵入等生理过程[1]。植物脂质转移蛋白(lipid transfer protein,LTP)是高等植物中大量存在的一种小型碱性蛋白,能够在体外可逆地结合并转运脂肪酸、磷脂、糖脂等多种疏水分子。LTP家族在植物中普遍存在,在拟南芥、水稻、小麦、玉米、油菜等中均已鉴定到大量LTP编码基因,其中在拟南芥和水稻全基因组中分别发现了79个和53个LTPs基因[2],在玉米和油菜中分别发现了77个和63个LTPs基因[3,4]。最初,根据蛋白分子量的大小,主要将植物中的LTP分为两类:LTPⅠ型和LTPⅡ型[5]。LTPⅠ型蛋白分子量大约为8~10 kDa,LTPⅡ型蛋白分子量约为7 kDa[6]。随着在植物中鉴定的LTP蛋白增多,已有的按蛋白分子量分类的方法已经满足不了区分不同种类LTP蛋白的需求。因此,Boutrot等[2]基于对水稻、小麦、拟南芥的全基因组分析,根据8个半胱氨酸序列的同源性将LTP蛋白分为9类(Ⅰ~Ⅸ)[2]。LTP成员具有多种生物学功能,主要涉及磷脂转运、信号转导、植物生殖发育、病原菌防御和非生物胁迫反应等多个生物学过程。已知在烟草中超表达小麦LTP3F1基因,转基因植株抗真菌病害能力得到增强[7];在山新杨中超表达ThLTP,转基因植株在逆境胁迫下相对野生株具有更强的抗胁迫能力[8,9]。表明LTP在植物适应各种逆境胁迫中发挥着重要作用。
谷子(Setaria italicaL.)俗称小米,又称为粟,是起源于我国的传统优势作物及粮饲兼用作物,在我国、印度、日本等广泛种植[10]。在禾本科植物中,谷子具有发达的根系、水分利用率高、蒸腾系数小、适应性强、抗旱抗盐碱能力突出、化肥农药用量少,是典型的抗旱节水作物及环境友好型作物。随着全球气候变化和我国工业化进程加快,我国水资源缺乏形势日益严峻,土壤盐渍化加重,盐碱地面积日益扩大。提高抗旱耐盐作物的种植比例是节约水资源、高效利用耕地的有效途径。而谷子作为一种节水耐旱耐盐碱作物,其在节水农业及可持续发展农业中的优势一目了然,也必将在应对世界水资源短缺中作为重要的战略储备作物发挥作用。
鉴于谷子LTP基因的功能研究还较少,本研究室前期通过TMT(tandem mass tags)蛋白定量方法解析了干旱胁迫下谷子的差异蛋白组,并鉴定到一个响应干旱胁迫的脂质转运蛋白(K3YAY4),干旱下其编码基因表达明显上调,进一步克隆到该基因并命名为SiLTP1(XM-004977323),并对SiLTP1进行了生物信息学分析和不同胁迫下的表达特性检测,为深入研究谷子LTP的生物学功能提供依据。
1 材料与方法
1.1 植物材料的培养与处理
挑选籽粒饱满的“豫谷一号”种子播种于96孔培养盒中,28℃恒温培养箱(光照16 h、黑暗8 h)水培两周至三叶期,分别用15%PEG6000处理,于0、2、6、12 h取幼苗叶片迅速放入液氮中-80℃保存备用;分别用200 mmol/L NaCl、50 μmol/L ABA、50μmol/L MeJA处理,于0、1、2、4、6、12、24 h取幼苗叶片迅速放入液氮中,-80℃保存备用。
1.2 试验方法
1.2.1 RNA的提取及反转录 使用TransZol Plant试剂盒(北京全式金生物技术有限公司)提取幼苗叶片的RNA,单链cDNA合成根据Prime-ScriptⅡ1st Strand cDNA Synthesis Kit试剂盒(北京宝日医生物技术有限公司)操作。
1.2.2 谷子SiLTP1基因的克隆 检索NCBI数据库获得SiLTP1核苷酸序列,使用Primer Premier 5设计基因特异引物SiLTP1-S1:5′-ACCAGCAAAGCAAAGCAC-3′和SiLTP1-A1:5′-GTATGTAGCGACGGTGGAG-3′,由青岛擎科生物工程有限公司合成。以谷子单链cDNA为模板进行PCR扩增。PCR体系为:TransStart FastPfuDNA Polymerase 0.5μL,5×TransStart FastPfubuffer 4μL,dNTP 2μL,SiLTP1-S1 1μL,SiLTP1-A1 1μL,单链cDNA 1μL,ddH2O补齐到20μL。反应程序:94℃5 min;94℃30 s,56℃30 s,72℃40 s,34个循环;72℃10 min。
PCR产物经电泳检测后,使用Easy-Pure Quick Gel Extraction Kit切胶回收目的基因片段,连接至pEASY®-Blunt3载体上,并转化到大肠杆菌Trans1-T1感受态细胞中,在含Amp(ampicillin,氨苄青霉素)抗性的LB平板上过夜培养,挑取单个菌斑,进行菌液PCR。将验证后的阳性克隆送到青岛擎科生物工程有限公司进行测序。
1.2.3 生物信息学分析 使用ExPASy网站(http://www.expasy.org/#)计算SiLTP1蛋白的理论分子量、等电点等基本参数,使用在线网站SMART(http://smart.embl-heidelberg.de/)对蛋白结构域进行预测,使用在线工具SignalP 4.1(http://www.cbs.dtu.dk/services/SignalP/)分析蛋白信号肽序列,通过TMHMM(http://www.cbs.dtu.dk/services/TMHMM/)对蛋白进行跨膜结构域分析,利用SOPMA(https://www.expasy.org/proteomics)预测蛋白的二级结构,运用SWISS MODEL(https://swissmodel.expasy.org/interactive)在线预测蛋白的三级结构,利用DNAMAN软件对来自不同植物的LTP氨基酸序列进行同源比对分析,利用MEGA 7.0软件中的Neighbor-Joining(邻位相连法,NJ)构建系统进化树。
1.2.4 qRT-PCR检测SiLTP1在不同处理下的表达模式 根据SiLTP1基因全长序列,使用Beacon Designer 8设计荧光定量PCR引物SiLTP1-S2:5′-ATGGCTCGCGCTCAGGTGGTG-3′和SiLTP1-A2:5′-CACTTGGATGGGATGCTGGC-3′,以谷子持家基因SiActin(NCBI登录号:XM-004978702)为内参,在ABI PRISM 7900HT(Applied Biosystems)荧光定量PCR仪上进行目的片段扩增。扩增体系为20μL,包括:稀释10倍的cDNA模板1μL,SiLTP1-S2 1μL,SiLTP1-A2 1μL,2×Rox 10μL,ddH2O 7μL。扩增条件:95℃10 min;之后95℃15 s,60℃1 min,40个循环;95℃15 s;60℃1 min;95℃15 s;60℃15 s。使用2-ΔΔCt算法计算SiLTP1基因在不同处理下的相对表达量。
2 结果与分析
2.1 谷子SiLTP1基因的克隆
以谷子单链cDNA为模板,以SiLTP1-S1、SiLTP1-A1为引物进行PCR扩增,得到一条354 bp的条带(图1)。将目的条带切胶回收后与克隆载体pEASY®-Blunt3连接,转化大肠杆菌,通过菌液PCR验证,且测序结果正确,证明其为目的基因,并命名为SiLTP1。

图1 SiLTP1 cDNA的PCR克隆
2.2 SiLTP1编码蛋白的生物信息学分析
2.2.1 SiLTP1编码蛋白的结构分析 使用Ex-PASy网站对SiLTP1核苷酸序列进行分析,结果显示,该基因编码117个氨基酸残基,其编码蛋白分子量为11.5 kDa,等电点为9.24,不稳定指数33.94,推测SiLTP1蛋白属于碱性稳定蛋白。
使用在线网站SMART对SiLTP1基因编码蛋白结构域进行预测,结果(图2)显示,在第7~26个氨基酸之间含有一个跨膜螺旋区域。另外,在第28~113个氨基酸之间还有一个AAI结构域,该结构域存在于植物脂质转运蛋白、种子贮藏蛋白及α-淀粉酶抑制剂结构域家族蛋白中。

图2 SiLTP1蛋白结构域预测
2.2.2 SiLTP1蛋白信号肽和跨膜结构域分析
通过SignalP 4.1对SiLTP1蛋白序列进行信号肽分析,结果(图3)显示,第1~28个氨基酸残基为信号肽序列,第29个和第30个氨基酸残基之间为信号肽裂解点。通过TMHMM对SiLTP1蛋白序列进行跨膜结构域分析,结果显示,在第7~26个氨基酸处存在一个螺旋跨膜区(图4),N端位于膜内,C端位于膜外。

图3 SiLTP1蛋白信号肽预测
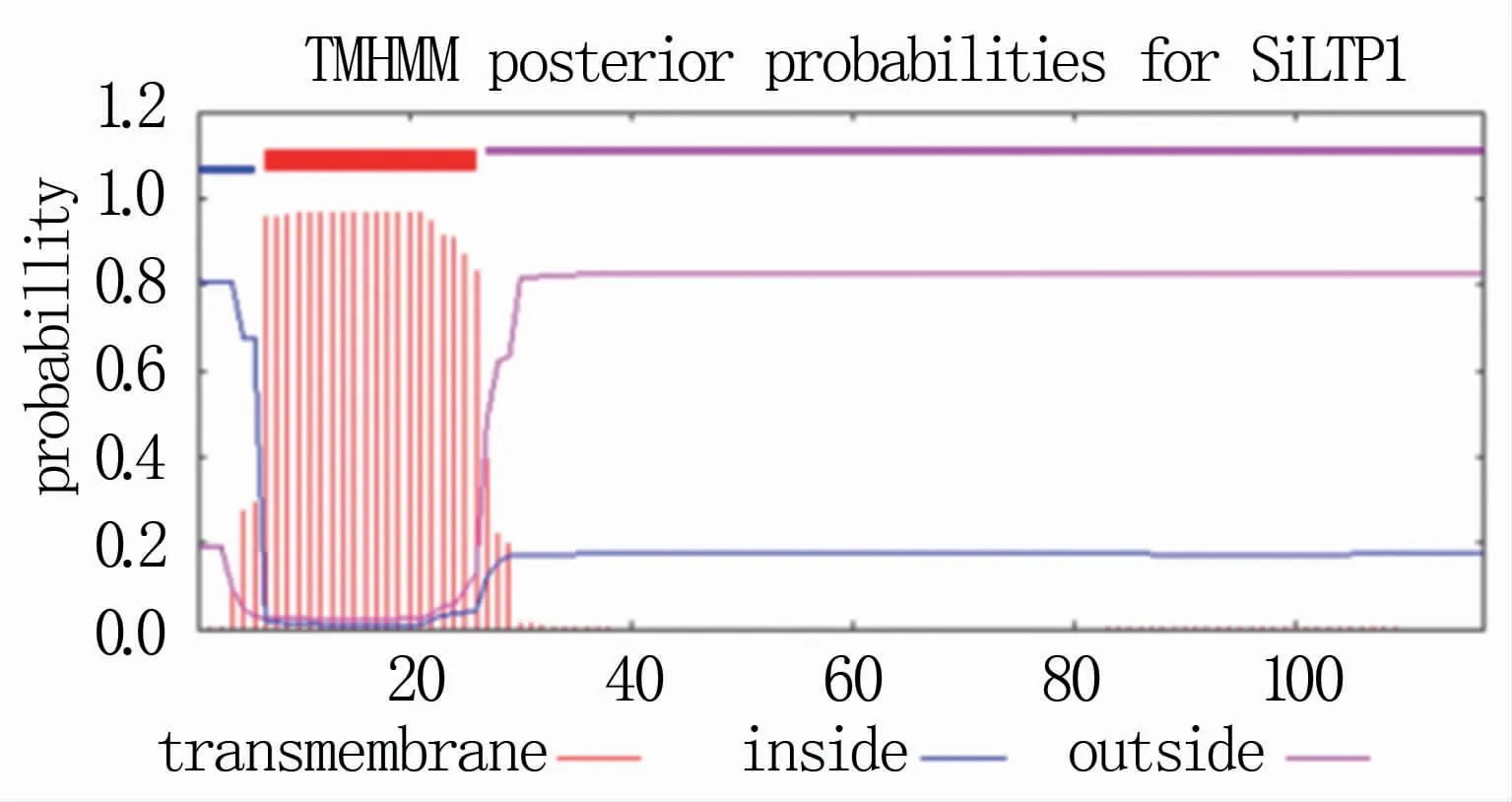
图4 SiLTP1蛋白跨膜结构域分析
2.2.3 谷子SiLTP1蛋白的二级及三级结构预测
采用SOPMA进行SiLTP1蛋白二级结构分析,结果(图5)显示其二级结构主要由α-螺旋(alpha helix,55.56%)、无规则卷曲(random coil,34.19%)、延伸链(extended strand,8.55%)组成。利用SWISS-MODEL对SiLTP1蛋白进行三维结构建模,结果(图6)显示,SiLTP1蛋白主要由α-螺旋和无规则卷曲组成;螺旋结构折叠形成一个中心疏水性裂隙,用于结合疏水性配体。

图6 SiLTP1蛋白的三级结构预测
2.2.4 部分LTP蛋白的同源比对分析 利用DNAMAN对来自谷子、水稻(Oryza sativa,Os)、拟南芥(Arabidopsis thaliana,At)、腊梅(Chimonanthus praecox,Cp)、陆地棉(Gossypium hirsutum,Gh)的代表性LTP蛋白序列进行同源比对。结果显示,SiLTP1含有典型的8个高度保守的Cys位点,其分布为28-C-38-C-53-C-54-C-74-C-76-C-99-C-113-C(其中C表示半胱氨酸,数字表示氨基酸残基所在位置);并且具有LTP保守的T/S-X-X-D-R/K五肽结构域(图7),该结构域与脂质结合、转运有关。
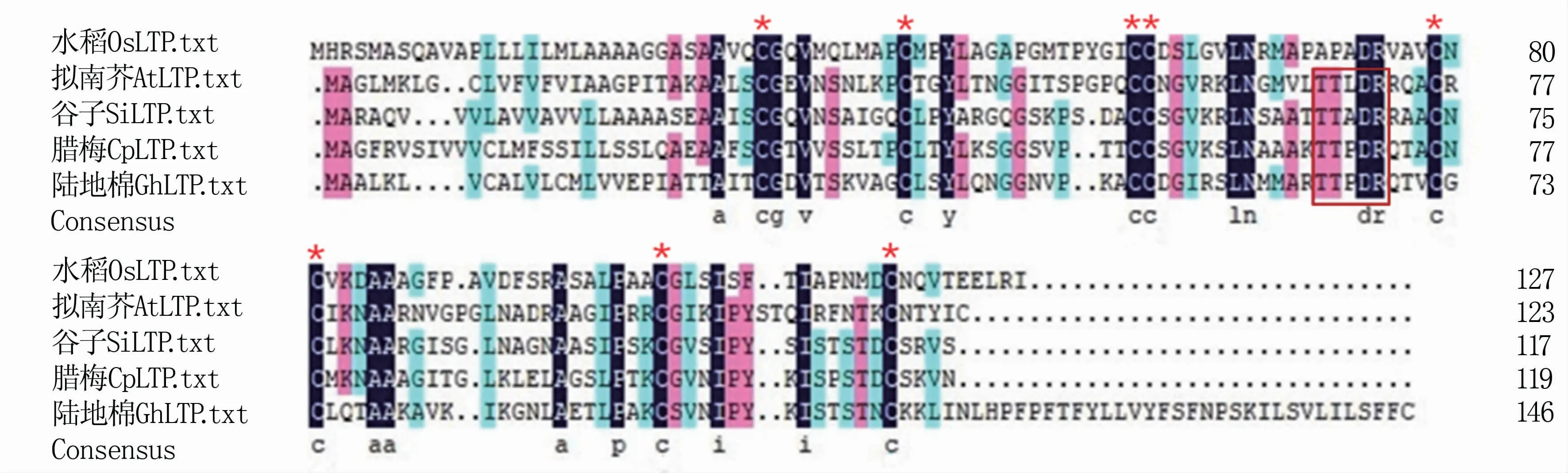
图7 部分LTP蛋白的同源比对分析
2.2.5 SiLTP1的进化树分析 利用MEGA 7.0对谷子中的SiLTP1蛋白与来自拟南芥、水稻的LTP蛋白构建进化树,结果(图8)显示,SiLTP1在进化关系上与水稻的第一亚族LTP亲缘关系较近,显示SiLTP1属于LTP家族中的TypeⅠ类。
2.3 SiLTP1基因表达模式分析
2.3.1 盐胁迫、PEG模拟干旱胁迫下SiLTP1表达模式分析 如图9所示,在200 mmol/L NaCl处理下,SiLTP1的表达出现先增加后降低的趋势,且在盐处理6 h基因表达量达到最高,其表达水平约为对照的160倍,之后其表达量随处理时间的延长而逐渐降低,但仍显著高于对照。经15%PEG6000模拟干旱处理后,SiLTP1表达量在处理6 h后显著升高,表达量约是未处理的17倍,之后随干旱处理时间的延长,基因表达量有所下降。

图9 SiLTP1在不同胁迫处理下的表达模式分析
2.3.2 各激素处理下SiLTP1表达模式分析 如图10所示,在不同激素处理下,SiLTP1具有不同的响应模式。经ABA处理24 h,SiLTP1表达表现为先上调后下降的趋势,处理8 h,基因表达量达到最高,约为对照的33倍。MeJA处理4 h,SiLTP1表达量达到最大值,约为处理前的13倍,之后基因表达量逐渐降低。
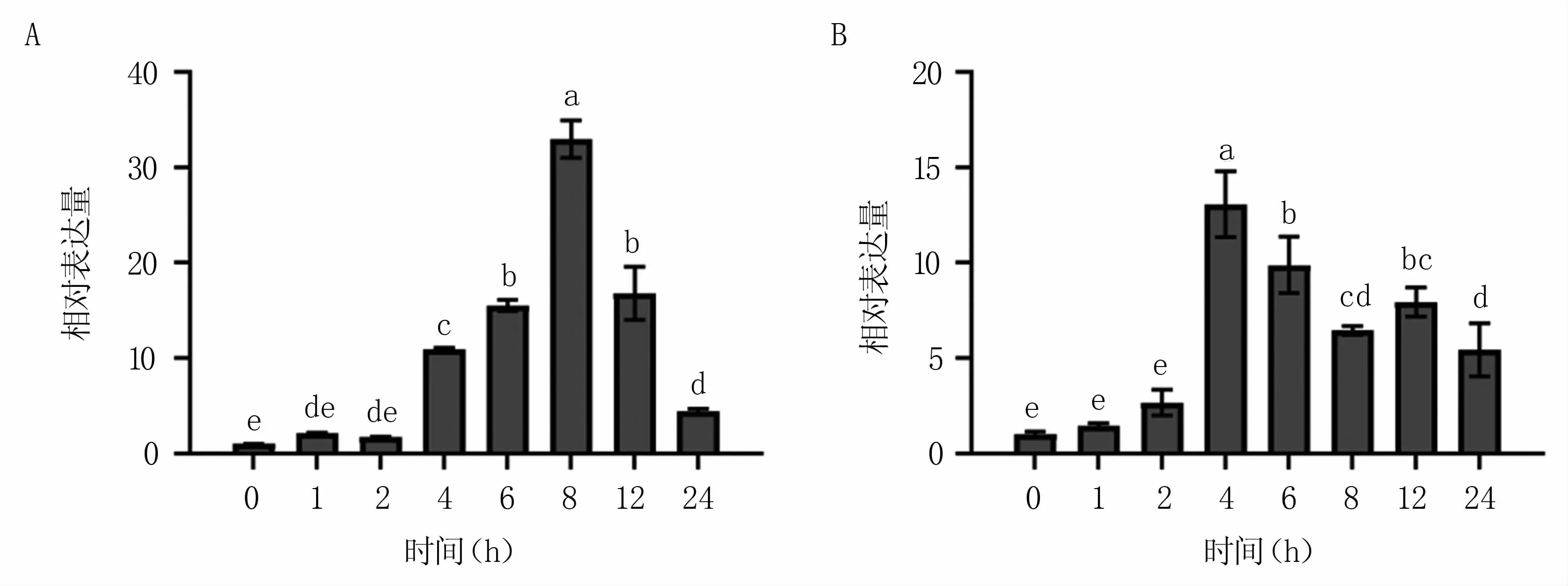
图10 SiLTP1在不同激素处理下的表达模式分析
3 讨论
研究表明,植物脂质转移蛋白是一类由多拷贝基因家族编码的碱性小分子蛋白,能够在体外可逆地结合并转运脂肪酸、磷脂、糖脂等多种疏水分子[11]。植物LTP的分子量较小,通常为6.5~10.5 kDa,等电点一般在8.5~12.0,其在植物中含量丰富,约占可溶性蛋白总量的4%[12-18]。LTP具有相似的结构特征,包括N端由21~27个氨基酸残基组成、能够引导蛋白分泌到细胞外参与细胞外亲脂性物质(如角质)沉积的信号肽,以及由8个高度保守的半胱氨酸组成的4个二硫键,其结构模型为Cys1-Xn-Cys2-Xh-Cys3Cys4-Xn-Cys5-Cys6-Xn-Cys7-Xn-Cys8;同时在C端有一非螺旋区用来结合并稳定脂质[19,20]。
本研究通过对克隆获得的SiLTP1基因进行生物信息学分析发现,SiLTP1基因编码117个氨基酸,蛋白分子量为11.5 kDa,等电点为9.24。将谷子与不同植物中的LTP蛋白构建进化树,发现SiLTP1属于LTP家族中的TypeⅠ类。SiLTP1具有脂质转移蛋白家族典型的8 CM结构、碱性等电点、N端信号肽序列、跨膜结构域等,具备4个α-螺旋和无规卷曲组成的三级结构。综上所述,SiLTP1基因编码蛋白符合LTP蛋白的结构特征。
早期研究报道,植物脂质转移蛋白在植物抵抗生物胁迫和非生物胁迫过程中有着重要的作用,已知重金属处理、冷胁迫、干旱胁迫、盐胁迫、激素(如ABA)以及病原物侵染都会诱导LTP基因的表达[21]。对于生物胁迫,早在1997年,Molina等[22]通过将大麦LTP2基因转入烟草,发现可以明显抑制烟草丁香假单胞杆菌的生长;Patkar等[23]研究表明,在玉米中过表达LTP基因能够提高受体材料对稻瘟病、白叶枯病等的抗病性;Choi等[24]研究表明,过表达NtLTP1的转基因烟草显示出蚜虫抗性。对于非生物胁迫,近年来,刘勇[25]研究发现通过在玉米中过表达ZmLTPL63可以提高植株抗氧化能力,从而提高植株对干旱和盐胁迫的耐受性。徐扬[26]研究发现NtLTP4基因可以作为正调控因子参与植物的非生物胁迫响应。小麦TdLTP4基因在拟南芥中过表达能够提高其抗旱和抗盐能力[27]。超表达脂质转运蛋白AZI能够增强植物对盐的耐受性,体内外实验证明,AZI可通过与有丝分裂原活化的蛋白激酶MPK3结合发挥作用[28]。鉴于LTP家族在植物逆境胁迫信号的响应过程中的重要作用,推测同属该家族的SiLTP1基因在谷子抗逆过程中也具有相似的生物学功能。
为了进一步明确SiLTP1在各种环境胁迫下的表达特性,通过qRT-PCR方法分析了SiLTP1基因在干旱、高盐、ABA以及MeJA处理下的表达情况。其中,盐处理后,基因表达量显著升高,说明SiLTP1可响应盐胁迫,且在盐处理6 h时其表达量约为未处理时的160倍,响应程度较高,显示该基因可能在谷子盐胁迫响应过程中发挥重要作用。PEG模拟干旱处理也可诱导基因的表达,且在处理6 h时基因表达量出现明显上调,显示该基因可能参与了谷子的干旱胁迫响应。激素处理条件下,谷子幼苗经ABA处理后,SiLTP1基因的表达量在8 h时达到未处理时的33倍,表明SiLTP1的表达受ABA的影响,推测该基因可能参与ABA依赖信号转导途径。经MeJA处理后基因表达量也有明显升高,已知MeJA是植物抗病防御过程中的重要信号分子,表明SiLTP1基因可能参与致病菌的防御过程。综合分析该基因在各处理下响应程度的不同,推测谷子SiLTP1基因作为LTP家族成员,可能在谷子抗逆、抗病等过程中发挥作用,并主要参与盐胁迫的响应和应答途径及ABA调控的相关途径。但其具体的生物学功能及作用机制还需要进一步研究。
