怀玉山三叶青查尔酮合酶基因克隆和表达分析
2021-11-15洪森荣刘佳刘军刘依婷陈荣华蔡红
洪森荣,刘佳,刘军,刘依婷,陈荣华,蔡红
(1.上饶师范学院生命科学学院,江西 上饶 334001;2.上饶市药食同源植物资源保护与利用重点实验室/上饶市三叶青保育与利用技术创新中心/上饶农业技术创新研究院,江西 上饶 334001;3.上饶市红日农业开发有限公司,江西 上饶 334700)
三叶青(Tetrastigma hemsleyanumDiels et Gilg)又名金丝吊葫芦,葡萄科(Vitaceae)崖爬藤属植物,是我国特有珍稀药用植物,也是民间常用药,主要分布在我国的浙、赣、湘、闽、粤、滇、桂、川等地区[1]。三叶青性寒味苦,具有祛风化痰、活血散结、消炎止痛和清热解毒等功效,以地下块茎和果实的药用效果最好[2]。现代药理实验和临床应用表明,三叶青无毒、无副作用、无耐药性,具有抗病毒、抗肿瘤、抗炎解热、镇痛保肝以及免疫调节等多种药理作用,被誉为“植物抗生素”[3]。
黄酮类化合物是一类重要的植物次生代谢产物,不但能抗毒、调节生长、清除活性氧、抵抗紫外辐射,还能抗氧化、抗肿瘤、调节机体免疫力、清除自由基[4]。查尔酮合酶(CHS)是黄酮类化合物生物合成过程中第一个限速酶和关键酶,主要催化丙二酰辅酶A和对羟基苯丙烯酰辅酶A缩合生成异黄酮、黄酮醇、黄烷酮和花青素等物质的共同前体查尔酮,从而为合成黄酮类化合物提供基本碳链骨架[5]。查尔酮合酶对植物生长发育的某些生理过程,如花色形成、根瘤形成、生物和非生物胁迫响应、抵御紫外辐射伤害等,具有重要作用[6]。因此,克隆三叶青查尔酮合酶基因并进行qRT-PCR(实时荧光定量PCR)分析,对研究查尔酮合酶基因在三叶青中的表达和三叶青黄酮类化合物的合成机理具有重要意义。
关于查尔酮合酶研究的报道较多,如韩颖颖等[7]对蝴蝶兰查尔酮合酶基因cDNA进行了克隆、鉴定和原核表达;谢修志等[8]对非洲菊查尔酮合酶基因进行了克隆、序列分析,并在大肠杆菌中表达;谭晓风等[9]对油茶查尔酮合酶和异构酶基因进行了cDNA克隆和序列分析;和凤美和朱永平[10]构建了东方百合“元帅”查尔酮合酶基因的表达载体;吴琦等[11]对苦荞查尔酮合酶基因的结构及花期不同组织表达量进行了分析;伍翀等[12]研究了黄芩查尔酮合酶基因内含子在转基因烟草中对GUS活性的调控;汪结明等[13]对矮牵牛查尔酮合酶基因进行了生物信息学分析;李成磊等[14]对甜荞查尔酮合酶基因进行了克隆和序列分析;夏芳等[15]研究了水母雪莲查尔酮合酶基因的克隆、表达和活性;汪孟曦等[16]克隆了白木香的查尔酮合酶基因AsCHS1,并进行了生物信息学分析;李星和王红[17]对虎杖查尔酮合酶基因PcCHS1进行了克隆与功能分析;刘姗等[18]克隆了金龙胆草查尔酮合酶基因并对其在花期不同组织中的表达进行了分析;王佳媛等[19]克隆了海南龙血树查尔酮合酶基因DcCHS,并分析了其在花、根、茎、叶和果实中的表达量;齐宇和赵兰勇[20]克隆了玫瑰查尔酮合酶基因,并对其进行了生物信息学分析;马立功等[21]克隆了向日葵查尔酮合酶基因HaCHS,并对其逆境应答进行了研究;赵风治等[22]克隆了花椰菜的查尔酮合酶基因,并对其功能进行了分析;孟衡玲等[23]克隆了铁皮石斛查尔酮合酶基因,并对其表达进行了分析;孙威等[24]克隆了日本蛇根草查尔酮合酶基因,并对其生物信息学进行了分析;潘德灼等[25]克隆了红树植物秋茄查尔酮合酶基因,并对其在盐胁迫下的表达进行了分析;赵学荣等[26]克隆了苦荞查尔酮合酶基因FtCHS1启动子,并对其在低温(4℃)和光照(UV-B)处理下的表达进行了分析;周姗等[27]克隆了乌拉尔甘草查尔酮合酶基因,并对其进行了序列分析;胡会刚[28]和徐僡[29]等分别对香蕉查尔酮合酶基因家族和金钗石斛的查尔酮合酶基因进行了生物信息学分析。
目前,对三叶青的研究主要集中在化学成分、药理临床、种植栽培、组织培养等方面[1,3],关于三叶青查尔酮合酶方面的研究尚未见报道。本研究利用RT-PCR技术克隆了怀玉山三叶青查尔酮合酶基因,并采用生物信息学方法和qRTPCR进行序列分析和组织表达分析,可为揭示怀玉山三叶青查尔酮合酶的生物学功能提供理论依据,为从分子水平调控怀玉山三叶青黄酮醇成分代谢及体外催化合成黄酮醇提供新思路。
1 材料与方法
1.1 试验材料
怀玉山三叶青2个栽培种‘怀玉1号’和‘怀玉2号’试管苗。
1.2 试验方法
1.2.1 总RNA的提取和cDNA第一链的合成 用Trizol试剂提取怀玉山三叶青‘怀玉2号’试管苗的总RNA,提取步骤按说明书进行,使用紫外分光光度计和琼脂糖凝胶电泳检测RNA的浓度和完整性。以提取获得的RNA为模版,按照MMLV cDNA第一链合成试剂盒说明书合成cDNA第一链,逆转录引物用Oligo(dT)18 Primer(5′-GGCCACGCGTCGACTAGTACTTTTTTTTTTTTTTTT TT-3′),具体步骤按说明书进行。
1.2.2 查尔酮合酶基因的克隆 利用转录组组装的Unigene序列信息(TRINITY_DN16981_c0_g3),运用Primer Premier 5.0设计引物(F:5′-ATGGCGGCCACCATGACCG-3′;R:5′-TCATGCGGTTGCCCCGGCGGT-3′)。PCR扩增条件:95℃2 min;95℃30 s,62.8℃30 s,72℃30 s,35个循环;72℃10 min。PCR产物经1%琼脂糖凝胶电泳检测后,将含有目的基因的条带与pMD19-T载体连接并用热激法转化到感受态细胞E.coliDH5α,经鉴定正确的阳性转化子提取质粒送往上海生工生物工程有限公司进行测序。
1.2.3 查尔酮合酶基因的生物信息学分析 使用BioEdit软件翻译基因序列为氨基酸序列,用ProtParam预测酶的理化性质,用ProtScale预测酶的疏/亲水性。使用GOR I软件在线预测酶的二级结构。使用SWISS-MODEL在线预测酶的三级结构。采用WoLFPsort在线预测基因的表达部位。通过软件DNAMAN和Bioedit进行氨基酸序列比对,利用MEGA 5.0软件进行系统进化树的构建。
1.2.4 查尔酮合酶基因的组织表达分析 分别取怀玉山三叶青2个栽培种‘怀玉1号’和‘怀玉2号’试管苗的根、茎、叶RNA 500 ng,反转录为cDNA。qRT-PCR(SYBR Green I)检测内参基因为GAPDH。设计引物F为5′-CACGAGTCCCACCTCGACTC-3′,R为5′-AGGGGACGCTCCACGGACA-3′,大小为104 bp,Tm为59.2。qRT-PCR检测采用16μL反应体系(SYBR Green Mix 7μL,Primer-F 0.5μL,Primer-R 0.5 μL,cDNA 8μL),PCR反应程序:95℃10 min;95℃10 s,60℃34 s,95℃15 s,40个循环。使用2-△△Ct法计算基因表达水平。试验重复3次。
试验所有数据表示为平均值±标准差,并使用SPSS 19.0软件进行统计分析,应用单因素方差分析(one-way ANOVA)检验查尔酮合酶基因组织表达的差异显著性(P<0.05)。
2 结果与分析
2.1 怀玉山三叶青查尔酮合酶基因cDNA序列
怀玉山三叶青查尔酮合酶基因cDNA总长度为1 143 bp(图1、图2),G+C和A+T含量分别为65.27%和34.73%(图3)。

图1 怀玉山三叶青查尔酮合酶基因PCR扩增

图2 怀玉山三叶青查尔酮合酶基因碱基组成
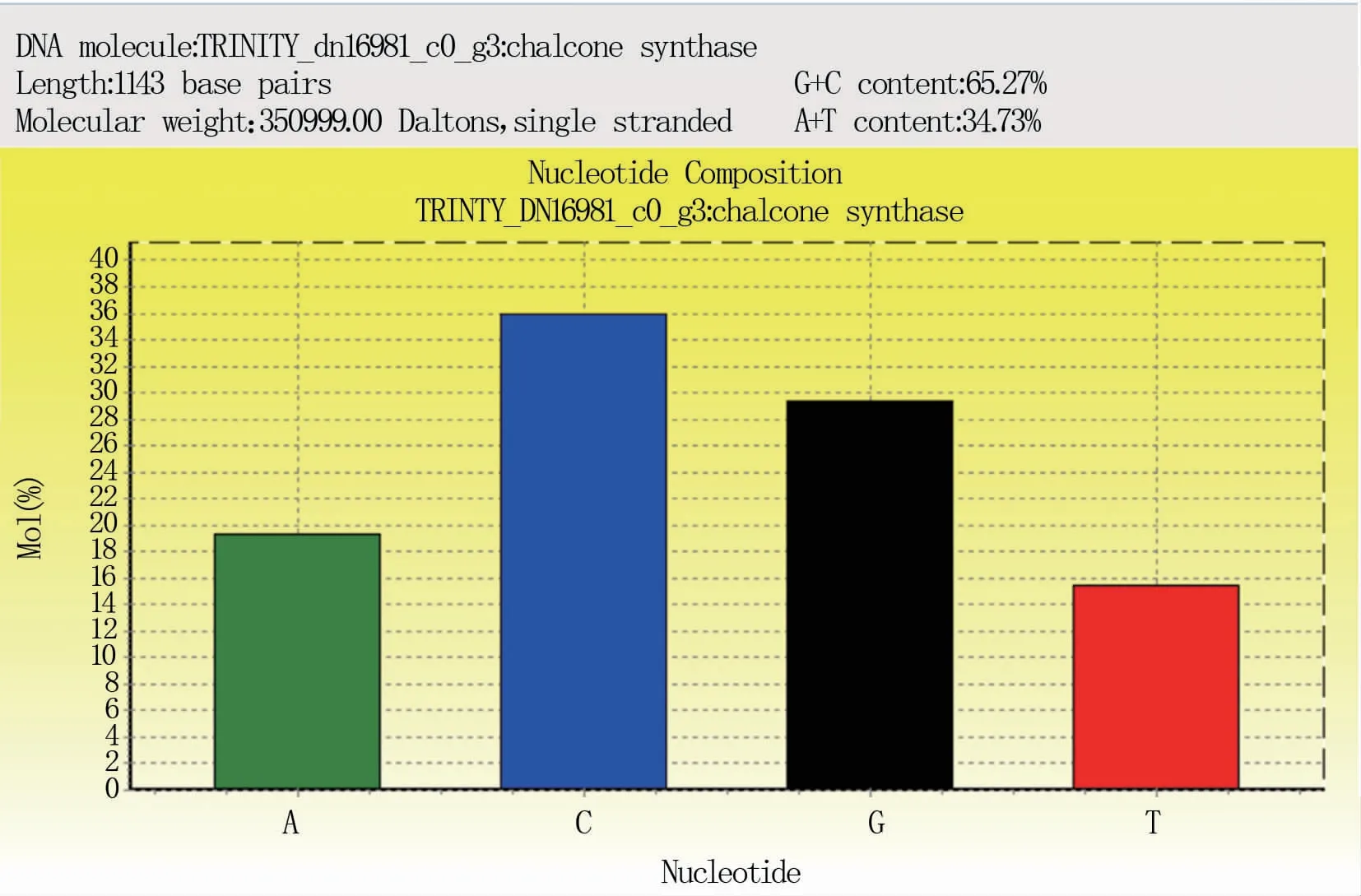
图3 怀玉山三叶青查尔酮合酶基因各碱基的比例
2.2 怀玉山三叶青查尔酮合酶氨基酸序列
怀玉山三叶青查尔酮合酶氨基酸序列见图4。怀玉山三叶青查尔酮合酶由380个氨基酸组成,分子量41 809.23 Da,等电点6.19,为亲水性蛋白。各氨基酸的数目和比例为Ala(A)37、9.7%,Arg(R)20、5.3%,Asn(N)9、2.4%,Asp(D)23、6.1%,Cys(C)7、1.8%、Gln(Q)12、3.2%,Glu(E)24、6.3%,Gly(G)30、7.9%,His(H)12、3.2%,Ile(I)18、4.7%,Leu(L)34、8.9%,Lys(K)22、5.8%,Met(M)17、4.5%,Phe(F)13、3.4%,Pro(P)17、4.5%,Ser(S)20、5.3%,Thr(T)20、5.3%,Trp(W)4、1.1%,Tyr(Y)9、2.4%,Val(V)32、8.4%。带负电荷残基(Asp+Glu)总数为47,带正电荷残基(Arg+Lys)总数为42。估计半衰期为30 h(哺乳动物网织红细胞,体外),>20 h(酵母,体内),>10 h(大肠杆菌,体内)。失稳指数(II)为40.92,因此将该蛋白分类为不稳定蛋白。

图4 怀玉山三叶青查尔酮合酶氨基酸序列
2.3 怀玉山三叶青查尔酮合酶亲疏水性分析
在图5中,峰值(正值)区域表示疏水区域,而低谷区域(负值)是亲水区域。可见,最大疏水值在2.25左右,说明该处的疏水性最强;亲水峰值最大为-2.50左右。该蛋白整体表现出高度的亲水性,为亲水蛋白。

图5 怀玉山三叶青查尔酮合酶亲疏水值分布
2.4 怀玉山三叶青查尔酮合酶的二级、三级结构分析
怀玉山三叶青查尔酮合酶的二级结构预测结果(图6)显示,其二级结构由α-螺旋(Hh,37.37%)、β-片层(Ee,19.47%)、无规则卷曲(Cc,43.16%)构成,且无规则卷曲、β-片层和α-螺旋散布于整个蛋白中(图7)。
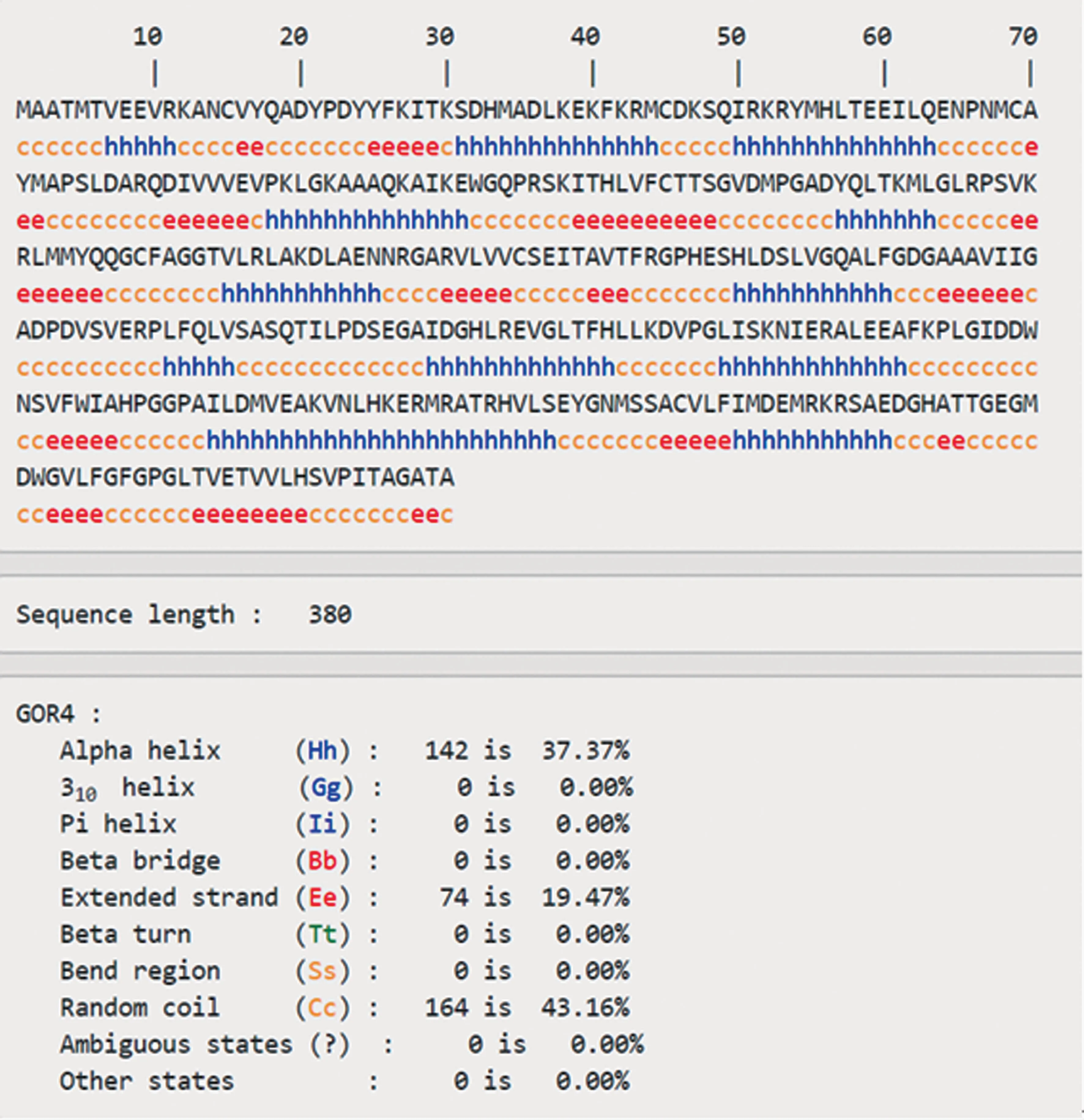
图6 怀玉山三叶青查尔酮合酶的二级结构预测结果

图7 怀玉山三叶青查尔酮合酶二级结构各部分的分布
三级结构是多个二级结构元素在三维空间排列形成的,SWISS-MODEL预测显示怀玉山三叶青查尔酮合酶的三级结构为二聚体(图8)。
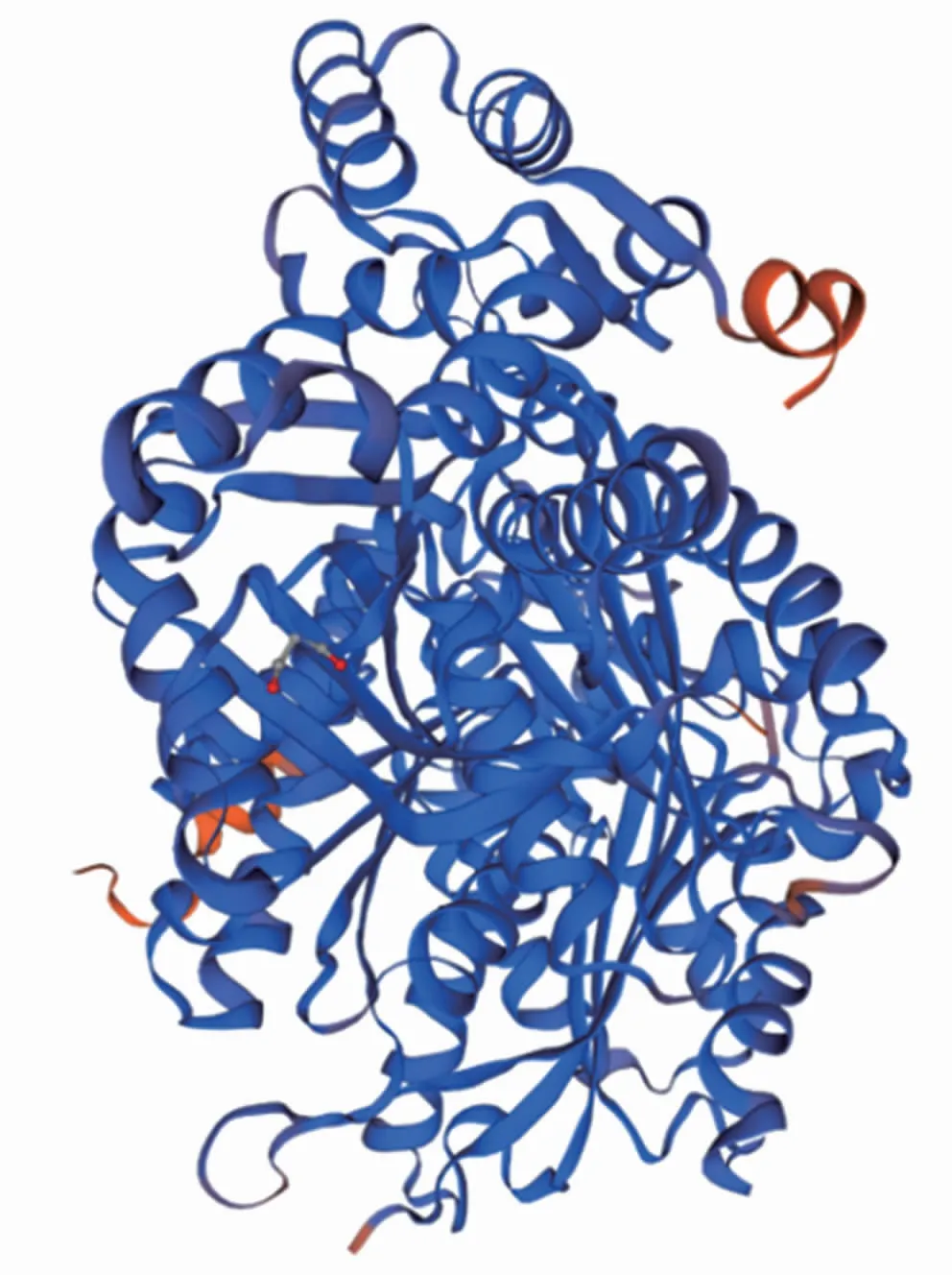
图8 怀玉山三叶青查尔酮合酶三级结构
2.5 怀玉山三叶青查尔酮合酶的亚细胞定位
对怀玉山三叶青查尔酮合酶基因表达部位的预测结果(图9)显示,定位于细胞核中的数量为6,定位于线粒体中的数量为5,定位于细胞质中的数量为2,定位于细胞外的数量为1。表明其主要存在于细胞核和线粒体中。

图9 怀玉山三叶青查尔酮合酶亚细胞定位
2.6 怀玉山三叶青查尔酮合酶系统进化分析
由构建的进化树(图10)可见,怀玉山三叶青查尔酮合酶与硬粒小麦(Triticum turgidumsubsp.durum)、节节麦(Aegilops tauschiisubsp.tauschill)、小麦(Triticum aestivum)的查尔酮合酶在一个大分支下,说明他们之间亲缘关系较近,尤其是与硬粒小麦未命名蛋白产物VAH38240.1亲缘关系最近。
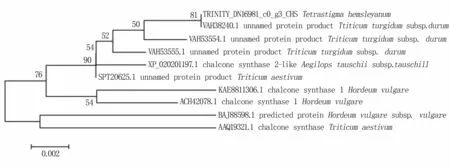
图10 怀玉山三叶青查尔酮合酶系统进化分析
2.7 怀玉山三叶青查尔酮合酶同源蛋白的序列比对信息
保守结构域是指在生物进化过程中不变或者一个蛋白家族中相同的结构域,一般具有重要的功能,不能被改变。图11中“※”号区域即为怀玉山三叶青查尔酮合酶蛋白家族的保守结构域,可见其同源蛋白保守结构域较为丰富。怀玉山三叶青在15到32位点氨基酸缺失,在其他位点与硬粒小麦(Triticum turgidumsubsp.durum)、节节麦(Aegilops tauschiisubsp.tauschill)、小麦(Triticum aestivum)完全一致,说明怀玉山三叶青查尔酮合酶与硬粒小麦、节节麦、小麦的查尔酮合酶同源性较高。

图11 怀玉山三叶青查尔酮合酶基因氨基酸序列的同源性比较
2.8 怀玉山三叶青2个栽培种不同器官中查尔酮合酶基因的表达分析
由图12可见,怀玉山三叶青查尔酮合酶基因在‘怀玉1号’和‘怀玉2号’栽培种根、茎、叶中均有表达,但表达量在不同器官间差异显著,其中,根中表达量最高,叶中最低。

图12 怀玉山三叶青2个栽培种不同器官中 查尔酮合酶基因相对表达量分析
3 讨论
三叶青地下块根中的药用成分主要有黄酮、多糖及多酚等[1],其中,黄酮类物质,如山奈酚芸香糖苷、芦丁、异槲皮苷、儿茶素、紫云英苷等均具有药理活性[3]。合成黄酮类化合物的关键酶之一是查尔酮合酶[5]。查尔酮合酶基因的突变、沉默或过表达会影响三叶青黄酮类物质的合成,对其功能和产量产生一定影响。因此,研究查尔酮合酶基因的结构和表达方式,将有助于明确三叶青黄酮合成的分子机制,提高三叶青中黄酮含量。
本研究从怀玉山三叶青中克隆到查尔酮合酶全长基因,cDNA总长度为1 143 bp,G+C含量为65.27%;该基因编码的蛋白质具有查尔酮合酶家族保守存在的功能位点及结构域,由380个氨基酸组成,分子量41 809.23 Da,等电点6.19,是一种亲水性、不稳定蛋白,与硬粒小麦(Triticum turgidumsubsp.durum)未命名蛋白产物VAH38240.1的亲缘关系最近。研究表明,G+C的含量越高,基因稳定性越高[7-29]。怀玉山三叶青查尔酮合酶基因的G+C含量大于50%,推测其处于相对稳定的状态,有助于该基因在进化过程中稳定遗传。此外,作为黄酮类化合物代谢途径的第一个关键限制酶,怀玉山三叶青查尔酮合酶基因的组织表达情况可能会对黄酮合成和累积造成影响,进而影响三叶青药材的品质。本研究结果表明,该基因在怀玉山三叶青2个栽培种的根、茎、叶中均有表达,但器官间存在显著差异,均以根中的表达量最高,叶中最低。本研究结果为进一步探究怀玉山三叶青查尔酮合酶的功能及表达调控奠定了理论基础。
4 结论
怀玉山三叶青查尔酮合酶具有查尔酮合酶典型的结构特征,氨基酸序列及核苷酸序列与同源物种相似度高,在进化上高度保守,且怀玉山三叶青查尔酮合酶基因的表达存在组织器官差异性,根中表达量最高。
