紫色红曲霉MD10产蛋白酶条件优化及其部分酶学性质
2021-11-15戴纯纯陈晓明
戴纯纯,陈晓明
(淮阴工学院生命科学与食品工程学院,江苏淮安 223300)
蛋白酶是一类能有效催化蛋白质水解成蛋白胨、多肽和氨基酸的水解酶,已经被广泛应用于肉制品[1-2]、皮革[3]、水产品[4-5]、茶饮[6]等生产领域,其数量占全球酶制剂销售总量的60%左右[7]。蛋白酶既可以从动植物中获得,也可以从微生物中获得。宗红等人[8]通过硫酸铵盐析及凝胶层析法从米曲霉中分离纯化出蛋白酶,并对该米曲霉所产的蛋白酶的特性进行了探究,发现该蛋白酶对疏水性氨基酸表现出较强的选择性,这对于米曲霉在食品中的利用提供了一定的参考意义。王鑫等人[9]利用黑曲霉基因在毕赤酵母进行基因重组,并通过优化培养获得高活性的蛋白酶,提高了黑曲霉蛋白酶的pH值及热稳定性,为蛋白酶制剂工业提供了新的研究思路。郑丽等人[10]通过芽孢杆菌在豆粕中发酵获得蛋白酶,并根据发酵条件进行优化,获得蛋白酶产量达到约520 U/g。红曲霉是人类传统使用的有益菌,不仅可以产天然色素,还具备较强的产酶能力,但研究多为糖化酶[11-13]和酯化酶[14-16],对其产蛋白酶方面的研究甚少。实验室从商品红曲米中分离出高糖化酶活力的紫色红曲霉MD10,为了挖掘其应用潜力,对其产蛋白酶的发酵条件进行优化,并探究其部分酶学性质。
1 材料与方法
1.1 材料
1.1.1 菌种紫色红曲霉MD10,实验室菌保藏。
1.1.2 原料
麸皮,购于当地农产品市场。
1.1.3 试剂与仪器
试剂:乳酸、乳酸钠、磷酸二氢钠、磷酸氢二钠、硼砂、氢氧化钠、三氯乙酸、碳酸钠、酪氨酸、酪蛋白、氯化钠、氯化钾、六水合硫酸亚铁铵、六水合氯化铁、无水硫酸镁、无水硫酸铜、一水合硫酸锰、七水合硫酸锌,均为分析纯,国药集团化学试剂有限公司提供。
仪器:UV2550型紫外分光光度计,上海旦鼎国贸有限公司产品;GHP-9160型隔水式恒温培养箱,上海一恒科学仪器有限公司产品;KG-SX-500型高压蒸汽灭菌器,KAGOSHIMA SEISAKUSYO(Japan)公司产品;HHS-8S型电子恒温不锈钢水浴锅,上海康路仪器设备有限公司产品;SPH-2102型立式大容量恒温培养摇床,上海世平实验设备有限公司产品。
1.2 培养基
(1)平板培养基。改良的马铃薯葡萄糖琼脂培养基(PDA),取46 g于1 000 mL蒸馏水溶解混匀,加入乳酸1 mL。
(2)种子液培养基。葡萄糖60 g/L,蛋白胨30 g/L,硫酸镁1.5 g/L,硝酸钠2 g/L,磷酸二氢钾2 g/L,pH值自然。
(3)初始固态发酵培养基。麸皮30 g,水30 mL,乳酸0.06 mL,置于500 mL锥形瓶中混合均匀。
以上培养基于121℃下灭菌30 min。
1.3 试验方法
1.3.1 菌株活化与培养
(1)种子液培养。刮取试管斜面中的红曲霉菌株MD10于已灭菌的种子液中,置于摇床中,30℃下,以转速150 r/min培养2 d至菌丝干重7 g/L。
(2)固态发酵基培养。以麸皮固态培养基质量为基准,吸取一定量的种子液于麸皮固态培养基上,30℃下培养5 d。
1.3.2 蛋白酶活力的测定
参考QB/T 4257—2011《酿酒大曲通用分析方法》中的蛋白酶活力的测定方法[17]。
蛋白酶活力:以1.0 g固体干曲在40℃和pH值3.0条件下,1 min内将酪蛋白水解产生1μg氨基酸为1个酶活单位,以U/g表示。
1.3.3 固态发酵参数条件的优化
选择发酵温度、乳酸添加量和接种量进行三因素三水平的正交试验,培养5 d后检测样品的蛋白酶活力,确定该菌株产蛋白酶的最佳参数。
固态发酵参数优化的正交设计见表1。

表1 固态发酵参数优化的正交设计
1.3.4 部分酶学性质的探究
(1)粗酶液制备。称取10 g干曲,加入pH值3.0的乳酸-乳酸钠缓冲液200 mL,于4℃下搅拌浸提30 min,过滤后即为粗酶液。
(2)最适温度。取1 mL酶液(pH值3.0)分别置于25,35,45,55,65,75,85℃条件下与1 mL质量浓度为10 g/L的酪蛋白反应30 min,酶活最高值对应的温度为最适温度,以其为100%计,计算其他各温度下的相对酶活。
(3)热稳定性。分别将酶液置于35~75℃的不同温度下保温,分别在保温的不同时间(30,60,90,120 min)取出酶液,冰浴冷却,测定其蛋白酶活力,以4℃下放置的同批粗酶液的酶活为对照,计算不同温度和时间下的相对酶活。
(4)最适pH值。用乳酸-乳酸钠配制pH值为2.5,3.5,4.5,5.5的缓冲液;磷酸二氢钠-磷酸氢二钠配制pH值为6.5,7.5,8.5缓冲液;硼砂-氢氧化钠配制pH值为9.5,10.5,11.5的缓冲液,分别用不同pH值缓冲液配制质量浓度为10 g/L的酪蛋白溶液。取1 mL粗酶液与1 mL不同pH值配制的底物反应,测定其蛋白酶活力,以最高值对应的pH值为最适pH值,以最高酶活为100%,计算其他各pH值下酶液的相对酶活。
(5)pH值稳定性。用不同pH值(3.5~7.5)的缓冲液稀释等量酶液为不同pH值的酶液,置于55℃下保温,分别在保温30,60,90,120 min的时间取出酶液,冰浴冷却,测定蛋白酶活力,于4℃下放置的同批酶的活性为100%,计算不同时间保温后的酶的相对活性,用相对酶活评价pH值对酶稳定性的影响。
(6)金属离子对酶活的影响。在测定蛋白酶活力的体系中,分别加入终浓度为3 mmol/L的金属离子(Na+,K+,Fe2+,Fe3+,Mg2+,Cu2+,Mn2+,Zn2+)的盐溶液,以没有加金属离子的酶活为100%计,计算各金属离子存在时酶的相对活性[18]。
2 结果与分析
2.1 固态发酵条件的优化
L9(34)正交试验结果见表2。
由表2可知,极差RA>RC>RB,说明发酵温度(A)对紫色红曲霉MD10产蛋白酶的影响最大,其次是接种量(C)和乳酸添加量(B)。
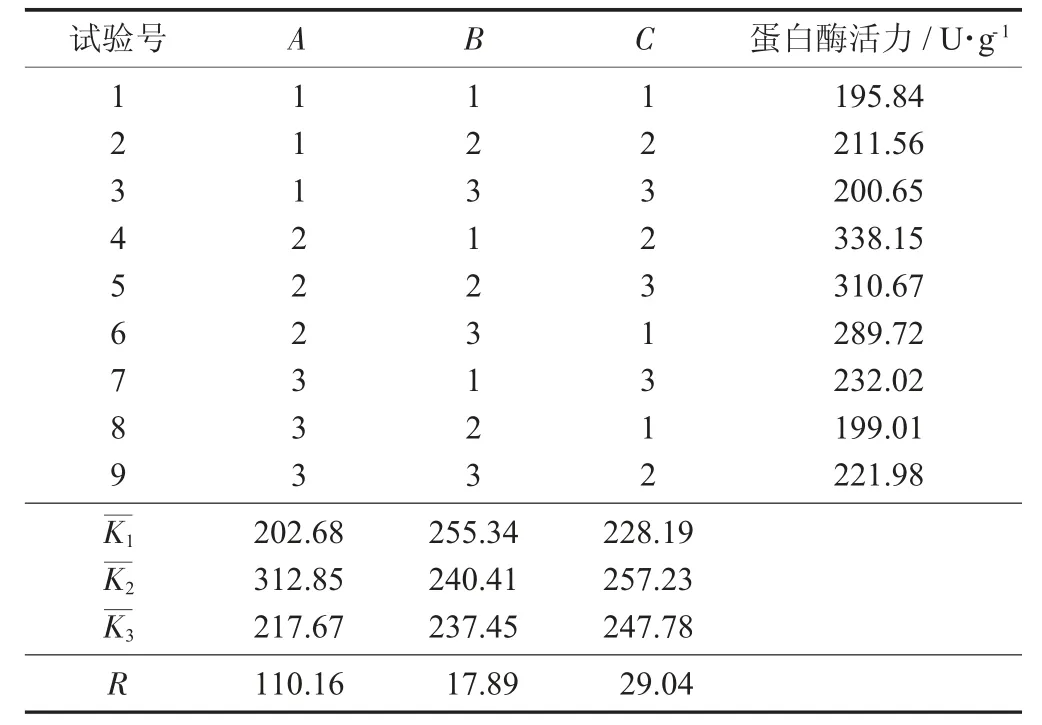
表2 L9(34)正交试验结果
29℃的发酵物状态见图1,32℃的发酵物状态见图2,35℃的发酵物状态见图3。

图1 29℃的发酵物状态

图2 32℃的发酵物状态

图3 35℃的发酵物状态
2.2 酶学性质的分析
2.2.1 最适温度温度对MD10蛋白酶活性的影响见图4。
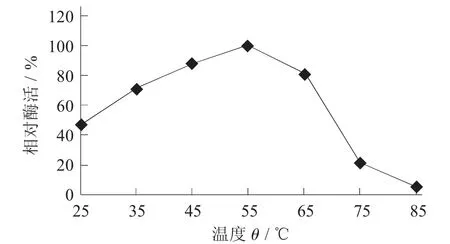
图4 温度对MD10蛋白酶活性的影响
由图4可见,该蛋白酶的最适反应温度为55℃。在25~55℃内酶活力随着温度的升高而逐渐升高,由50%上升到100%;当温度从65℃上升至75℃时,相对酶活从81%快速降低为22%,说明温度对该酶的影响较大,85℃时,仅为5%,基本失活。
2.2.2 热稳定性
MD10蛋白酶的热稳定性见图5。
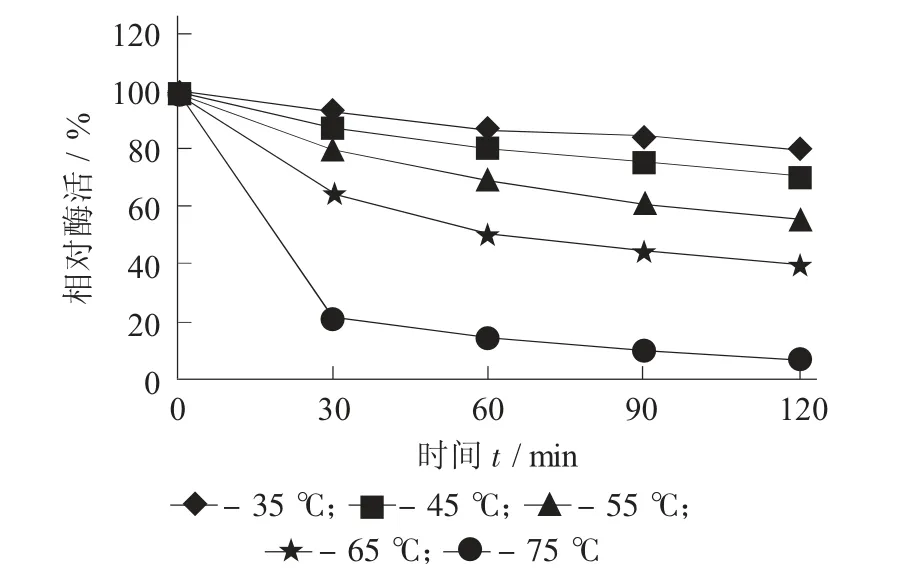
图5 MD10蛋白酶的热稳定性
由图5可见,在分别保温了30,60,90,120 min后,各个温度的酶活均有下降。当温度在35,45℃时,该蛋白酶稳定性较好,保温120 min后,酶活分别为80%,70%以上;55~75℃下该蛋白酶不稳定,伴随时间的增加,酶活持续降低;75℃保温120 min后酶活约为7.1%,表明该蛋白酶不适合高温条件的应用场合。
2.2.3 最适pH值
pH值对MD10蛋白酶活性的影响见图6。
pH值对微生物的生长影响显著,不同的红曲霉所产生的蛋白酶的特性均有所差异。由图6可知,MD10蛋白酶的最适pH值为4.5。在pH值3.5~6.5内,酶活保持在80%以上;当pH值低于3.5后,酶活急速下降;pH值大于7.5后,酶活下降加快,在pH值9.5~11.5内,保持10%左右的活性。结果可推测,MD10蛋白酶主要是酸性蛋白酶。Masaaki Y等人[20]进行了红曲霉3403菌株酸性蛋白酶的纯化并对其性质做了探究,其蛋白酶的最适pH值为3.0。
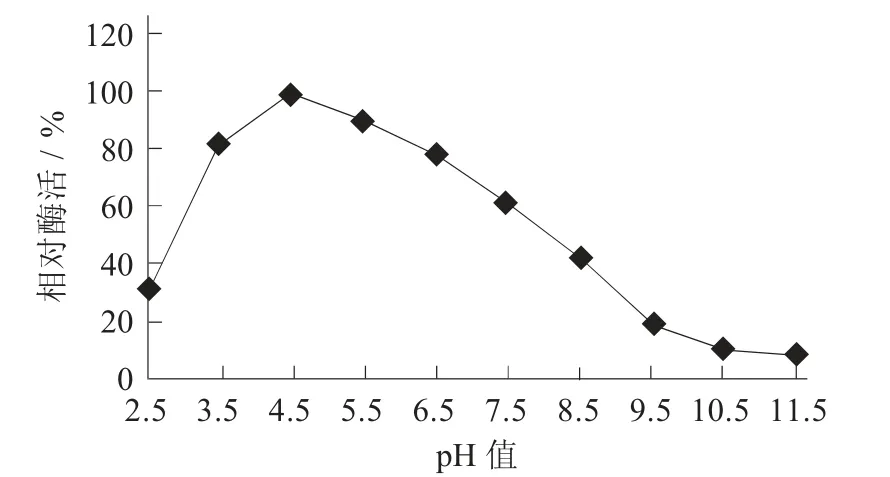
图6 p H值对MD10蛋白酶活性的影响
2.2.4 pH值稳定性
MD10蛋白酶的pH值稳定性见图7。
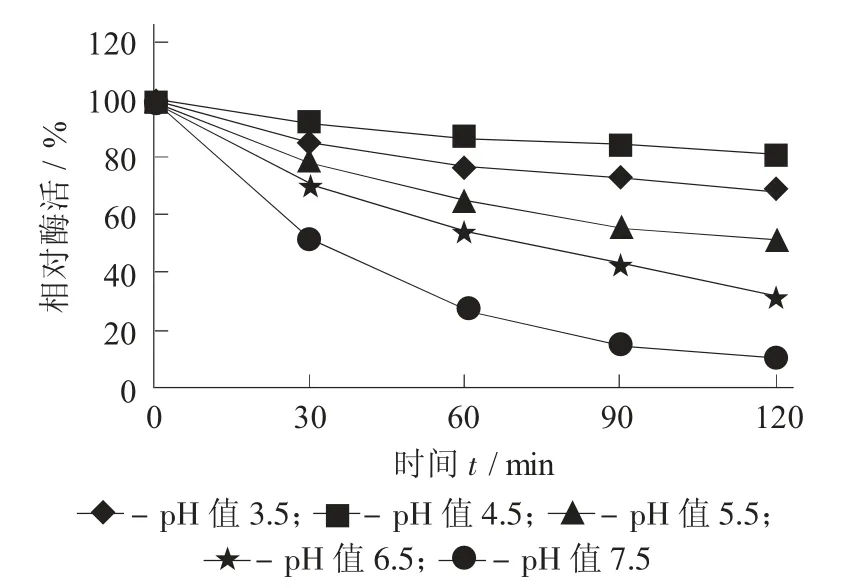
图7 MD10蛋白酶的p H值稳定性
由图7可知,在保温30,60,90,120 min后,pH值3.5、pH值4.5 2个条件下,酶活较稳定,保温120 min后能保持70%左右的活性;pH值5.5时,酶活稳定性减弱,保温120 min后,酶活为51%;当pH值6.5、pH值7.5时,随保温时间的延长,酶活持续降低,保温120 min后,相对酶活分别为32%和11%。
2.2.5 金属离子对酶活的影响
金属离子对酶活的影响见图8。
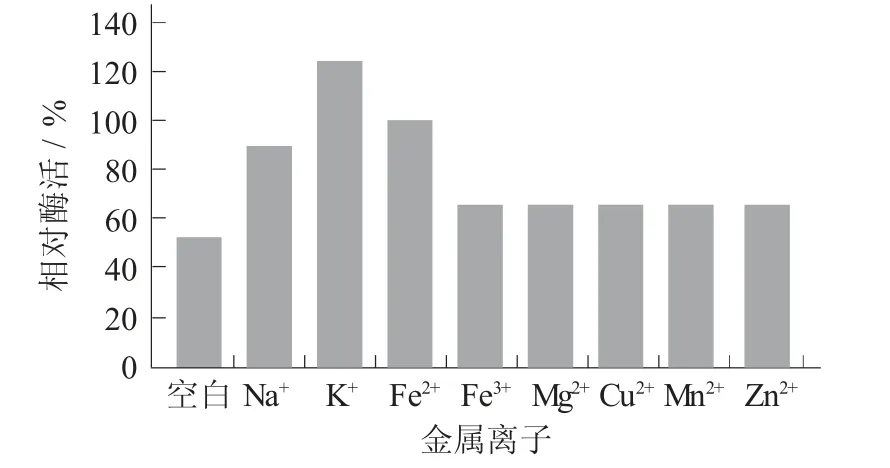
图8 金属离子对酶活的影响
由图8可看出,Na+,K+,Fe2+,Fe3+,Mg2+及Zn2+对该蛋白酶酶活有一定的抑制作用,其中Zn2+,Mg2+抑制作用最强;Cu2+,Mn2+对其有促进作用,且Mn2+比Cu2+的促进效果明显。
3 结论
对紫色红曲霉MD10产蛋白酶的发酵条件进行了优化,并且对其部分酶学性质进行了测定,得到最佳发酵条件为温度32℃,乳酸添加量1‰,种子液接种量9%,在此条件下,其蛋白酶产量达到338.15 U/g,是优化前的2.3倍。其酶学测定结果表明,最适温度为55℃,最适pH值为4.5,酶在35~45℃保持较好的稳定性;pH值3.5~5.5内保温120 min后,酶活能保持在68%以上;Na+,K+,Fe2+,Fe3+,Mg2+及Zn2+对酶活有一定的抑制作用,其中Zn2+,Mg2+抑制作用最强;Cu2+,Mn2+对其有促进作用。该研究结果为紫色红曲霉MD10在酿酒行业及酶制剂行业的应用提供一定的科学数据。
