OCTA观察增生性糖尿病视网膜病变治疗前后不同形态视盘新生血管的变化
2021-11-15王光鑫刘伦高健廖荣丰
王光鑫 刘伦 高健 廖荣丰
增生性糖尿病视网膜病变(proliferative diabetic retinopathy, PDR)的特征是视盘或视网膜新生血管增生。大部分增生的新生血管管壁由单层细胞组成,脆弱且易破裂,可引起玻璃体出血或牵拉性视网膜脱离,从而导致糖尿病患者视力丧失[1]。根据新生血管形成的位置,将其分为视盘新生血管(neovascularization in the optic disc,NVD)或其他地方的新生血管(neovascularization elsewhere, NVE)。
荧光素眼底血管造影(fundus fluorescein agiography, FFA)可用于检测新生血管和评估新生血管活动性。但由于FFA为侵入性检查,存在过敏反应等潜在危险因素,临床实践中不宜将其作为常规检查来监测糖尿病患者的眼底新生血管[2]。相干光层析血管成像术(optical coherence tomography angiography, OCTA)是一种安全、快速、无创的视网膜和脉络膜微血管可视化技术,分辨率超过FFA[3-6],可清晰显示视网膜新生血管形态,包括视盘上的纤维增殖膜中大量新生血管结构[7,8]。Akihiro等[7]的研究中描述了两种不同形态的新生血管:(1)有旺盛的血管增生(exuberant vascular proliferations, EVP)的NVD定义为周边存在不规则增殖的细小血管网的新生血管;(2)无EVP的NVD定义为较粗大的新生血管环。但是,NVD的形态学特征及其对治疗的应答反应之间的相关性仍未明确,有待进一步研究。
血管内皮生长因子(vascular endothelial growth factor, VEGF)是参与糖尿病视网膜病变(diabetic retinopathy, DR)患者眼底新生血管形成的关键[9-11]。近年来,雷珠单抗和贝伐单抗两种抗VEGF单克隆抗体在PDR治疗中均取得了较好的疗效,关于抗VEGF融合蛋白康柏西普的研究已有报道[9, 11-13]。因此,本研究旨在应用OCTA技术对经眼内注射康柏西普治疗及全视网膜光凝后的PDR患者的NVD详细形态进行观察和研究,并分析不同形态学特征的NVD治疗前后的改变,评估其对治疗的应答反应。
资料与方法
一、病例资料
回顾性病例研究。本研究纳入了就诊于安徽医科大学第一附属医院眼科的发现NVD的PDR患者16例(19只眼),本研究遵循《赫尔辛基宣言》要求,经患者及家属知情同意,并通过安徽医科大学第一附属医院伦理委员会审查批准。
二、纳入标准和排除标准
纳入标准:(1)屈光介质透明;(2)明确诊断糖尿病;(3)经过OCTA检查,明确存在NVD,且未经任何治疗;排除标准:(1)眼部手术及外伤史;(2)患有其他影响眼底血管的全身疾病如高血压、免疫系统性疾病等;(3)患有其他可能影响眼底的眼部疾病如老年性黄斑变性,视网膜静脉阻塞以及青光眼等;(4)严重的屈光介质混浊,如角膜白斑、白内障以及玻璃体积血等;(5)认知能力差,不能配合检查及治疗者;(6)扫描质量指数(scan quality index, SQI)<6。
三、方法
所有患眼均接受0.5 mg康柏西普玻璃体腔内注射治疗,抗VEGF药物治疗两周后行全视网膜光凝(panretinal photocoagulation,PRP),并在4周内完成。治疗前和注射抗VEGF药物两周及激光完成后1个月行眼科检查,包括裂隙灯检查、眼内压、眼底镜检查、眼底照相、OCTA检查以及必要时行FFA检查,对治疗前和激光完成后1个月的数据进行分析。OCTA使用美国Optovue仪器,采用Angio Disc模式扫描以视盘为中心,范围4.5 mm×4.5 mm大小的区域(图1A)。由同一位经验丰富的眼科医师重复扫描,SQI≥6时使用图像,采集NVD图像并使用ImageJ软件对其进行分析。NVD图像通过B-scan扫描采集,并通过具有血流型号的膜结构确认其存在。OCTA图像可显示突入玻璃体腔(图1B和1C)或视网膜表面增殖(图1D和1E)的新生血管。突入玻璃体腔的NVD常常会在自动分割内界膜时引起误差,因此,定位病灶后需手动调节校准以识别内界膜边界的精确位置,直至NVD完整显示。使用ImageJ软件绘制NVD的形态轮廓,计算治疗前后的NVD的面积和累积光密度(IntDen)值,并比较其差异。
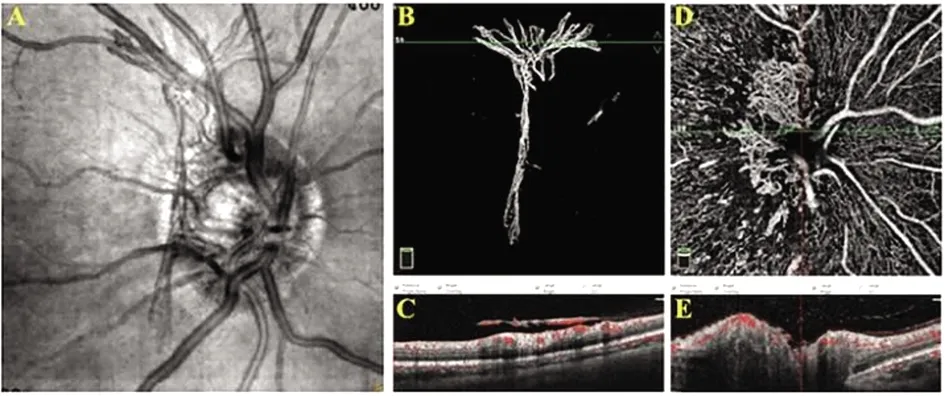
图1 OCTA扫描以视盘为中心,范围4.5mm×4.5mm大小的区域(A);B391-395scan扫描采集NVD图像,可显示突入玻璃体腔(B和C)或视网膜前增殖(D和E)的新生血管
四、统计学分析方法
采用Sharpiro-Wilk检验对数据进行正态检验,计量资料不符合正态分布的以中位数和四分位间距表示。通过Wilcoxon秩和检验比较计量资料间的差异。所有统计分析均使用SPSS 21.0进行,当P<0.05时,差异视为有意义。
结 果
一、NVD的基线特征
符合纳入标准的16例(19只眼)患者,其中男性11例,女性5例,年龄在31~55岁,病程在1~20年。在13只眼的眼底彩照中观察到NVD或位于视盘表面,或突入玻璃体腔(图2A),OCTA图像清晰的显示了所有眼中NVD的形态学结构(图2C)。FFA提示造影早期视盘内快速进行性活动性荧光素渗漏,后期视盘内弥漫性荧光素渗漏,但是FFA未能显示出NVD的形态和轮廓(图2E和2F)。在其余6只眼中,眼底彩照未观察到明显视盘异常(图2B),但OCTA图像发现并清晰的显示出NVD形态结构和轮廓(图2D)。FFA提示造影早期荧光素渗漏,以及后期的弥漫性渗漏。同样,FFA无论早期还是后期都未能显示出NVD的形态结构和轮廓(图2G和2H)。3只眼中,NVD面积小于1/4视盘面积(图3A),其余16只眼NVD面积大于1/4视盘面积(图3B)。
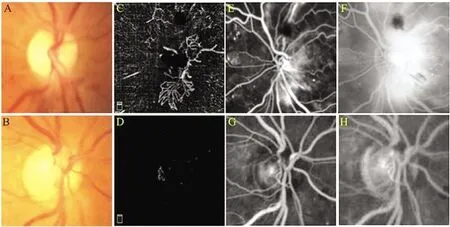
图2 眼底彩照观察到NVD(A),眼底彩照未观察到NVD(B),OCTA图像清晰显示NVD的形态轮廓(C和D),FFA提示NVD造影早期、后期均存在荧光素渗漏,但未能显示出NVD的形态及轮廓(E、F、G和H)
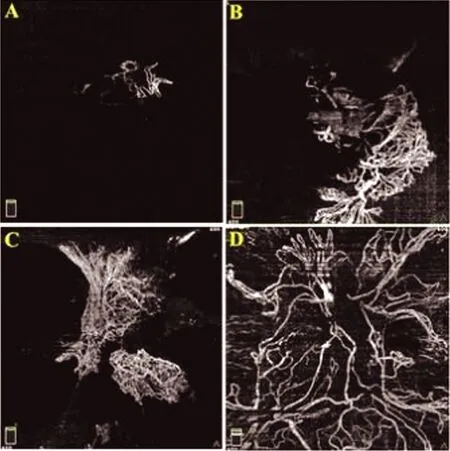
图3 小于1/4视盘面积的NVD(A),大于1/4视盘面积的NVD(B),OCTA图像中表现为EVP的NVD周围存在大量不规则细小新生血管网增殖(C),无EVP的NVD表现为修剪的粗大丝状新生血管环(D)

表1 两组患者一般资料的比较
通过OCTA图像,区分出两种形态学特征的新生血管,17只眼NVD表现出周边有不规则增殖的新生血管网,有EVP(图3C),2只眼NVD表现出修剪的较粗大的丝状新生血管环,无EVP(图3D)。有无EVP的NVD的一般资料比较见表1。

图4 在OCTA图像上显示EVP的NVD(A)在治疗后显著减少(B)。与基线(C)相比,NVD血流信号明显减少(D)。治疗后FFA显示,在早期(E)和晚期(F)仅有微弱的荧光素渗漏
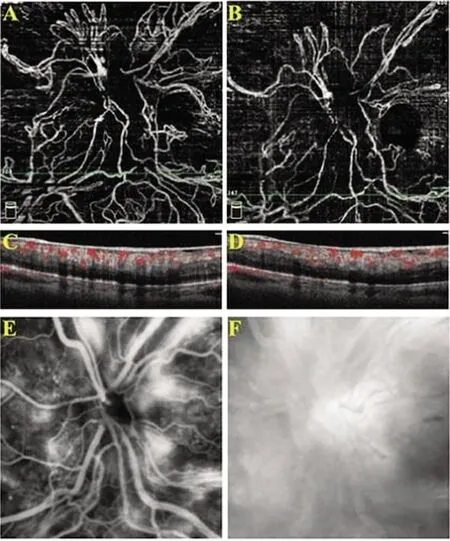
图5 OCTA图像显示无EVP的NVD(A)治疗后无明显消退(B)。与基线(C)比较,血流信号无明显减少(D)。治疗后FFA仍提示明显荧光素渗漏(E和F)
二、治疗后NVD的变化
经治疗后测得的NVD的变化的定量分析见表2。治疗前NVD的面积为65 253(5 834,112 827),IntDen值为5 285 103(609 128,10 037 989)。治疗后测得的NVD面积减小至4 943(784,34 617),IntDen值减小至435 084(54 953,2 692 039),差异均有显著的统计学意义(均P<0.001)。见表2,同时,我们观察到,OCTA图像提示有EVP的NVD的17只眼中,经康柏西普玻璃体腔注射及视网膜光凝治疗后NVD均显著消退(图4A,B),新生血管不规则的复杂网状结构消失,残存数个较大的血管环。B-scan提示NVD的血流信号减少(图4C,D)。治疗后FFA提示在造影早期和晚期仅存有微弱的荧光素渗漏(图4E,F)。2只无EVP的NVD眼则未观察到视盘新生血管在治疗后有明显消退(图5A,B)。B-scan提示治疗后血流信号无明显改变(图5C,D)。治疗后FFA提示,丝状新生血管末端仍存明显荧光素渗漏(图5E,F)。且这两只眼后期在随访中病情持续进展,最后行玻璃体切除术。

表2 治疗前后PDR患者NVD的面积和IntDen值的比较
讨 论
视网膜新生血管作为PDR的重要标志,其易破裂出血的特性导致PDR患者疾病后期常出现玻璃体出血和牵拉性视网膜脱离,是DR患者视力丧失的主要原因。OCTA是基于相干光层成像技术(optical coherence tomography,OCT)新进发展的无创血管造影术,通过对同一位置执行重复扫描,利用血管内红细胞等运动粒子引起的OCT信号变化作为成像机制,区分运动粒子与静态组织,从而达到视网膜脉络膜微血管可视化[5]。本研究发现,在6只眼底彩照未观察到视盘区有明显异常的患眼中,OCTA可准确识别NVD,并清晰显示其形态和轮廓。本研究和先前的研究均证实,OCTA能够清晰的显示出视网膜新生血管的形态轮廓,并可将其与正常血管区分开[14,15]。由于部分PDR患者常合并肾功能损害,FFA由于其侵入性,此时便不能用作这些PDR患者的常规检查[16]。因此,OCTA可作为PDR患者早期无创筛查NVD的有效方法。
本研究中,16例(19只眼)PDR接受了康柏西普玻璃体腔注射及全视网膜光凝。治疗后的NVD的面积和IntDen值相较于治疗前均显著减小,具有统计学意义(P<0.001)。多项证据表明,DR患者的眼内VEGF水平明显高于正常眼,VEGF及其调控的血管生成参与了PDR的发生和发展。抑制VEGF的产生,阻断病理性新生血管的形成是挽救视网膜新生血管疾病患者视功能的关键[17]。近年来,不同类型的抗VEGF靶向药物已大量应用于临床,雷珠单抗和贝伐单抗的作用已得到广泛证实[18]。我们的研究表明,玻璃体腔注射康柏西普联合视网膜光凝治疗同样可有效迅速消退NVD。
另外,我们观察了NVD的形态学特征对治疗的应答反应。结果表明康柏西普眼内注射及全视网膜光凝可显著使有EVP的NVD削减消退,并在接下来的随访期间保持稳定。有学者经研究发现活动期PDR患者的眼内VEGF水平显著高于静止期PDR患者,并且经贝伐单抗治疗后眼内VEGF水平显著降低[11, 19, 20]。在OCTA图像中,有EVP的NVD表现为周围存在大量不规则的细小血管网,这可能说明EVP提示了NVD的活动性增殖。FFA显示的渗漏程度也有力支持了这一结论。Akihiro[7]认为VEGF在EVP的形成中扮演重要角色,Spaide等[21]使用OCTA观察了定期抗VEGF治疗期间脉络膜新生血管网形态学改变也指出:高浓度的VEGF导致了新生血管的旺盛增殖。抗VEGF治疗后,玻璃体腔内游离VEGF水平急剧下降,周细胞覆盖不足的新生血管退化。然而,周细胞覆盖充足的部分血管仍然存在,其直径和血流量增加。VEGF水平升高以及反复的抑制治疗可能导致粗大的血管环形成。我们假设这种过程同样发生在PDR患者的NVD中。这可解释在接受抗VEGF治疗后,眼内VEGF水平下降,表现为EVP的NVD对治疗有较为良好的应答反应,修剪成为相对静止的较大的血管吻合。
相反,我们观察到基线是无EVP的NVD对治疗无明显应答反应,NVD血流信号并无明显减退。我们的研究结果提示,无EVP的NVD可能已进入纤维增生期,在FFA中,也表现出较有EVP的NVD更为轻微的渗漏。以往研究表明,不成熟的新生血管较成熟新生血管渗漏更快更显著[22],说明这种无EVP的粗大新生血管环可能处于较为成熟的状态。此时治疗对其无明显改善作用。因此,安全无创的OCTA检查可有效监测PDR患者治疗过程中NVD的变化。使用OCTA技术对NVD进行形态学评估可能有助于预测治疗的有效性,对DR患者的治疗提供有价值的信息。
本研究存在一些不足之处。首先,本研究纳入的样本量较小,仍需要加大样本量行进一步研究,从而可通过统计学比较抗VEGF治疗对不同形态学特征的NVD有效性的差异。其次,由于本研究纳入的部分患者合并有肾功能损害从而未能进行FFA检查。最后,受技术局限,目前OCTA仅能检测到视盘周围4.5 mm×4.5 mm范围的区域,更大范围的检测有待未来OCTA技术的进一步发展来实现。
综上所述,OCTA有助于我们观察评估NVD的详细结构以及形态学特征。被观察到伴随EVP的NVD可能是对治疗敏感的信号,但仍需要大样本量和长期随访研究来进一步验证此发现。OCTA在指导PDR患者的随访和对NVD的评估和治疗方面显现出良好的临床应用价值。
