水热法合成二氧化锰及其对染料的脱色性能研究
2021-11-14朱丹琛李名洁陈彰旭
朱丹琛,李名洁,陈彰旭,林 倩
(1.莆田学院环境与生物工程学院,福建莆田351100;2.福建省新型污染物生态毒理效应与控制重点实验室)
亚甲基蓝(MB)和罗丹明B(RhB)是一种常用的工业染料,广泛应用于纺织、造纸、塑料和涂料等行业[1]。但工业排放染色废水由于其具有毒性高和化学需氧量高等危害,会引起水体生态平衡等问题[2]。因此,众多研究报道了从废水中去除染料的技术,如催化降解[3-4]、吸附[5-6]和膜分离[7]等。在实际应用中通常采用两种或多种方法实现对废水的脱色处理。
二氧化锰是一种天然矿物,具有特殊的隧道结构,导致其晶型和形貌多样,对亚甲基蓝、刚果红等染料有吸附、降解性能[1,8-12]。通常合成的二氧化锰只对一种染料有较高的去除率。本课题组前期以硫酸锰和过硫酸铵为原料合成多种晶型的二氧化锰,并研究水热温度对微观结构和吸附量的影响[13]。本实验在此基础上加入十二烷基苯磺酸钠稳定其晶型,合成γ-MnO2和β-MnO2,探究其对MB和RhB两种染料的脱色性能,研究影响其脱色的因素、热力学模型以及循环使用性能,为扩展MnO2在染料吸附中的应用提供参考。
1 实验部分
1.1 试剂与仪器
试剂:一水硫酸锰、过硫酸铵、氯化钾、无水乙醇、十二烷基苯磺酸钠、罗丹明B和氢氧化钠,均为分析纯,盐酸(质量分数为36.0%~38.0%);亚甲基蓝由湘中地质实验研究所提供。
仪 器:XRD-6100型X射 线 衍 射 仪(XRD);S4800型扫描电子显微镜(SEM);UV2550型紫外/可见分光光度计(UV);ASAP2460型比表面积及微孔物理吸附仪;DGH-9146A型恒温干燥箱;SCS-24型恒温培养摇床。
1.2 MnO2吸附剂的合成方法
分别称取5.71 g过硫酸铵、4.23 g一水硫酸锰(最终浓度均为0.33 mol/L)和0.5 g十二烷基苯磺酸钠溶于75 mL的去离子水中,完全溶解后将溶液移入100 mL高压反应釜中,分别于80~150℃反应12 h。用去离子水将样品洗涤至滤液电导率低于水的电导率,样品在100℃干燥10 h,得到黑色粉末状样品。
1.3 MnO2对染料的脱色性能测试
在0.1g样品中加入50 mg/L的MB或RhB溶液50 mL。在35℃、150 r/min的摇床中振荡24 h。离心后取上清液,用紫外/可见分光光度计测定溶液的吸光度,并由公式(1)和(2)计算染料的脱色率和吸附量:

式中:A0为脱色前溶液的最大吸收峰对应波长处的吸光度(MB的λmax=665nm;RhB的λmax=554nm);A1为脱色后溶液在波长为400~700 nm内的最大吸光度[14]。Qe为吸附量,mg/g;ρ0为初始质量浓度,mg/L;ρe为吸附后的质量浓度,mg/L;V为体积,L;m为吸附剂的质量,g。
2 结果与讨论
2.1 样品的结构分析
2.1.1 XRD分析
图1 为样品XRD谱图。由图1看出,当水热反应温度为80~110℃时,样品均在2θ为22.4、37.1、42.6、56.1°处对应γ-MnO2(120)(131)(300)(160)的晶面(PDF 14-0644)[15-16]。当水热反应温度为130~150℃时,在2θ为28.7、37.3、56.6°等处出现β-MnO2的衍射峰,分别对应(110)(101)(211)晶面(PDF 24-0735)[17]。水热反应温度为120℃时,既出现γ-MnO2也出现β-MnO2的衍射峰。这可能是由于水热温度升高,产物从较不稳定的γ-相向热力学稳定的β-相[18]转化。

图1 不同水热温度合成样品的XRD谱图Fig.1 XRD patterns of samples prepared at different hydrothermal temperature
2.1.2 SEM分析
图2 为样品的SEM图。由图2可以看出,水热温度为80~110℃时,样品形貌均为毛刺微球、表面疏松、比表面积大(图2a~2d)。其中,水热温度为110℃时的样品,球状较为均匀、表面最疏松,是由1 μm长条构成的直径为2~8 μm的球状物(图2d)。而当水热温度为120℃时,虽然主要呈现1~6 μm球状,但是已经从毛刺球状转变成棒状堆积团簇的球(图2e)。水热温度高于120℃时,主要呈现出微米长棒状,其球状逐渐坍塌,部分出现由长棒状无序堆积团簇而成的类球状的形貌(图2f~2h)。

图2 不同水热温度合成样品的扫描电镜图Fig.2 SEM images of samples prepared at different hydrothermal temperature
2.1.3 比表面积和孔径分析
不同水热温度样品N2吸附-脱附等温曲线见图3,水热温度对样品比表面积的影响见图4。由图3、图4可知,水热温度为80~150℃时样品的氮气吸附-脱附等温线都属于Ⅱ型等温线,在高相对压力(p/p0)处未出现极限吸附值,表现出无限制的单层-多层吸附特征。其中,80~120℃的样品吸脱附曲线还出现H3型回滞环,表明材料中具有平板状颗粒堆积形成的斜孔[19-20],其比表面积较大,是一种良好的吸附材料。其中水热温度为110℃的样品比表面积最大为43.87 m2/g。而水热温度高于120℃的样品比表面积急剧减小,水热温度为150℃的样品比表面积最小的仅为12.28 m2/g。
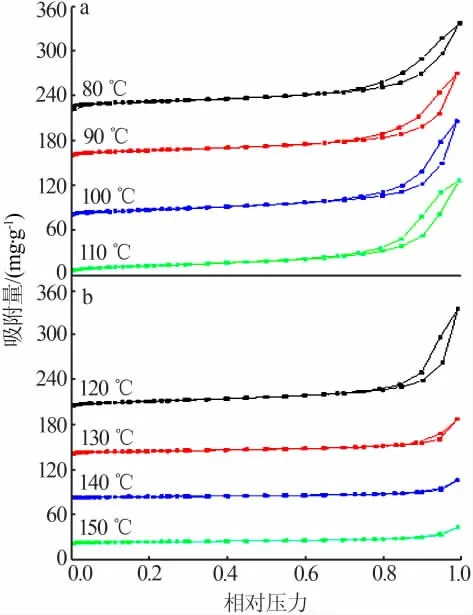
图3 不同水热温度样品的N2吸附-脱附等温曲线Fig.3 N2 adsorption-desorption isotherm curves of samples prepared at different hydrothermal temperature
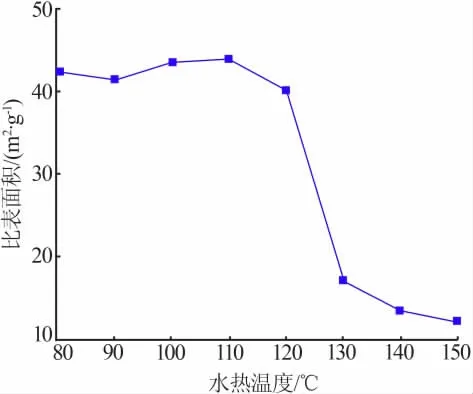
图4 水热温度对样品比表面积的影响Fig.4 Effect of hydrothermal temperature on specific surface area of samples
2.2 样品对染料的脱色性能
2.2.1 水热温度的影响
为考察不同水热温度所得的二氧化锰样品对不同有机染料的脱色率的影响,在50 mL、50 mg/L的MB或RhB溶液中添加0.1 g不同水热温度所得的二氧化锰样品,于35℃振荡24 h,测试分析结果如图5所示。由图5可知,随着水热反应温度的升高,二氧化锰吸附MB和RhB的脱色率总体呈先上升再下降的趋势,在110℃时脱色率达到最大值59.54%和63.93%,分别在140℃和150℃时脱色率最低,仅为15.26%和6.94%。

图5 水热温度对样品染料脱色性能的影响Fig.5 Effect of hydrothermal temperature on dyes decolorization performance of sample
结合图1~4可知,水热温度为80~120℃合成的为毛刺球状γ-MnO2,其对染料的脱色率高,可能是由于吸附MB和RhB后溶液的最高峰分别蓝移到600 nm和533 nm,即吸附过程伴随中间体的生成[1,21]。其中水热温度为110℃时样品形貌呈现均匀毛刺球状,其比表面积大,可能是其脱色率最佳的原因。而水热温度为130~150℃时样品为团聚严重的针状,同时晶型转化为β-MnO2,吸附过程最高峰位置不变,不产生中间产物而是通过吸附去除,且其比表面积小,这可能是其脱色率急剧降低的原因。
2.2.2 二氧化锰投加量的影响
为考察MnO2投加量对染料脱色率的影响,改变脱色率最佳样品(水热温度为110℃)的投加量,分别测试其在35℃振荡24 h条件下对50 mL、50 mg/L的MB或RhB溶液的脱色率,结果见图6。由图6可以看出,随着吸附剂投加量的增加,样品对MB和RhB的脱色率呈现上升的趋势。在投加量为6 g/L时,MB和RhB的脱色率分别为86.95%和76.07%。可以通过增加MnO2的投加量提高MB的去除效果,但对RhB的去除效果的影响较小。
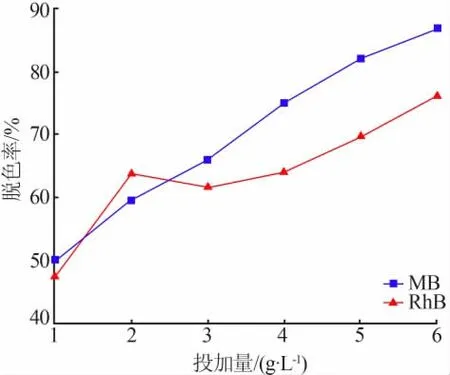
图6 MnO2投加量对染料脱色率的影响Fig.6 Effect of MnO2 dosage on decolorization rate of dye
2.2.3 pH对脱色率的影响
为考察染料溶液的pH对染料脱色率的影响,分别调节50 mL、50 mg/L的MB和RhB溶液的pH为1~11,加入0.1 g脱色率最佳的样品(水热温度为110℃),在35℃振荡24 h,测试分析结见图7。在强酸、强碱的条件下,MnO2对MB溶液的脱色率均有很大的提高,在pH=1时,染料的脱色率达到了76.10%;在pH=11时,染料的脱色率达到了81.73%。类似地,强酸条件中MnO2对RhB溶液的脱色率也有很大提高,在pH=1时染料脱色率高达96.07%,但随着pH增大,其脱色率逐渐减小,在pH=11时,染料的脱色率仅为8.58%。实验表明,MnO2对两种染料的脱色率随着pH变化也发生相应变化。
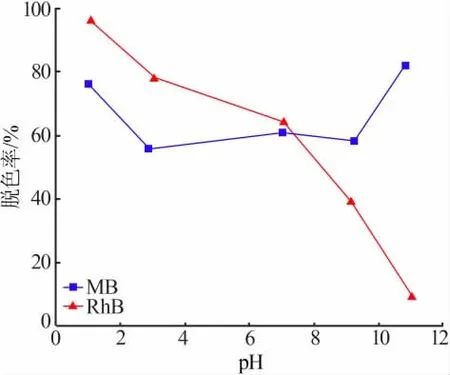
图7 溶液的pH对染料脱色率的影响Fig.7 Effect of solution pH on decolorization rate of dyes
众所周知,pH是影响染料去除能力的关键因素之一,染料溶液初始pH的减小会提升MnO2的潜在氧化能力,抵消因pH减小带来的其他负面影响,导致其脱色率明显提高[22]。相较于中性条件,强碱性对MB的脱色率明显提升,这可能是由于pH越大,MnO2表面去质子化程度越高,负电荷位点增加;在碱性环境下亚甲基蓝的正离子倾向明显,MnO2与MB离子之间发生静电吸引,从而使脱色率增加[23-24]。而碱性条件下其对RhB的脱色率却大大降低,这可能是由于在pH大于8时,RhB以两性离子的形式存在于溶液中,使得其与MnO2之间产生静电排斥;此外,在较大的pH时,还可能出现水溶液中羟基与两性离子RhB的竞争性吸附,静电排斥和竞争吸附可能是导致碱性条件下RhB脱色率急剧下的原因[25-27]。
2.3 吸附等温线
分 别 在 质 量 浓 度 为10、25、50、100、200、400、600 mg/L的MB溶液和质量浓度为10、30、50、70、90、100 mg/L的RhB溶液中加入0.1g MnO2(水热温度为110℃),分别在25、35、45℃下振荡24 h,测定样品对两种染料的吸附量。绘制的吸附等温线如图8所示,采用Langmuir和Freundlich等温方程对图6数据进行拟合,求得参数如表1、表2所示。
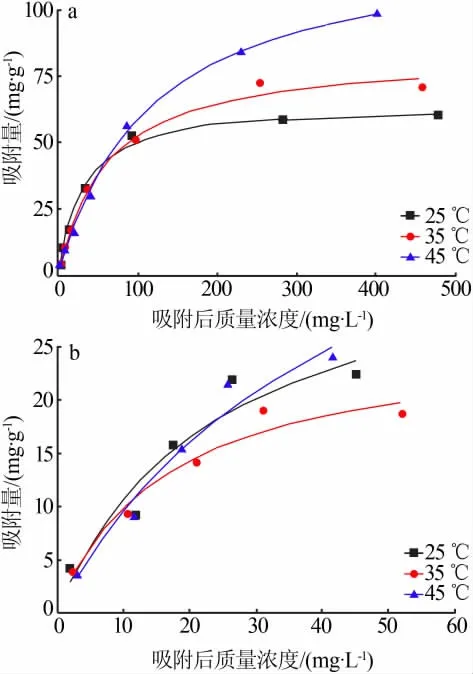
图8 吸附等温线Fig.8 Adsorption isotherm

表1 等温吸附模型拟合参数(MB)Table 1 Fitting parameters of the adsorption isotherm model(MB)
Langmuir等温方程表达式:

Freundlich等温方程表达式:

式中:ρe为吸附平衡时溶质的质量浓度,mg/L;Qe为吸附平衡时的吸附量,mg/g;Qm为样品的最大吸附量,mg/g;KL、KF为吸附能力常数;n为描述吸附强度的常数[23]。
由表1可知,MnO2对MB的Langmuir和Freundlich吸附方程的相关系数R2均高于0.9,Langmuir等温模型计算得到的Qm与实验值相近,说明两种等温模型均可以描述MnO2对MB溶液的吸附过程。在25℃和35℃时吸附过程更符合Langmuir等温模型,这表明吸附是单分子层吸附[23]。而在45℃时,吸附过程更符合Freundlich等温模型,这可能是由于温度的升高,导致分子运动剧烈,而更趋向于在吸附剂表面形成多层吸附[28]。由表2可知,MnO2对RhB的吸附更符合Freundlich等温模型,这说明MnO2对RhB的吸附趋向于多层吸附[26]。此外,表1、表2中3个温度下1/n均小于1,说明MnO2样品易于吸附MB和RhB[29]。
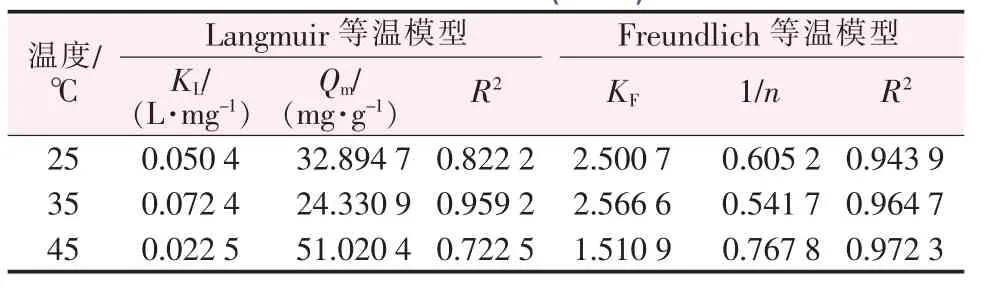
表2 等温吸附模型拟合参数(RhB)Table 2 Fitting parameters of the adsorption isotherm model(RhB)
2.4 循环性能测试
将吸附后的MnO2(110℃样品)加入饱和KCl溶液解吸1 d,KCl与染料形成竞争性吸附,破坏染料和MnO2间的静电作用,使染料易于解吸[23,27]。测定解吸后的MnO2对MB和RhB的吸附量,其循环使用的性能如表3所示。二氧化锰吸附解析3次后对MB吸附量仅下降1.08 mg/g;对RhB的吸附量下降2.66 mg/g,说明其循环使用性能较好。
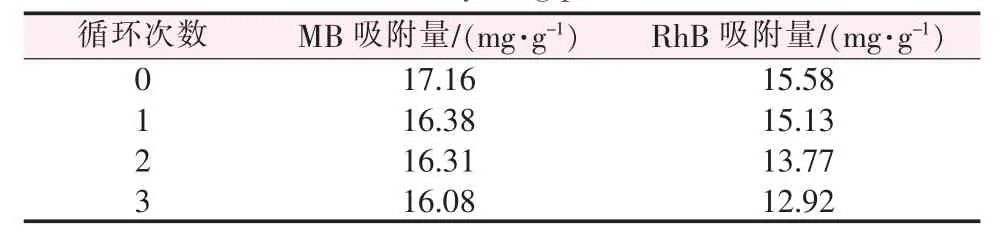
表3 循环使用性能Table 3 Recycling performance
MnO2(110℃样品)吸附染料前后XRD如图9所示。由图9可知,吸附后样品的主衍射峰没有发生变化,也没有出现新的衍射峰,说明染料吸附前后二氧化锰的晶型没有变化。吸附染料后的SEM图见图10。由图10可知,吸附MB和RhB后,其形貌仍为毛刺球形,其球的大小略有增大。图11为样品吸附前后的N2吸附-脱附等温线,吸附后曲线仍属于Ⅱ型等温线,且都出现H3型回滞环;吸附后的比表面积略有减小,分别为43.18 m2/g和42.55 m2/g。综上所述,吸附前后,样品的性能和结构并未发生显著的变化,说明样品是一种良好的可循环利用的吸附剂。

图9 吸附前后样品的XRD谱图Fig.9 XRD patterns of samples before and after adsorption

图10 吸附前后样品的扫描电镜图Fig 10 SEM images of samples before and after adsorption

图11 吸附前后样品的N2吸附-脱附等温曲线Fig 11 N2 adsorption-desorption isotherms of samples before and after adsorption
3 结论
1)采用水热法在110℃时制备比表面积为43.87 m2/g的2~8 μm球状γ-MnO2,其对MB和RhB的脱色率达到59.54%和63.93%。2)可以通过增加投加量和改变pH提高其染料脱色率。在投加量为6 g/L时,对50 mg/LMB和RhB的脱色率可达86.95%和76.07%。MB和RhB溶液的pH对脱色率有很大影响,MB在pH=11时脱色率最大,达到81.73%;RhB在pH=1时脱色率最大,达到96.07%。3)样品对MB吸附过程符合Langmuir等温模型和Freundlich等温模型;对RhB吸附过程符合Freundlich等温模型。样品循环使用后,其性能和结构并未发生显著变化。
