马氏珍珠贝软体酶法制备降糖肽的工艺优化及肽段分析
2021-11-14李佳芸王欣之韦源青卞慧敏
李佳芸,王欣之,韦源青,卞慧敏,刘 睿,3, ,吴 皓,
(1.江苏省海洋药用生物资源研究与开发重点实验室,江苏南京 210023;2.南京中医药大学药学院,江苏南京 210023;3.南京中医药大学,江苏省中药资源产业化过程协同创新中心,江苏南京 210023)
马氏珍珠贝(Pinctada martensiiDunker)是生产海水珍珠的主要贝类,其育珠产量占海水珍珠产量的85%以上[1-2]。2020版《中国药典》[3]记载珍珠味甘、咸、寒,入心、肝经,有安神定惊、明目消翳、解毒生肌、润肤祛斑的功效;珍珠母味咸性寒,归肝、心经,具有平肝潜阳,安神定惊,明目退翳的功效。源于马氏珍珠贝的珍珠和珍珠母应用于中医临床已有千年历史,其珍珠和贝壳均是重要的传统中药,历代本草均有记载。尽管其软体部分的功效鲜有记载,但现代研究表明马氏珍珠贝软体富含蛋白质类、多烯不饱和脂肪酸类,及人体所需的各种无机盐和微量元素[4],营养物质丰富。
近年来,酶解技术被广泛应用于贝类软体活性肽制备的研究。在蛋白酶的作用下,蛋白质类被水解为易吸收的小分子多肽[5]。研究表明,这类小分子多肽通常具有降血压、降血糖、抗氧化、抗肿瘤、抗菌、免疫调节等作用[6-15]。如采用复合蛋白酶对红岛蛤蜊[16]进行酶解,得到的蛤蜊肽具有良好的血管紧张素转化酶抑制活性。木瓜蛋白酶酶解联合Plastein反应修饰的方法得到的牡蛎[17]多肽血管紧张素转化酶抑制率为82.31%。胰蛋白酶酶解贻贝[18]得到的酶解肽血管紧张素转化酶抑制率的IC50为215.96 μg/mL。复合蛋白酶酶解扇贝裙边[19]得到的酶解肽具有α-葡萄糖苷酶抑制活性,可以改善正常小鼠对血糖浓度的调节能力,对机体的糖耐受能力有一定的增强作用。本课题组前期采用酸性蛋白酶酶解杂色蛤[20]得到的酶解肽具有二肽基肽酶-IV(dipeptidyl peptidase,DPPIV)抑制活性且可促进胰岛素抵抗细胞的葡萄糖摄取量。
软体动物蛋白质类成分丰富,是酶解活性肽的重要来源,本文在前期研究基础上以DPP-IV抑制率和HepG-2细胞的葡萄糖消耗量为指标,通过单因素试验和正交试验筛选优化酶解工艺,评价马氏珍珠贝软体酶解肽的降糖活性,并探究其物质组成。通过本文的研究以期为马氏珍珠贝软体降糖产品的开发提供研究基础与理论依据。
1 材料与方法
1.1 材料与仪器
新鲜马氏珍珠贝软体 广西北海;HepG-2细胞中科院上海细胞库;酸性蛋白酶(50000 U/g)、碱性蛋白酶(200000 U/g)、中性蛋白酶(50000 U/g)、复合蛋白酶(100000 U/g)、胰蛋白酶(250000 U/g)、木瓜蛋白酶(800000 U/g)、盐酸罗格列酮 北京索莱宝科技有限公司;风味蛋白酶(20000 U/g) 源叶试剂公司;DMEM培养基 美国Hyclone公司;胎牛血清 美国Gibco公司;DPP-IV 美国BioLegend公司;葡萄糖测定试剂盒 上海荣盛生物药业有限公司;IIe-Pro-IIe(纯度>98.0%) 南京金斯瑞生物科技有限公司。
BT 125 D型电子分析天平 德国Sartorious有限公司;FA 2004型电子分析天平 上海上平仪器设备有限公司;真空浓缩蒸发仪 美国Labconco公司;PHS-25 pH计 上海仪电科学仪器股份有限公司;MO-AOR型培养箱 美国Major Science公司;BB 150二氧化碳培养箱 美国Thermo scientific公司;SW-CJ-2FD洁净工作台 苏州净化设备公司;戴安U3000 Nano RSLC纳升液相系统 美国DIONEX公司;Thermo Q Exactive Plus Orbitrap质谱仪 美国Thermo Fisher公司。
1.2 实验方法
1.2.1 马氏珍珠贝软体酶解工艺 称取一定量的马氏珍珠贝软体(仅贝肉),按设定的料液比加入纯水后匀浆,用1 mol/L NaOH溶液和1 mol/L HCl溶液调节至最适的pH,然后加入适量的蛋白酶,置于恒温水浴锅中调至最适温度进行搅拌酶解。酶解1 h后,沸水浴灭酶10 min,冷却后5000 r/min离心20 min,取上清液,得马氏珍珠贝软体酶解液。将酶解液冻干,得马氏珍珠贝软体酶解液冻干粉。
1.2.2 蛋白酶的筛选 称取100 g马氏珍珠贝软体,按料液比1:3(w:w)加入纯水,匀浆,平均分成7份。选取7种蛋白酶:酸性蛋白酶、碱性蛋白酶、中性蛋白酶、复合蛋白酶、胰蛋白酶、风味蛋白酶、木瓜蛋白酶。在加酶量1000 U/g(每1 g软体加入1000 U蛋白酶)以及各酶的最适pH和温度下酶解1 h,具体酶解条件见表1。其余步骤同1.2.1,得到的酶解液冻干粉以DPP-IV抑制率和HepG-2细胞的葡萄糖消耗量为指标[20-21],选出马氏珍珠贝软体酶解的最佳蛋白酶。

表1 不同蛋白酶酶解条件Table 1 Digestion conditions of different proteases
1.2.3 单因素实验
1.2.3.1 酶解温度的筛选 称取100 g马氏珍珠贝软体,按料液比1:3(w:w)加入纯水,匀浆,平均分成5份。温度设定为40、45、50、55、60 ℃[22],调节pH3.0,选择酸性蛋白酶,加酶量1000 U/g,酶解1 h。其余步骤按“1.2.2”操作。取冻干粉测DPP-IV抑制率和HepG-2细胞的葡萄糖消耗量。
1.2.3.2 酶解时间的筛选 称取100 g马氏珍珠贝软体,按料液比1:3(w:w)加入纯水,匀浆,平均分成5份。温度设定为45 ℃,调节pH3.0,选择酸性蛋白酶,加酶量1000 U/g,各样品分别酶解1、2、3、4、5 h。其余步骤按“1.2.2”操作。取冻干粉测DPP-IV抑制率和HepG-2细胞的葡萄糖消耗量。
1.2.3.3 加酶量的筛选 称取100 g马氏珍珠贝软体,按料液比1:3(w:w)加入纯水,匀浆,平均分成5份。温度设定为45 ℃,调节pH3.0,选择酸性蛋白酶,各样品加酶量分别为600、800、1000、1200、1400 U/g,酶解3 h。其余步骤按“1.2.2”操作。取冻干粉测DPP-IV抑制率和HepG-2细胞的葡萄糖消耗量。
1.2.3.4 料液比的确定 称取100 g马氏珍珠贝软体,平均分成5份,按料液比1:1、1:2、1:3、1:4、1:5(w:w)分别加入纯水,匀浆。温度设定为45 ℃,调节pH3.0,选择酸性蛋白酶,加酶量1000 U/g,酶解3 h。其余步骤按“1.2.2”操作。取冻干粉测DPPIV抑制率和HepG-2细胞的葡萄糖消耗量。
1.2.4 马氏珍珠贝软体酶解正交试验 在单因素酶解实验的基础上,选择酶解温度、时间、加酶量、料液比四个因素,以DPP-IV抑制率和HepG-2细胞的葡萄糖消耗量为指标,进行L9(34)正交试验进行酶解工艺的优化,试验因素与水平见表2。

表2 正交试验因素与水平表Table 2 Factors and levels table of orthogonal experiment
1.2.5 马氏珍珠贝软体不同极性酶解样品的制备及活性测定 取酶解样品冻干粉200 mg,用0.1% TFA复溶,采用Waters Sep-Pak C18固相萃取小柱分离,上样,以0.1% TFA洗脱10次后,分别用10%、15%、20%、40%乙腈(均含0.2% TFA)洗脱,收集不同浓度的乙腈洗脱液,冻干保存,待测DPP-IV抑制率。
1.2.6 马氏珍珠贝软体酶解肽15%乙腈洗脱部位Nano LC-MS/MS分析 色谱条件:色谱柱:Reprosil C18AQ(75 μm×150 mm, 5 μm);进样量1 μL,流速400 nL/min;流动相A(乙腈-甲酸-水 2:0.2:98),流动相B(乙腈:甲酸:水 80:0.2:20),2%~30% B线性梯度洗脱120 min。
质谱条件:电子能量2.5 kV;离子传输毛细管温度200 ℃;质谱一级全扫描范围m/z 300~2000;分离宽度3。串联质谱分析获得总离子色谱图(TIC),通过碰撞诱导解离(CID),产生一系列MS/MS图。
采用Maxquant软件进行搜库鉴定,选择软体动物门数据库(Mollusca,2021年1月下载于www.uniprot.org);检索参数:前体离子误差20 ppm,子离子误差0.2 Da;酶切方式:unspecific;其他为默认参数,在上述检索条件下所得的分值有显著性意义(P<0.05),被认为有效的鉴定结果[23]。
1.2.7 HepG-2细胞葡萄糖消耗量的测定 HepG-2细胞用含10% FBS的DMEM培养基[24-26]培养于培养皿中,置于37 ℃、5% CO2的培养箱中培养,2~3 d更换一次新鲜培养基。细胞生长至90%融合时,对细胞进行传代。按照每孔1×105个细胞接种到96孔板中,孵育24 h后,给药。
对照组、模型组给予单一培养基,阳性药组给予0.2 mg/mL的盐酸罗格列酮溶液,给药组给予不同浓度样品。给药30 min后,对照组加全培,模型组、阳性药组、给药组加50 mg/mL棕榈段诱导剂,孵育24 h后,更换培养基为低糖DMEM孵育12 h。
采用GOD-POD微量法在505 nm下测剩余葡萄糖含量,利用标准品吸光度(OD)值,计算葡萄糖消耗量[27]。

1.2.8 体外DPP-IV抑制率的测定 分为样品组、样品空白组、阳性药组、阳性药空白组、阴性对照组和空白组。样品组和样品空白组加入1.25 mg/mL样品,阳性药及阳性药空白组加入0.3 mmol/L Ile-Pro-Ile溶液,阴性对照组和空白组加入15 mmol/L Tris-HCl缓冲溶液;各组均加入3.2 mmol/L Gly-Pro-PNA 37 ℃孵育10 min后,给药组、阳性药组、阴性对照组加入0.1 μg/mL DPP-IV溶液,继续孵育1 h后,加100 μL 1 mmol/L醋酸钠水溶液终止反应。
在405 nm下测定吸光度,计算DPP-IV抑制率[28-29]。

1.2.9 活性评分方法 葡萄糖消耗量评分为各种酶解方法在不同浓度的倒数与对应葡萄糖消耗量的乘积的平均值;综合评分为葡萄糖消耗量评分和DPPIV抑制率的和。
1.3 数据处理
2 结果与分析
2.1 蛋白酶的筛选
本实验选取了7种常用的蛋白酶:酸性蛋白酶、碱性蛋白酶、中性蛋白酶、复合蛋白酶、胰蛋白酶、风味蛋白酶、木瓜蛋白酶,以DPP-IV抑制率和HepG-2细胞的葡萄糖消耗量为指标,酶解结果如图1所示。由图1A可知,酸性蛋白酶、碱性蛋白酶、中性蛋白酶、复合蛋白酶酶解的马氏珍珠贝软体样品在不同浓度下其葡萄糖消耗量均高于胰蛋白酶、风味蛋白酶、木瓜蛋白酶酶解的样品;由图1B可知,风味蛋白酶酶解的产物DPP-IV抑制率最高,为53.34%,酸性蛋白酶次之,为46.61%。以葡萄糖消耗量评分和DPP-IV抑制率的和综合评分,如图1C所示,酸性蛋白酶酶解产物的综合评分最高,为68.83%,这可能是由于酸性蛋白酶的酶切位点使马氏珍珠贝软体暴露的降糖活性位点更充分,故选择酸性蛋白酶进行后续实验。

图1 蛋白酶种类对酶解效果的影响Fig.1 Effect of protease types on the effect of enzymolysis
2.2 单因素实验
2.2.1 酶解温度的筛选 酶解温度过高或过低均会降低酸性蛋白酶的活力。酶解温度对HepG-2细胞葡萄糖消耗量的影响如图2A所示,当HepG-2细胞的给药浓度大于25.00 μg/mL时,在40~45 ℃范围内,细胞的葡萄糖消耗量随温度升高而增大,温度为50 ℃时,达到最大值。酶解温度对DPP-IV抑制率的影响如图2B所示,在40~50 ℃范围内DPP-IV抑制率随温度升高而增大,50 ℃时酶解的产物表现出最高的DPP-IV抑制率52.74%。超过50 ℃时DPP-IV抑制率开始下降。酶解温度增高,提高了分子碰撞的机率,有利于催化酸性蛋白酶酶解马氏珍珠贝软体。温度继续升高,酶的活性下降,酶解不充分导致发挥降糖作用的活性位点未暴露而未能发挥作用。以葡萄糖消耗量评分和DPP-IV抑制率的和综合评分,如图2C所示,50 ℃下酶解得到的产物评分最高,为63.42%,故选择50 ℃作为酸性蛋白酶的酶解温度。

图2 酶解温度对酶解效果的影响Fig.2 Effect of enzymolysis temperature on enzymolysis effect
2.2.2 酶解时间的筛选 酶解时间对HepG-2细胞葡萄糖消耗量的影响如图3A所示,酶解时间从1到5 h,细胞各给药浓度均在3 h处达到最高点,表明酶解3 h的产物在各浓度下均表现出较高的葡萄糖消耗量;图3B中酶解3 h的产物DPP-IV抑制率最高,为74.19%。这可能是由于酶解时间较短时软体酶解不充分,导致水解度降低,发挥降糖活性的位点未暴露而未能发挥作用;酶解时间过长导致副反应发生,生成的副产物阻碍了酶解肽活性位点与相应受体的结合,导致降糖活性减弱。以葡萄糖消耗量评分和DPP-IV抑制率的和综合评分,如图3C所示,酶解3 h的产物综合评分最高,为79.74%。因此酸性蛋白酶酶解马氏珍珠贝软体的最佳时间为3 h。

图3 酶解时间对酶解效果的影响Fig.3 Effect of enzymolysis time on the effect of enzymolysis
2.2.3 加酶量的筛选 加酶量对HepG-2细胞葡萄糖消耗量影响如图4A所示,加酶量在600~1200 U/g范围内,HepG-2细胞的葡萄糖消耗量均随给药浓度增大而呈现升高的趋势,加酶量为1400 U/g,给药浓度大于1.56 μg/mL时,HepG-2细胞的葡萄糖消耗量较加酶量为1200 U/g时均呈下降趋势,这表明给药浓度过高和加酶量过高对胰岛素抵抗细胞摄取葡萄糖有一定的抑制作用;加酶量对DPP-IV抑制率的影响如图4B所示,加酶量为1000 U/g的酶解产物表现出最高的DPP-IV抑制率,为78.96%。这可能是由于加酶量过低时,马氏珍珠贝软体未充分酶解,发挥降糖作用的位点未充分暴露导致降糖活性较弱;加酶量过高时,可能会有副反应发生,生成的副产物阻碍了酶解肽活性位点与相应受体的结合,导致降糖活性减弱。以葡萄糖消耗量评分和DPP-IV抑制率的和综合评分,如图4C所示,加酶量为1000 U/g的酶解产物综合评分最高,为85.42%,故选择加酶量为1000 U/g。

图4 加酶量对酶解效果的影响Fig.4 Effect of enzyme dosage on the enzymolysis effect
2.2.4 料液比的确定 料液比对HepG-2细胞葡萄糖消耗量的影响如图5A所示,在各料液比条件下,HepG-2细胞葡萄糖消耗量均随给药浓度的升高呈上升趋势;料液比从1:2到1:5(w:w),给药浓度小于6.25 μg/mL时HepG-2细胞葡萄糖消耗量在料液比为1:3或1:4(w:w)时达到最高值。料液比过低时,底物浓度较高可催化酶解反应进行,但反应体系较粘稠导致酶解反应不充分,因此出现了图5A所示的料液比为1:1(w:w)时细胞的葡萄糖消耗量在各给药浓度下均高于料液比为1:2(w:w)时细胞的葡萄糖消耗量;料液比过高时,反应体系为溶液状态,酶和底物可以充分接触反应完全,但底物浓度过低导致酶解反应缓慢,因此出现了图5A所示的给药浓度低于6.25 μg/mL时料液比增加到1:5(w:w),细胞的葡萄糖消耗量开始降低的现象。料液比对DPPIV抑制率的影响如图5B所示,可能是由于料液比为1:3(w:w)时的反应体系为溶液状态且底物浓度未减缓酶解反应的速度,此时产物DPP-IV抑制率最高,为68.09%。以葡萄糖消耗量评分和DPP-IV抑制率的和综合评分,如图5C所示,料液比为1:3(w:w)时的综合评分最高,为77.12%。料液比为1:1和1:2(w:w)时的综合评分分别为76.52%和76.29%,与料液比为1:3(w:w)的综合评分相近,但考虑到料液比为1:1和1:2(w:w)时的酶解液较粘稠,离心后上清较少,样品得率较低,仍选择料液比为1:3(w:w)进行酶解。

图5 料液比对酶解效果的影响Fig.5 Effect of material-liquid ratio on enzymolysis
2.3 正交试验优化酶解工艺
酸性蛋白酶酶解马氏珍珠贝软体的正交试验结果见表3、表4。由直观分析结果可以看出,对DPPIV抑制率和HepG-2细胞的葡萄糖消耗量综合评分影响的大小顺序为A(酶解温度)>C(加酶量)>B(时间)>D(料液比)。酸性蛋白酶酶解马氏珍珠贝软体的最佳工艺参数为:A1B2C2D3,即酶解温度45 ℃、酶解时间3 h、加酶量1000 U/g、料液比1:3.5。方差分析显示,酶解温度、酶解时间和加酶量对DPPIV抑制率和HepG-2细胞的葡萄糖消耗量综合评分有显著影响。

表3 正交试验设计及结果Table 3 Design and results of orthogonal experiments

表4 正交试验方差分析Table 4 Analysis of variance of orthogonal array experimental results
2.4 最优组合条件验证
取马氏珍珠贝软体20 g,按料液比1:3.5加入纯水,匀浆后调节pH3.0,加酶量1000 U/g,于45 ℃酶解3 h后,沸水浴灭酶10 min,冷却后5000 r/min离心20 min,取上清液,得马氏珍珠贝软体酶解液。将酶解液冻干,得马氏珍珠贝软体酶解液冻干粉。重复验证三次,测得马氏珍珠贝软体酶解液的DPP-IV抑制率和HepG-2细胞的葡萄糖消耗量综合评分分别为97.12%、97.66%、94.16%,RSD为1.96%,在此条件下的葡萄糖消耗量为37.53%、DPP-IV抑制率为74.21%,表明该工艺稳定可靠。
2.5 马氏珍珠贝软体酶解样品不同极性部位DPPIV抑制活性测定
马氏珍珠贝软体酶解样品不同极性部位的DPP-IV抑制活性评价结果如图6所示,在终浓度为1.25 mg/mL的情况下,15%乙腈洗脱部位具有最佳的DPP-IV抑制活性,抑制率为52.39%±2.61%。故对15%乙腈洗脱部位进行成分分析鉴定。
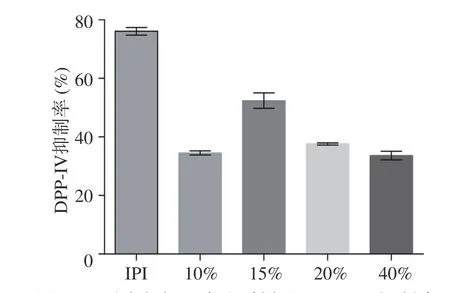
图6 不同浓度乙腈洗脱样品DPP-IV抑制率Fig.6 Inhibition rate of DPP-IV in samples eluted with acetonitrile at different concentrations
2.6 马氏珍珠贝软体酶解肽15%乙腈洗脱部位nano-LC-MS/MS数据分析
从马氏珍珠贝软体酶解肽15%已经洗脱部位中共鉴定了327个肽段,这些肽段主要来源于肌动蛋白、微管蛋白和组蛋白。已知质谱数据和数据库中的数据越吻合得分越高,本文列出得分较高的前20条肽段信息,如表5所示。

表5 得分最高的前20种多肽Table 5 Top 20 peptides with the highest score
以肽段YASGRTTGIVLDSGDGVTH为例,说明肽段的鉴定过程:该肽段[M+H]2+m/z 1906.923,MS/MS(图7)显示其主要碎片离子有b9+(900.41)、b10+(1006.53)、b11+(1119.61)、b12+(1237.64)、b15+(1493.72)、b16+(1553.75)、b17+(1651.80)、b18+(1742.87);y1+(155.08)、y2+(257.12)、y4+(408.16)、y7+(672.29)、y8+(787.32),经搜库确定该肽段来自肌动蛋白,具体位置见如下。质谱数据与数据库结果吻合,确定肽段的序列为YASGRTTGI VLDSGDGVTH,源于肌动蛋白序列的144至162位。

图7 YASGRTTGIVLDSGDGVTH的MS/MS Fig.7 MS/MS of YASGRTTGIVLDSGDGVTH
本次实验统计了327个肽段中每种氨基酸出现的频次,如图8A,其中亲水性氨基酸2219个,疏水性氨基酸1875个;数量最多的前5种氨基酸分别是:疏水性氨基酸甘氨酸(Gly,G,452个)、丙氨酸(Ala,A,333个)和亲水性氨基酸丝氨酸(Ser,S,361个)、苏氨酸(Thr,T,340个)、谷氨酸(Glu,E,327个),亲水性氨基酸与疏水性氨基酸数量比例为1.18:1。如图8B,通过计算亲水平均值来评估肽段的亲水性和疏水性,GRAVY值小于0则具有亲水性,结果显示77.37%为亲水性多肽,26.61%的肽段N-末端侧的两个氨基酸为疏水氨基酸,74.92%的肽段N-末端侧的两个氨基酸中至少含有一个疏水氨基酸。已有研究表明,疏水氨基酸的存在能增强与DPP-IV活性位点的相互作用,DPP-IV S1亚位点的疏水口袋在DPP-IV抑制中起着非常重要的作用,且位于N端侧两个氨基酸的疏水性与肽的DPP-IV效力呈正相关[30]。如图8C,对多肽分子量分布情况进行统计,结果显示多肽分子量(MW)主要分布在711.30至2602.12 Da之间,其中93.88%的肽段分子量低于2000 Da。Puneet Tyagi[31]研究显示,肽段的效价、口服利用度与分子量呈反比趋势,这表明马氏珍珠贝软体酶解肽具有成为口服药物穿过膜屏障发挥生物效应的潜能。

图8 肽段分析Fig.8 Peptide analysis
3 结论
本文以马氏珍珠贝软体为研究对象,以DPPIV抑制率和葡萄糖消耗量为指标优化确定了马氏珍珠贝软体的酶解工艺,即以酸性蛋白酶酶解,在45 ℃,酶解时间3 h,料液比1:3.5(w:w),加酶量1000 U/g的条件下,制备得到的酶解液的DPP-IV抑制率和葡萄糖消耗量综合评分最高,DPP-IV抑制率为74.21%,HepG-2细胞葡萄糖消耗量为37.53%。经过Nano LC-MS/MS鉴定发现马氏珍珠贝软体酶解肽15%乙腈洗脱部位中,22.63%的肽段为疏水性肽段,74.92%的肽段N端至少有含有一个疏水性氨基酸,93.88%的肽段分子量低于2000 Da。本实验研究表明马氏珍珠贝软体酶解肽有作为健康食品和功能食品生物活性原料的潜能,这在很大程度上解决了马氏珍珠贝综合利用程度低的问题。将马氏珍珠贝剥取珍珠后被废弃的软体资源加以开发利用,形成具有潜在降糖作用的酶解物,对促进马氏珍珠贝的综合利用、开发健康产品具有较好的指导意义。
