荧光假单胞菌ZX对葡萄采后灰霉病的防治
2021-11-14江孟遥王智荣ZSOLTZalanFERENCHegyi
魏 雪,江孟遥,钟 涛,张 曼,王智荣,ZSOLT Zalan,FERENC Hegyi,
KRISZTINA Takacs3,杜木英1,2,4, *
(1.西南大学食品科学学院,重庆 400715;2.中匈食品科学联合研究中心,重庆 400715;3.匈牙利国家农业创新研究中心,匈牙利布达佩斯 1022;4.农业部农产品贮藏保鲜质量安全风险评估实验室(重庆),重庆 400715)
葡萄(Vitis viniferaL.)为葡萄科葡萄属木质藤本植物,是世界各国广泛种植的水果,不仅味美可口,而且营养价值高[1]。从2011年起,我国鲜食葡萄产量已稳居世界首位,到2019我国的鲜食葡萄产量达到1419.5万吨,是最大的葡萄生产国[2-3]。但葡萄组织水分含量高、果肉娇嫩,采后生理代谢旺盛,因此果实在运输和贮藏过程中极易遭受病原真菌的侵染而发生腐烂变质。由Botrytis cinerea引起的灰霉病(Gray mold)是全球各种果蔬中最常见和普遍发生的病害,也是造成葡萄采后腐烂损失的主要原因。葡萄果实的贮藏条件相对湿度较大、温度适宜,容易大面积发病,导致每年葡萄采后的损失率高达50%[4]。使用二氧化硫、硫化物等化学保鲜剂和吡咯类、咪唑类、甲氧基丙烯酸酯类化学杀菌剂都是生产上常用的防治葡萄采后灰霉病的有效方法,但使用过程中造成的病原菌抗药性增加、化学药物残留、环境污染等问题日益突出[5-7]。随着近年来消费者对食品安全性的关注,使用安全无毒具有拮抗作用的微生物对采后果蔬进行生物防治已经成为果蔬防腐保鲜技术发展的新方向。
荧光假单胞菌(Pseudomonas fluorescens),广泛分布于植物根际土壤和果蔬表面,是近几十年来最具应用价值的一类植物病害生防菌和根际促生菌,对病原菌具有良好的防治效果。有研究显示P. fluorescens能有效控制苹果、番茄和草莓果实采后青霉病、酸腐病和灰霉病发病率[8-10],对病原菌生长繁殖有显著抑制效果。我们前期研究发现,P. fluorescensZX能显著抑制指状青霉(Penicillium digitatum)的生长,有效降低采后柑橘的发病率[11-12],但现阶段有关P. fluorescensZX处理抑制B. cinerea的研究较少,生防菌的拮抗机理尚不明确,我们研究了P. fluorescensZX对葡萄灰霉病的防治效果,为P. fluorescensZX的深入研究提供一定的理论基础。在扩展微生物源杀菌剂途径、减少葡萄采后损失、提高葡萄食用安全性等方面也具有积极意义[13]。因此,本研究以“巨峰”葡萄为试材,主要研究了不同处理模式下P. fluorescensZX对葡萄果实灰霉病的控制效果,着重分析了P.fluorescens对B. cinerea可能存在的作用模式,初步探讨P. fluorescensZX控制B. cinerea发病的机制,旨在为进一步开发果蔬采后保鲜方案提供一定的理论参考。
1 材料与方法
1.1 材料与仪器
“巨峰”葡萄(Vitis viniferaL.×V. labruscaL.‘Kyoho’) 采于重庆市北碚区金刀峡镇诗进葡萄种植股份合作社,商业成熟的葡萄,采摘后立即运回实验室,过程中注意尽量不要碰撞和损伤果实。拮抗菌 匈牙利Dr. Zsolt Zalán研究员惠赠;B. cinerea病原菌 由西南大学植物保护学院惠赠;葡萄糖、氯化钠、氢氧化钠 成都市科龙化工试剂厂;琼脂粉、牛肉浸粉、葡萄糖标准品、果糖标准品 北京索莱宝科技有限公司;乙腈 色谱纯,美国Spectrum公司;抑霉唑水乳剂 一帆生物科技集团有限公司;马铃薯葡萄糖固体培养基(PDA):马铃薯200 g,葡萄糖20 g,琼脂15~20 g 蒸馏水1000 mL;营养肉汤培养基(NA):蛋白胨10 g,牛肉粉3 g,氯化钠5 g,琼脂15~20 g;营养肉汤培养基(NB):配方同NA,但不加琼脂;马铃薯葡萄糖液体培养基(PDB):制作方法同马铃薯葡萄糖固体培养基但不加入琼脂。
BSA224S电子天平 塞多利斯科学仪器(北京)有限公司;LRHS-150-Ⅱ型恒温恒湿培养箱 上海跃进医疗器械有限公司;WZT-1M型细菌浊度仪 上海劲佳科学仪器有限公司;QP201010500型GCMS气质联用仪 日本岛津公司;Phenom Pro10102型扫描电镜 Phenom World公司。
1.2 实验方法
1.2.1 实验前预处理 将采摘回来的葡萄沿果穗逐粒剪下,留3~5 mm果梗,选择饱满圆润、无病虫害、无受伤、无干枯、成熟度和大小一致的健康果实,静置2 h,除去田间热后用75%的乙醇进行表面消毒,室温晾干。
拮抗菌活化后,参照Jiang等[11]的方法制备拮抗菌原液、滤液、热杀死液和菌悬液。拮抗菌原液:移取拮抗菌培养液,用浊度仪测定菌液浊度,调节浓度至0.33 MCF(约为1×108CFU/mL);滤液:将培养液6000 r/min离心10 min,取上清液用无菌注射器经0.22 μm聚碳酸酯膜过滤得到;热杀死液:原液在121 ℃下高压灭菌20 min。菌悬液:将拮抗菌培养液6000 r/min离心10 min,倒去上清,收集菌体,用无菌水(sterile distilled water,SDW)洗涤菌体两次,最后加入SDW,调节至所需浓度。
病原菌的前处理方法,参照王智荣等[12]的方法制备病原菌孢子悬浮液,用接种环将培养基上的病原菌刮下,接入0.05%吐温80无菌水中,涡旋均匀,用无菌纱布过滤,再次涡旋,血球计数板计数,并稀释至所需浓度。
1.2.2 不同P. fluorescensZX处理液对葡萄灰霉病的防治效果 将预处理的葡萄赤道周围各刺一个3 mm(宽)×3 mm(深)的孔,随机分成3组,先分别接种10 μL 0.5 MCF拮抗菌培养原液、滤液、热杀死液和菌悬液,自然风干2 h后接种10 μL病原菌孢子悬浮液(1×105spores/mL),以SDW和农药抑霉唑(1000倍稀释液,商业建议用量)处理作对照,自然晾干后将果实放入周转箱中,用保鲜膜进行密封,以保持90%的相对湿度,置于20 ℃的恒温恒湿培养箱中培养。每组处理30个果实,3次重复。当葡萄果实表面灰霉病病斑直径大于1.5 mm时,记为发病。培养1、3、5 d后测定果实的发病率和病斑直径。
1.2.3 不同接种时间对P. fluorescensZX防治葡萄灰霉病效果的影响 水果打孔后,在接种病原菌孢子悬浮液之前的24、12、6、0 h和接种之后的6、12、24 h接种相同体积麦氏浊度为0.50 MCF的P.fluorescensZX菌悬液,自然晾干后将果实放入周转箱中,用保鲜膜进行密封,20 ℃、90%相对湿度恒温恒湿培养箱中培养5 d后,测定果实的发病率和病斑直径。
1.2.4P. fluorescensZX的生长动态
1.2.4.1P. fluorescensZX在葡萄果实伤口处的生长动态 参照严圆[14]的方法,稍作修改。在葡萄赤道周围打两个孔径一致的伤口,后接种10 μL 0.5 MCF拮抗菌菌悬液,2 h后,再接种相同体积的病原菌孢子悬浮液(1×105spores/mL),以SDW作对照,逐果袋封。分别贮藏于4 ℃和20 ℃、90%相对湿度环境下,每隔一段时间取样测定伤口表面的拮抗菌数。20 ℃条件下的葡萄果实共测定8 d,每2 d 测定一次,4 ℃条件下的葡萄果实共测定16 d,每4 d测定一次。结果以log10CFU/伤口表示。
1.2.4.2P. fluorescensZX在葡萄果实表面的生长动态 参照王智荣[15]的方法,分别用无菌水和麦氏浊度为0.5 MCF的P. fluorescensZX菌悬液浸渍完整无损的果实2 min,自然晾干后,再用1×105spores/mL病原菌孢子悬浮液浸泡2 min,逐果袋封。分别贮藏于4 ℃和20 ℃、90%相对湿度环境下,测定方法同上。计数结果以log10CFU/circle 表示,其中circle表示果实经浸泡处理后表面的拮抗菌数。
1.2.5P. fluorescensZX各种处理液对病原菌孢子萌发的影响 参照Jiang等[11]的方法,在装有14 mL PDB的试管中,加入4 mL的病原菌孢子悬浮液(1×105spores/mL)、2 mL拮抗菌各种处理液和14 mL SDW,28 ℃、150 r/min恒温振荡培养,每隔4 h观察一次孢子萌发情况。当芽管长度大于等于孢子直径时,认为孢子萌发,即可计算病原菌孢子萌发率以及芽管长度。
1.2.6P. fluorescensZX挥发性次生代谢产物(Volatile organic compounds,VOCs)的抑菌作用分析
1.2.6.1 平板抑菌试验 参照王智荣等[16]的方法,分别移取0.1 mL浓度为0.25、0.50、0.75、1.0 MCF的拮抗菌菌悬液和0.1 mL原液、热杀死液、滤液于NA平板上均匀涂布,30 ℃恒温培养2 d;另取PDA平板,中央放入病原菌丝块(D=6 mm),两板对扣密封,室温培养7 d后,测定病原菌菌落直径。以SDW涂布的平板作对照。
均采用十字交叉法测定病斑直径,按下式计算相对抑菌率:

1.2.6.2P. fluorescensZX挥发性次生代谢产物的GC-MS分析 王智荣等[15]报道P. fluorescensZX抑制病原微生物生长繁殖有多种方式,其抑菌途径主要是通过营养和空间竞争,P. fluorescensZX产生的VOCs能明显减缓采后锦橙的病害进程,具有较强的抑菌作用。因此本实验考虑直接探究P. fluorescensZX中的挥发性物质。参照Stanborough等[17]的方法并作适当修改。将0.2 g/mL灭菌的NA培养基用100 mL无菌注射器等分至经紫外灭菌的15 mL玻璃顶空瓶中。按1%的接种量培养P. fluorescensZX,28 ℃,150 r/min振摇培养12 h,制备菌悬液,调节浓度至0.5 MCF。将100 μL 0.5 MCF的菌悬液无菌加入至装有0.2 g/mL培养基的玻璃顶空瓶中,对照组接种等体积的无菌水。振摇培养24 h后进行测定。40 ℃预热35 min,然后插入100 μm PDMS萃取头,顶空取样40 min,用GC-MS进行挥发性香气成分分析。
色谱条件:DB-FFAP弹性石英毛细管柱(30 mm×0.25 mm×0.25 μm)。载气为氦气,流速1.0 mL/min,不分流,进样口温度280 ℃。升温程序为:起始初温35 ℃,保持5 min,以10 ℃/min的升温速度升至280 ℃,保持5 min。质谱条件为:接口温度280 ℃,离子源温度280 ℃,电子能量70 eV,时间间隔0.5 s。
1.2.7 扫描电镜观察P. fluorescensZX与B. cinerea离体条件下的相互作用 移取0.1 mL浓度为0.5 MCF的P. fluorescensZX菌悬液于1/2 NA+1/2 PDA(添加5%新鲜葡萄汁)平板上均匀涂布,30 ℃恒温培养2 d后于平板中央放入经7 d培养的B. cinerea菌丝块(D=6 mm),室温培养5 d,参照Wallace等[18]的方法稍作修改,用无菌打孔器取下病斑,无菌牙签挑取菌丝于载玻片,乳酸酚棉蓝染色,扫描电镜下观察拍照。以SDW涂布的平板作为对照。
1.2.8 扫描电镜观察P. fluorescensZX与B. cinerea活体条件下的相互作用 用无菌接种针在葡萄赤道周围打两个直径为3 mm(宽)×3 mm(深)的伤口。然后接种10 μL 0.5 MCFP. fluorescensZX菌悬液,2 h后再接种10 μL病原菌孢子悬浮液(1×105spores/mL),72 h以后,将伤口组织削下用2.5%的戊二醛固定,乙醇逐级脱水,扫描电镜进行观察。
1.3 数据处理
采用SPSS 19.0软件进行数据处理分析,用Tukey多重比较方法进行差异显著性分析,Origin 9.0软件进行绘图。
2 结果与分析
2.1 P. fluorescens ZX 对葡萄采后灰霉病的防治效果
从图1可以看出,贮藏5 d 后P. fluorescensZX处理有效减缓了采后葡萄灰霉病的发病率和病斑直径,但是对B. cinerea的防控效果明显弱于农药抑霉唑,当对照组葡萄果实发病率高达64.67%时,P.fluorescensZX处理仅为24.8%。根据病斑直径的实验结果来看,抑霉唑处理和P. fluorescensZX处理没有显著性差异,P. fluorescensZX处理与对照组相比具有显著性差异。
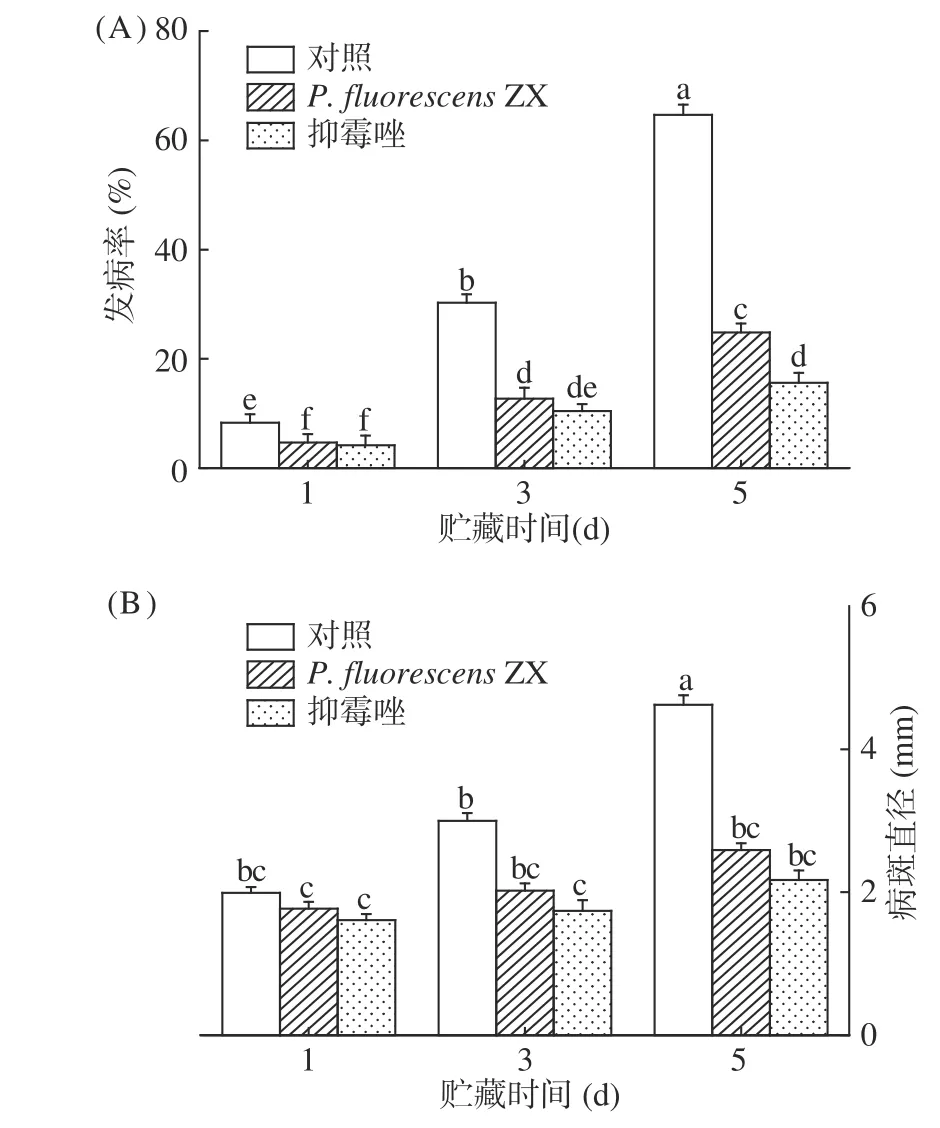
图1 荧光假单胞菌ZX对葡萄采后灰霉病的抑制效果Fig.1 Inhibitory effect of P. fluorescens ZX on gray mold of grape berries
2.2 不同P. fluorescens ZX处理液对葡萄灰霉病的防治效果
由图2可知,P. fluorescensZX菌悬液对葡萄果实采后灰霉病的防治效果最好,20 ℃、90%相对湿度贮藏5 d后,菌悬液处理的葡萄果实的发病率最低,为42%,病斑直径最小,为3.5 mm,都显著低于(P<0.05)对照组;热杀死液、滤液、培养原液对葡萄采后灰霉病也有一定的抑制作用,但其抑菌效果不及同等浓度的菌悬液。滤液和热杀死液缺乏活细胞,对葡萄灰霉病的防治效果不明显,P. fluorescensZX培养原液的发病率与病斑直径显著低于滤液和热杀死液,显著高于菌悬液(P<0.05)。与原液相比,菌悬液去除了培养基中的营养成分,防治效果却更强,说明P. fluorescensZX的对葡萄灰霉病的抑菌途径可能是通过营养和空间竞争。这些研究结果与王智荣[15]的研究结果一致。

图2 P. fluorescens ZX各种处理液对葡萄灰霉病的防治效果Fig.2 Control effects of various treatment solutions of P.fluorescens ZX on gray mold of grape
2.3 不同接种时间对P. fluorescens ZX葡萄灰霉病的防治效果
由图3可知,接种拮抗菌24 h后接种病原菌孢子悬浮液发病率最低,为18%,病斑直径也最低,与对照组相比有显著性差异(P<0.05)。结果显示,拮抗菌P. fluorescensZX相对于B. cinerea孢子悬浮液的接种次序和间隔时间对P. fluorescensZX防治葡萄灰病的效果具有显著影响(P<0.05)。接种拮抗菌24 h后接种病原菌的防治效果更好。

图3 接种时间对P. fluorescens ZX防治葡萄采后灰霉病效果的影响Fig.3 Effect of inoculation time on the effect of P. fluorescens ZX on post-harvest gray mold of grape
2.4 P. fluorescens ZX 在葡萄果实上的生长动态
从图4可以看出,不论是低温冷藏还是室温贮藏亦或是接种处理还是浸泡处理,P. fluorescensZX都能在果实上快速生长繁殖;与无菌水相比,B.cinerea对P. fluorescensZX的增长有一定的抑制作用。不论是处理后2 h还是4 ℃下培养16 d,浸泡P. fluorescensZX+无菌水葡萄果实表面处的拮抗菌数量都明显高于浸泡P. fluorescensZX+灰霉孢子的拮抗菌数量;接种P. fluorescensZX+无菌水果实伤口处的拮抗菌数量明显高于P. fluorescensZX+灰霉孢子的拮抗菌数量。可以看出在贮藏期间,果实伤口处的拮抗菌生长速度明显高于果实表面,说明拮抗菌在果实伤口处更能抢占位置,消耗营养,从而抑制B.cinerea的生长。

图4 20 ℃和4 ℃下P. fluorescens ZX在葡萄果实上的动态生长Fig.4 Dynamic growth of P. fluorescens ZX at grape fruits in 20 ℃ and 4 ℃
2.5 P. fluorescens ZX不同处理液对病原菌孢子萌发情况的影响
由表1可知,与P. fluorescensZX共培养时B.cinerea孢子萌发受到显著抑制,原液和菌悬液的作用效力明显高于热杀死液和滤液。28 ℃恒温振荡培养16 h后,对照组的孢子悬浮液萌发率达到了79.46%,而菌悬液处理组的B. cinerea孢子仅为萌发率23.72%,B. cinerea孢子的芽管长度也显著低于对照组(P<0.05)。

表1 P. fluorescens ZX不同处理液对B. cinerea孢子萌发情况的影响Table 1 The effects of various treatments of P. fluorescens ZX to conidial germination of B. cinerea
2.6 P. fluorescens ZX不同处理液对病原菌的抑制作用
由图5可知,P. fluorescensZX各种处理液都对B. cinerea菌丝生长具有明显影响,热杀死液和滤液的抑菌效果相近,但其相对抑菌率远远低于菌悬液和原液;菌悬液和原液都具有较好的抑菌效果,0.5和0.75 MCF的P. fluorescensZX菌悬液对B.cinerea的相对抑菌率分别高达63.21%±1.50%和72.02%±0.53%。

图5 P. fluorescens ZX不同处理液对B. cinerea的抑制作用Fig.5 Different treatment fluids of P. fluorescens ZX to B. cinerea
2.7 P. fluorescens ZX挥发性次生代谢产物的GC-MS分析
从表2可以看出,P. fluorescensZX在葡萄汁培养基和营养肉汤培养基中恒温培养一定时间后,分别有21种物质被检测出,营养肉汤培养基的检出物质中主要是由醛、酸、醇、含硫化合物组成;葡萄汁培养基的检出物质中主要由酮、酸、醇组成。Hernández-León等[19]报道发现P. fluorescensUM16、UM240、UM256、UM270均能产生VOCs,其主要成分是小分子的乙醛、酮和醇等,而主要的抑菌成分可能是含硫化合物。菌株P. fluorescensZX能在营养肉汤培养基中产生相当比例的含硫化合物,对于是否含硫化合物主要是哪些含硫化合物起主要抑菌作用还需进一步研究。

表2 P. fluorescens ZX产生的挥发性次生代谢产物分析结果Table 2 Analysis results of the VOCs produced by P. fluorescens ZX
2.8 P. fluorescens ZX对病原菌平板上的重寄生作用
P. fluorescensZX与B. cinerea在PDA平板上经过7 d共培养后,经扫描电镜观察发现,P. fluorescensZX能够附着在B. cinerea的菌丝体上对其产生重寄生作用,破坏B. cinerea的菌丝形态,造成菌丝褶皱、产生水解孔,影响B. cinerea正常生长(图6)。
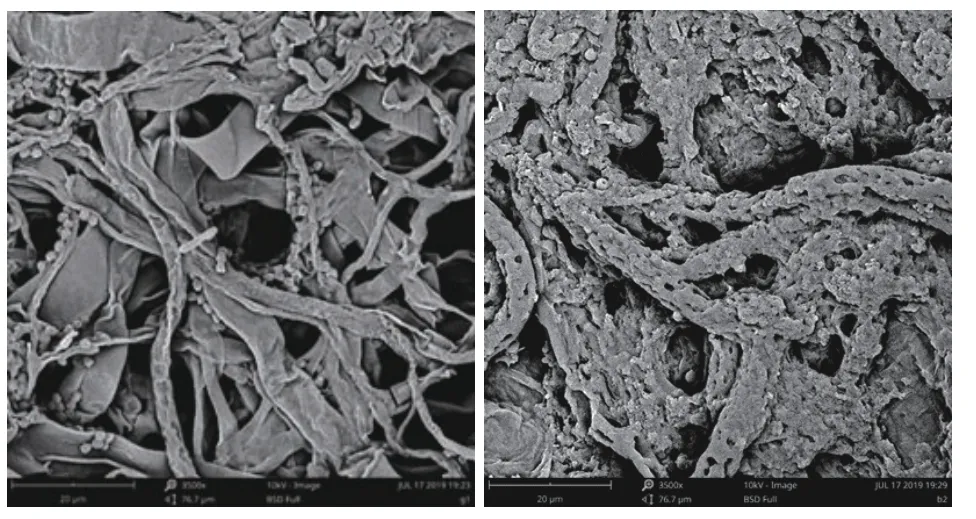
图6 B. cinerea(左)和B. cinerea与P. fluorescens ZX(右)离体条件下相互作用的扫描电子显微照片Fig.6 Scanning electron micrograph of healthy B. cinerea (left)and B. cinerea interacting with P. fluorescens ZX in vitro
2.9 P. fluorescens ZX对病原菌活体上的重寄生作用
P. fluorescensZX与B. cinerea在葡萄果实上经过72 h共培养后,经扫描电镜观察发现,P. fluorescensZX能够附着在B. cinerea菌丝上破坏B.cinerea菌丝形态、造成菌丝褶皱,影响B. cinerea正常生长(图7),说明活体条件下P. fluorescensZX亦能够对B. cinerea产生重寄生作用。

图7 B. cinerea(左)和B. cinerea与P. fluorescens ZX(右)在葡萄果实上相互作用的扫描电子显微照片Fig.7 Scanning electron micrograph of healthy B. cinerea(left)and B. cinerea interacting with P. fluorescens ZX(right) on grape berries
3 讨论
由于具有分布广、适应能力强、营养需求简单、繁殖快、竞争定殖能力强、易于人工培养、遗传背景清楚、对人和环境无害、能防治多种病原微生物等特点,P. fluorescens越来越受到专家学者的关注,成为近几十年来研究报道最多、最具应用价值的一类生防菌和根际促生菌[20-21]。本实验中,P. fluorescensZX对葡萄采后灰霉病有明显的防治效果,就发病率来看,P. fluorescensZX处理后发病率仅显著低于对照组;从病斑直径看,P. fluorescensZX处理与农药抑霉唑处理的没有显著性差异;拮抗菌菌悬液处理的B. cinerea孢子萌发率显著低于对照组的萌发率,P. fluorescensZX能够明显抑制B. cinerea的孢子萌发、芽管伸长,降低葡萄采后灰霉病的发病率和病斑直径,从而有效控制葡萄采后灰霉病的发生,延缓病害速度;对比P. fluorescensZX不同处理液的作用效果,菌悬液处理的果实发病率和病斑直径都是最小的,热杀死液、滤液、原液也具有一定的防治作用,这些结果表明P. fluorescensZX可能具有产生抑菌物质的能力,但具体是什么抑菌物质还需要进一步探究。
P. fluorescensZX在葡萄果实上的生长动态结果表明,无论是接种还是浸泡处理P. fluorescensZX都能在葡萄果实上快速生长定殖,消耗营养,抢占生态位点,从而使B. cinerea无法获得足够的营养和空间从而无法进行正常的生命活动。现在普遍认为,与病原物进行营养物质与空间位点竞争是拮抗微生物防治病害最主要的作用机制之一[22-24]。而浸泡处理的P. fluorescensZX生长速度明显低于接种处理,说明P. fluorescensZX能够更快地利用果实机械伤口处的营养,这也很好解释了为什么越早接种拮抗菌生防效果越好。
采用两板对扣法使得P. fluorescensZX和B.cinerea同步培养但彼此不接触,结果表明P. fluorescensZX能够产生多种具有较强抑菌作用的VOCs,明显抑制B. cinerea的菌丝生长,产生的VOCs主要为醇、酮、醛、酸和含硫化合物。而Li等[25]发现球孢链霉菌(Streptomyces globisporus)JK-1产生的VOCs主要为二甲基二硫、二甲基三硫和苯乙酮,能够对意大利青霉(Penicillium italicum)的生长产生强烈的抑制作用。相似的,Elsherbiny等[26]发现两株木霉菌(Trichoderma spp.)产生的VOCs中,异戊醇和2-甲基-1-丙醇对马铃薯晚疫病菌(Phytophthora infestans)的菌丝扩展有较强的抑制作用,在10 μL时可完全抑制病原菌的生长。但供试菌株具体是产生哪些VOCs起主要抑菌作用,还需进一步研究。
重寄生作用是指有的拮抗菌可以在病原菌菌丝上附着定殖,通过分泌细胞壁降解酶对病原菌的细胞壁及菌丝体进行分解,达到抑制病原菌生长的作用,如Elangovan等[27]研究发现哈茨木霉(Trichoderma harzianum)能够分泌几丁质酶、β-1,3-葡聚糖酶、纤维素酶和蛋白酶,表现出对甘蔗炭疽病(Colletotrichum falcatum)的重寄生潜力。Wallace等[8]在扫描电镜下观察发现P. fluorescens可吸附于扩展青霉(P. expansum)菌丝体上,导致病原菌菌丝体严重皱缩。本实验中,在扫描电镜下观察到P. fluorescensZX能够吸附于B. cinerea菌丝体上,破坏B. cinerea菌丝形态,这也是P. fluorescensZX抑制B. cinerea的重要机制之一。拮抗菌和病原菌之间的互作效应十分复杂,P. fluorescensZX对B. cinerea是否还存在其他的作用机制以及各种机制之间是否有协同作用,还需更深入地研究。总的来说,P. fluorescensZX对于葡萄采后灰霉病具有良好的生物防治效果,能够有效减少损失,可以作为果蔬采后保鲜防腐的新选择。
4 结论
本实验研究结果表明:a.P. fluorescensZX菌悬液能够显著抑制B. cinerea的孢子萌发、芽管伸长,降低葡萄采后灰霉病的发病率和病斑直径;b. 无论是接种还是浸泡处理P. fluorescensZX都能抢占葡萄果实上营养与空间,使B. cinerea无法获得足够的营养和空间从而无法进行正常的生命活动;c.P.fluorescensZX能够产生多种具有较强抑菌作用的VOCs,明显抑制B. cinerea的菌丝生长;d.P. fluorescensZX抑制B. cinerea的重要机制之一是P.fluorescensZX能够附着在B. cinerea菌丝体上破坏菌丝形态。研究P. fluorescensZX对葡萄采后灰霉病的防治作用对提高P. fluorescensZX的生防效果奠定理论基础,同时为P. fluorescensZX在实际应用中提供理论依据。本实验研究表明P. fluorescensZX能产生抑菌作用强的VOCs,但具体是哪几种物质发挥抑菌作用还需要更深入的研究;对于P.fluorescensZX对B. cinerea产生的拮抗作用其中P. fluorescensZX的代谢通路是怎样的,有必要进一步研究。
