壁材对方竹叶黄酮微胶囊结构及抗氧化性能的影响
2021-11-14李贵华刘永翔黄毕应
黄 珊,刘 嘉,李贵华,刘永翔,3,黄毕应,李 俊,
(1.贵州省农业科学院食品加工研究所,贵州贵阳 550006;2.贵州省福泉市牛场镇人民政府,贵州黔南 550508;3.贵州省生物技术重点实验室,贵州贵阳 550006)
方竹(Chimonobambusa quadrangularis(Fenzi)Makino)是我国特有的优质笋用竹种之一,具有极高的食用价值和经济价值,广泛分布于四川省与云贵交界的大娄山区域[1]。近年来贵州大力发展竹产业,省内方竹种植面积大约20万 hm2,贵州桐梓于2014年被评为“中国方竹笋之乡”,2015年“桐梓方竹笋”获选为国家地理标志产品[2]。与竹子的根、茎等相比,竹叶的利用率很低,常被作为废弃物。竹叶中含有黄酮类、生物多糖、蒽醌类、酚酸类等多种活性物质,具有良好的应用价值[3],已在食品、医疗等领域广受关注。竹叶提取物主要抗氧化成分包括黄酮、内酯和酚酸类化合物[4],其中黄酮类化合物主要是黄酮糖苷,包括荭草苷、异荭草苷、牡荆苷和异牡荆苷等[5],研究发现植物黄酮在胃肠道消化中易被降解,会导致生物可及性及稳定性降低,这限制了其生物活性的发挥[6-7]。因此,如何保证竹叶提取物的稳定性,对竹叶黄酮的应用具有极其重要的价值。
微胶囊技术起源于上世纪三十年代,它利用天然或合成高分子材料,把气、液或固体芯材包埋起来形成一种半透性膜或密封的微小粒子[8],其中喷雾干燥法是食品工业中最常用的微胶囊化工艺,具有生产成本低、工艺简单、可包埋热敏性的物质以及适于工业化生产等优点,在包埋食品中的生物活性物质及功能性脂质方面备受青睐[9],孙亚利等[10]以热诱导的聚合乳清蛋白为壁材制备的苦荞黄酮微胶囊,品质较优,感官较佳,具有良好的贮藏稳定性和缓释性。李杨等[11]以乳清分离蛋白、大豆分离蛋白和豌豆分离蛋白分别与麦芽糊精作为复合壁材,发现大豆分离蛋白制备的鱼油微胶囊热稳定性最高。Wang等[12]利用乳清分离蛋白和卵磷脂制备出的微胶囊表现出良好的包埋率和再分散性。
目前竹叶黄酮的相关研究主要集中在抗氧化活性等方面[13-14],而对于竹叶黄酮微胶囊包埋壁材的选择及其对产品的理化性质影响研究较少。本实验采用超声辅助乙醇提取方竹叶中的黄酮,探究麦芽糊精、阿拉伯胶、明胶、大豆分离蛋白、月桂酸单甘酯等不同类型壁材对竹叶黄酮微胶囊性能的影响;探究适合竹叶黄酮微胶囊包埋的壁材,制备具有良好抗氧化活性的竹叶黄酮微胶囊,为竹叶提取物功能产品的开发提供一定的理论基础。
1 材料与方法
1.1 材料与仪器
方竹叶 由贵州省林业科学研究院提供,在60 ℃烘箱中烘干10 h,使含水量达到12.0%±0.5%,用粉碎机粉碎后过100目网筛,放于干燥器中备用;芦丁标准品(≥98%) 北京索莱宝科技有限公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2- picrylhydrazyl,DPPH)、硝酸钠、无水乙醇、亚硝酸铝、三氯化铁、铁氰化钾、磷酸二氢钠、三氯醋酸、氢氧化钠、磷酸氢二钠 均为分析纯,国药集团化学试剂有限公司;麦芽糊精、阿拉伯胶、明胶、大豆分离蛋白、月桂酸单甘酯 均为食品级,山东文兴生物科技有限公司;所用水 为超纯水。
HHS型数显恒温水浴锅 上海博迅实业有限公司医疗设备厂;UV-6000型紫外可见分光光度计上海元析仪器有限公司;G-040s型超声波清洗机深圳市歌能清洗设备有限公司;Mastersizer2000激光粒度仪 英国马尔文仪器有限公司;B-290喷雾干燥机 瑞士BÜCHI公司;S-3400N扫描电子显微镜日本日立公司。
1.2 实验方法
1.2.1 方竹叶黄酮样液的制备 采用超声辅助醇提法,依据前期预实验优化,称取粉碎后的竹叶粉20.0 g,加入1000 mL 75%(v/v)乙醇,设定超声功率为80 W,温度55 ℃,时间60 min,提取方竹叶黄酮,经旋转蒸发纯化后,获得方竹叶黄酮浓缩溶液备用。
1.2.2 方竹叶黄酮含量测定 参考李俊等[15]的方法测定样品中的总黄酮含量(mg/mL)。以芦丁标准溶液浓度为横坐标x,吸光值为纵坐标y绘制标准曲线,得回归方程为:y=1.754x-0.0051,R2=0.9991,经测定方竹叶黄酮浓缩溶液中黄酮含量为3.46 mg/mL。
1.2.3 方竹叶黄酮微胶囊的制备 准确称取一定量的壁材(麦芽糊精、阿拉伯胶、明胶、大豆分离蛋白及月桂酸单甘酯)倒入50 ℃蒸馏水溶解配成悬浮液(w/v,5%)并均质15 min,然后加入方竹叶黄酮提取液,芯壁比为1:5,再次均质10 min后进行喷雾干燥[16],即得到方竹叶黄酮微胶囊,以未经壁材包埋直接喷雾干燥得到的方竹叶黄酮微胶囊为对照组,喷雾干燥工艺参数为:进风温度180 ℃,出风温度115 ℃,进料速率15 mL/min。
1.2.4 微胶囊理化性质测定
1.2.4.1 微胶囊包埋率的测定 参考Lv等[17]的方法,并做适当的改动。总黄酮含量的测定:准确称取20 mg干燥后的微胶囊,加入200 mL 75%(v/v)乙醇,超声处理30 min,3500 r/min离心10 min,取上清液定容至25 mL,测定吸光度,根据标线计算微胶囊产品总黄酮含量。表面黄酮含量的测定:准确称取20 mg干燥后的微胶囊,加入200 mL无水乙醇,充分震荡后过滤定容至25 mL,吸取一定量溶液测定吸光度,根据标线计算微胶囊产品表面黄酮含量。微胶囊的包埋率按公式(1)计算:

式中:R代表包埋率,%;Ct代表总黄酮含量,mg/mL;Cs代表表面黄酮含量,mg/mL。
1.2.4.2 休止角测定 准确称取5 g微胶囊样品倒入漏斗,使微胶囊通过漏斗自然下落,在水平圆板上堆积。每一样品进行3次平行试验[18]。测量粉堆高度H及粉堆覆盖半径R,休止角θ按公式(2)计算:

1.2.4.3 堆积密度测定 准确称取3 g竹叶黄酮微胶囊样品倒入带有刻度的量筒中,反复振动使微胶囊粉末自然下沉,直至样品不能被压缩,计算单位体积微胶囊的质量,重复3次。
1.2.4.4 水分含量测定 参照GB/T 5009.9-2016《食品中水分含量测定》。
1.2.5 微观结构 取适量的未包埋和不同包埋壁材的微胶囊于导电胶上,于真空镀膜机中喷金后固定在样品台上,然后放入显微镜腔室中对微胶囊进行扫描,观察微胶囊固体表观形貌[19]。
1.2.6 粒径分布测定 以超纯水为分散剂,称取适量竹叶黄酮微胶囊溶解于分散剂中,通过激光粒度仪来测定粉体的粒度分布[20]。
1.2.7 抗氧化活性测定
1.2.7.1 DPPH自由基清除活性 配制79 mg/L的DPPH-乙醇溶液,低温避光保存备用。分别取未包埋和不同包埋壁材的黄酮微胶囊溶于乙醇中,黄酮质量浓度依次为200、400、600、800、1000 μg/mL。分别取0.5 mL不同质量浓度的未包埋和不同包埋壁材的黄酮微胶囊样液,加入5.0 mL的DPPH-乙醇溶液混合均匀,37 ℃反应1 h,以相应乙醇为空白,在波长为517 nm处比色,按式(3)计算DPPH自由基清除率[21]:
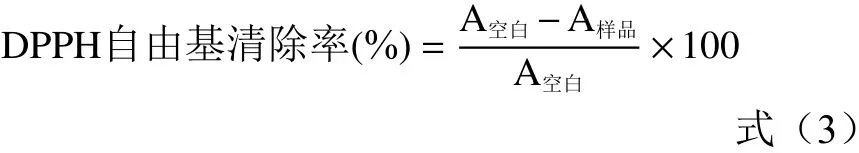
式中:A空白代表对照组吸光值;A样品代表实验组吸光值。
1.2.7.2 还原力测定 分别取未包埋和不同包埋壁材的黄酮微胶囊溶于乙醇中,使两者的黄酮质量浓度均为200、400、600、800、1000 μg/mL。取2.5 mL的磷酸缓冲液(0.2 mol/L,pH6.6)和2.5 mL铁氰化钾(w/v,1%)混匀,分别移取1 mL上述不同质量浓度的样液,加入反应体系内,摇匀后置于50 ℃水浴中20 min。流水快速冷却,然后分别加入2.5 mL三氯醋酸(w/v,10%)终止反应,3000 r/min离心10 min,离心后取2.5 mL上清液,加入到2.5 mL蒸馏水和0.5 mL三氯化铁(w/v,0.1%),摇匀后静置10 min,在波长700 nm处测定样品溶液吸光值[22]。
1.3 数据处理
采用Origin8.0软件作图,SPSS20.0数据统计软件对试验结果进行统计学分析,数据重复测定3次,结果以平均值±标准差表示。
2 结果与分析
2.1 方竹叶黄酮微胶囊的理化性质分析
微胶囊的包埋率、堆积密度、水分含量及休止角等会影响微胶囊产品的最终质量及其在销售和存储过程中的特性[23]。不同壁材方竹叶黄酮微胶囊的包埋率、堆积密度、水分含量及休止角结果如表1所示。包埋率是判断微胶囊质量的重要指标,包埋率越高,对黄酮的保护作用较好,不同壁材的微胶囊之间包埋率不同且有一定显著性差异(P<0.05),阿拉伯胶的包埋率最高,为91.23%,且与麦芽糊精(90.10%)和明胶(89.73%)之间差异不显著(P>0.05),最低为月桂酸单甘酯。相比对照组,不同壁材微胶囊的堆积密度均有所提高,且一些不同壁材之间有显著性差异(P<0.05),月桂酸单甘酯与阿拉伯胶、麦芽糊精明胶、明胶与大豆分离蛋白之间有显著差异(P<0.05),其余壁材间没有显著性差异(P>0.05),阿拉伯胶的堆积密度最大为0.53±0.01 g·cm-3,堆积密度越大表明其可储存于更小的容器中,从而可以减少粉末空隙中的空气量,有利于防止微胶囊氧化[24],由此可知,包埋技术可以显著提升微胶囊的堆积密度,减轻微胶囊的氧化,有利于稳定微胶囊的品质及保存。

表1 不同壁材制备的方竹叶黄酮微胶囊理化性质比较Table 1 Comparison of physiochemical properties of the bamboo leaves flavonoids microcapsules prepared with different wall materials
不同壁材微胶囊的水分含量都显著低于对照组(P<0.05),说明经过壁材包埋后有效降低了微胶囊中的水分含量,而较低的水分含量有利于微胶囊的储存。其中阿拉伯胶最低,为5.33%,其与大豆分离蛋白、麦芽糊精和明胶之间没有显著性差异(P>0.05),在这四者中,麦芽糊精的水分含量偏高,可能是因为麦芽糊精是公认的非常吸湿的材料,易吸收水分。在Goula等[25]的研究中也将橙汁微胶囊的高含水量归因于高浓度的麦芽糊精。微胶囊之间呈现的水分含量差异是由于材料对水的亲和力不同,以及水分通过壁材基质的扩散系数不同导致的[26]。
休止角是衡量粉末产品流动性的重要指标,一般来说,当休止角≤30°时粉末的流动性很好;休止角为30°~45°产品流动性良好;休止角45°~60°产品流动性流动性一般;而休止角≥60°则流动性差[27]。实验中,除对照组外,不同壁材的微胶囊的休止角均小45°,其中阿拉伯胶的休止角最低,说明以不同壁材制备的微胶囊粉末的流动性较好,经壁材包埋能有效的改善微胶囊粉末的流动性能,这与刘成祥[18]在研究牡丹籽油微胶囊流动性质中发现相似。综合比较以阿拉伯胶为壁材的微胶囊性能更优,能满足生产要求。
2.2 方竹叶黄酮微胶囊的微观结构分析
不同包埋壁材的微胶囊的微观结构如图1所示。从图1中可以看出不同包埋壁材处理下的微胶囊表面结构及大小存在差异,但同一包埋壁材的微胶囊颗粒大小也存在一定差异,这可能与液滴从高压喷枪中喷出时形成的液滴大小有直接关系[28]。图1a中微胶囊外部结构未呈现球形颗粒且出现大块粘连的情况,这与胶囊未进行壁材包埋处理有直接关系。图1b和图1f中微胶囊未呈现球型颗粒且表面有凹陷,可能是在干燥过程中,液滴之间出现相互碰撞、相互挤压造成,也有研究表明微胶囊表面出现的典型褶皱或凹陷现象与壁材中碳水化物的含量有关[29],特别是在冷却阶段,如果微胶囊壁材的固化要先于热气流造成的膨胀,使壁材收缩而产生凹陷或褶皱[30],图1b中微胶囊表面还有孔洞,这是由于在高喷雾干燥速率下,干燥颗粒内部空气或蒸汽的热膨胀可以平整凹痕,但也可能使囊膜破裂,导致孔洞的形成[31]。
图1 c、图1d和图1e大部分微胶囊呈球形颗粒,表面光滑平整,凹陷较少且大小均一,这很可能是因为这些碳水化合物组成的壁材体系具有更高的分子柔性,表现出更多的分子构型,导致成膜均匀[32],微胶囊致密性较好。与对照组相比,经过壁材包埋处理的微胶囊在结构形态上更加稳定,这对于芯材的保护和避免氧化,提高微胶囊稳定性至关重要。综上所述,阿拉伯胶、麦芽糊精及明胶制备的方竹叶黄酮微胶囊呈球形颗粒,表面光滑平整,凹陷较少且大小均一,在表观更加出色。

图1 不同壁材制备的方竹叶黄酮微胶囊的表面形态Fig.1 Outer morphology of the bamboo leaves flavonoids microcapsules prepared with different wall materials
2.3 方竹叶黄酮微胶囊的粒径分析
粒径是评价微胶囊体系质量的一个重要参数,粒径小的微胶囊更有易于被人体吸收[33]。不同包埋壁材处理下的微胶囊平均粒径和粒度分布图见图2。由图2可知,阿拉伯胶包埋体系粒径分布呈现正态分布,其制备的竹叶黄酮微胶囊的粒径分布均匀且集中,而对照组微胶囊粒径呈现双峰分布,双峰跨度较小,麦芽糊精、明胶、月桂酸单甘酯及大豆分离蛋白包埋体系呈现双峰分布且双峰跨度较大,粒径分布不集中。粒径分布曲线中具有单峰分布以及峰较窄或峰下面积较小的包埋体系,表示微胶囊粒径均匀且稳定[34],可知阿拉伯胶显示出良好的包埋能力以形成细小的微胶囊。
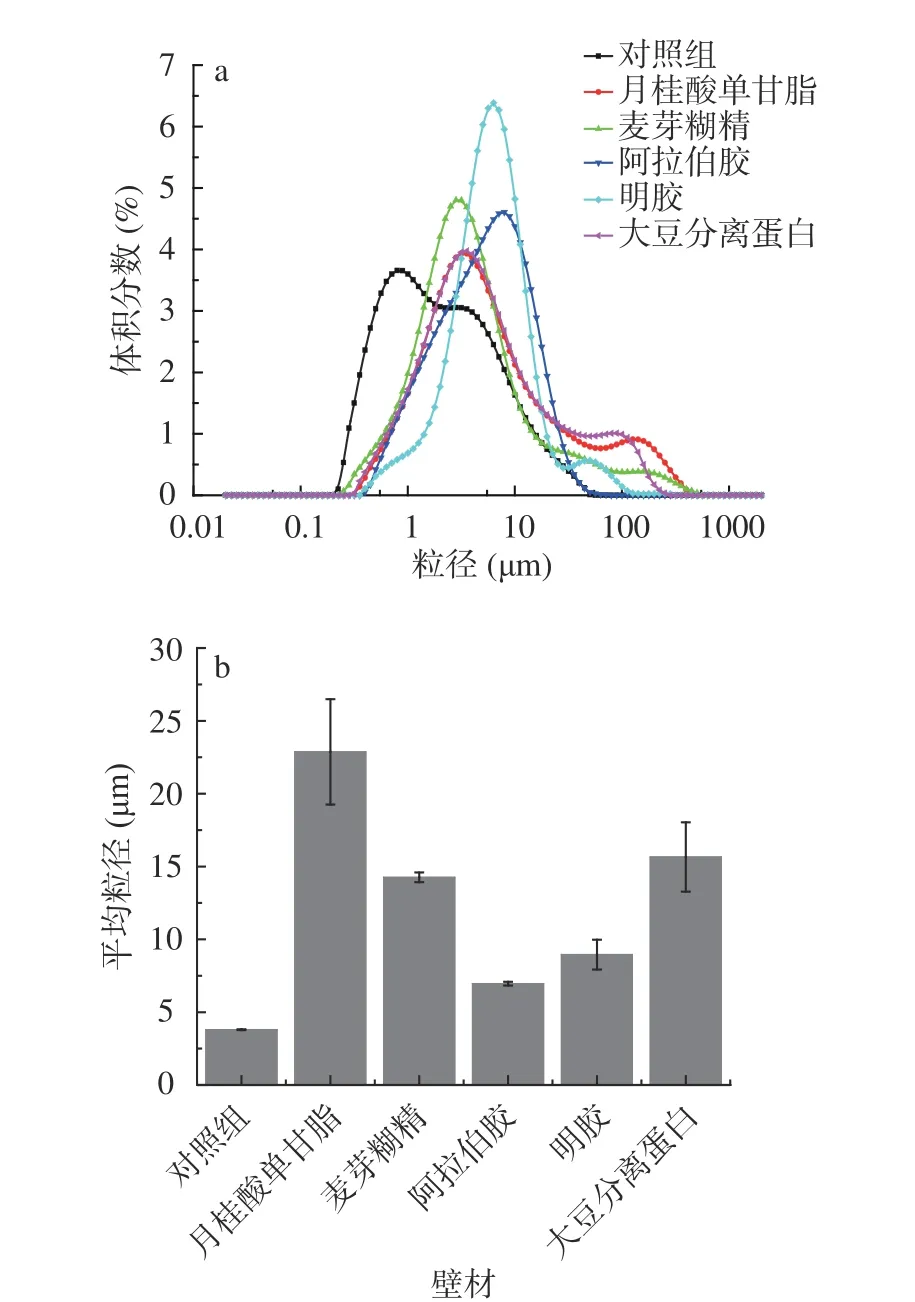
图2 不同壁材对方竹叶黄酮微胶囊平均粒径和粒度分布的影响Fig.2 Effects of different wall materials on mean particle size and particle size distribution of the bamboo leaves flavonoids microcapsules
微胶囊平均粒径大小依次为月桂酸单甘酯(22.87 μm)>大豆分离蛋白(15.65 μm)>麦芽糊精(14.26 μm)>明胶(8.95 μm)>阿拉伯胶(6.96 μm)>对照组(3.80 μm),由此可知经过包埋后微胶囊的粒径显著提升,不同处理下微胶囊的粒径产生较大差异,其可能是由于制备过程中水分瞬间蒸发的速率不同导致颗粒产生不同的收缩力度,从而得到不同粒径的微胶囊[35];在同等实验条件下,阿拉伯胶制备的微胶囊平均粒径低且包埋体系粒径分布呈现正态分布,是理想的包埋壁材。
2.4 方竹叶黄酮微胶囊抗氧化活性及还原性分析
2.4.1 方竹叶黄酮微胶囊抗氧化活性分析 如图3所示,未经包埋的对照组以及不同包埋壁材处理下的微胶囊清除DPPH自由基能力都展现出与剂量成正相关,随着质量分数浓度的增加抗氧化能力不断增强。麦芽糊精包埋处理下的微胶囊清除DPPH自由基的能力最高,经计算如表2所示,其清除DPPH自由基的IC50为258.67 μg/mL,对照组IC50为681.83 μg/mL,月桂酸单甘酯IC50为532.80 μg/mL,阿拉伯胶IC50为364.30 μg/mL,明胶IC50为446.53 μg/mL,大豆分离蛋白IC50为518.83 μg/mL,IC50值越小证明微胶囊抗氧化性能力越强,则微胶囊清除DPPH自由基的能力依次为麦芽糊精>阿拉伯胶>明胶>大豆分离蛋白>月桂酸单甘酯>对照组,经过包埋处理的微胶囊清除DPPH自由基能力明显高于未经包埋的对照组,可能是因为经包埋的微胶囊,黄酮抗氧化物质进入包埋空腔内,使客体分子稳定性增加,更易与DPPH中的自由基反应[36]。而不同包埋壁材处理下的微胶囊清除DPPH自由基能力也有所差异,可能是由于不同壁材的本身特性所决定的;还有可能是因为不同壁材包埋形成的微胶囊颗粒的表面积不同,而与反应溶液接触不同所致[21,37]。
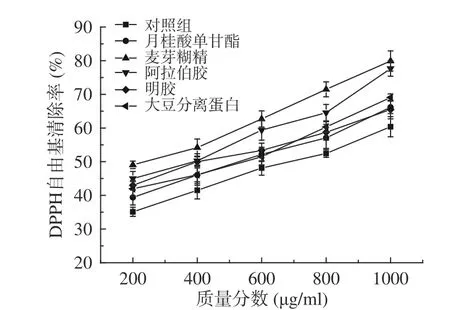
图3 不同壁材制备的方竹叶黄酮微胶囊DPPH自由基清除能力对比Fig.3 Comparison of DPPH free radical scavenging activities of the bamboo leaves flavonoids microcapsules prepared with different wall materials
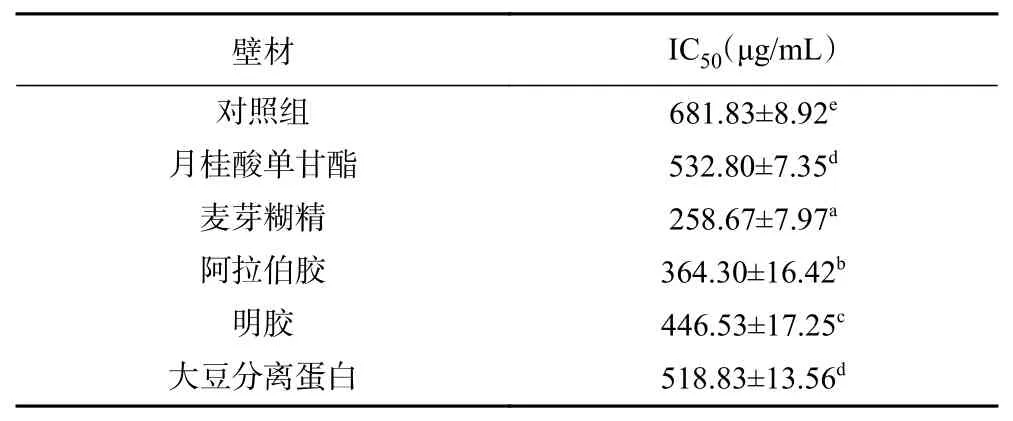
表2 不同壁材制备的方竹叶黄酮微胶囊的抗氧化活性(IC50)Table 2 Antioxidant activity(IC50) of the bamboo leaves flavonoids microcapsules prepared with different wall materials
2.4.2 方竹叶黄酮微胶囊还原能力分析 由图4可知,不同包埋壁材微胶囊铁还原力也同样随着质量浓度的增加而增强,呈现出明显的剂量正效应关系,且经过包埋处理的微胶囊铁还原力明显高于未经包埋的对照组,质量浓度为200 μg/mL时,微胶囊铁还原力依次为阿拉伯胶(0.496)>麦芽糊精(0.457)>大豆分离蛋白(0.411)>月桂酸单甘酯(0.375)>明胶(0.365)>对照组(0.264);质量浓度为800 μg/mL时,微胶囊铁还原力依次为麦芽糊精(0.936)>阿拉伯胶(0.918)>明胶(0.907)>大豆分离蛋白(0.829)>月桂酸单甘酯(0.738)>对照组(0.603),麦芽糊精及阿拉伯胶包埋竹叶黄酮微胶囊Fe3+还原力能力稳定。
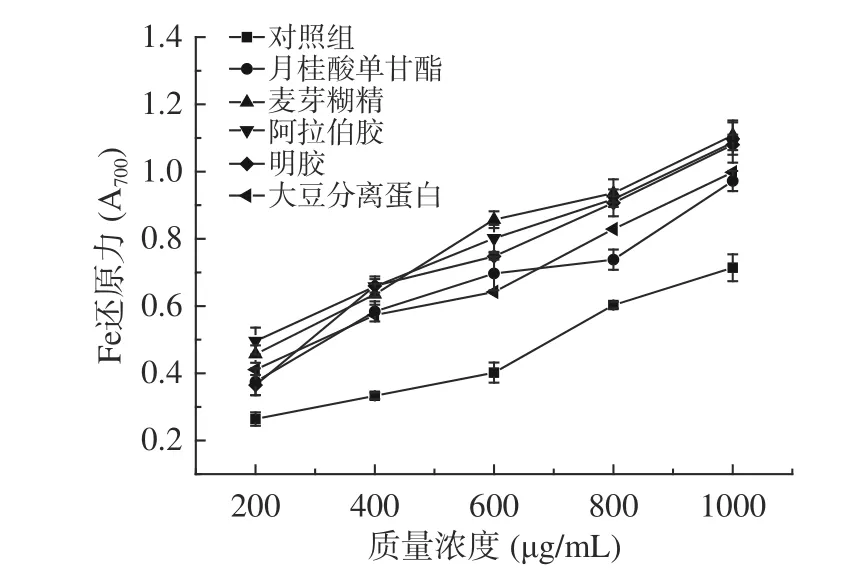
图4 方竹叶黄酮微胶囊还原能力对比Fig.4 Comparison of iron reduction capacity of the bamboo leaves flavonoids microcapsules
综上可知,麦芽糊精及阿拉伯胶制备的微胶囊产品DPPH自由基清除能力和Fe3+还原力强,都有较好的抗氧化活性及还原性。体外抗氧化实验结果表明,在喷雾干燥法中利用不同包埋壁材制备的竹叶黄酮微胶囊性能稳定性均优于未包埋处理组,证明包埋可以有效提高微胶囊体外抗氧化活性,提高了竹叶黄酮微胶囊产品的贮存稳定性。
3 结论
本实验通过对比分析5种不同壁材制备的方竹叶黄酮微胶囊产品包埋效果及性能的差异,结果发现,与对照组相比,经过壁材包埋处理的微胶囊在结构形态上更加稳定,物理性质得到改善,有效提高微胶囊体外抗氧化活性和还原能力,以及产品的贮存稳定性。以阿拉伯胶为壁材的微胶囊产品包埋效果好,其包埋率、堆积密度、休止角、含水量分别为91.23%±1.00%、0.53±0.01 g/cm3、33.27°±1.20°、5.33%±0.28%,并具有良好的流动性及储存性能,平均粒径最小,为6.96 μm,扫描电镜结果显示微胶囊呈球形且表面较为完整光滑,凹陷较少且大小均一,无不良感官性状,在体外抗氧化活性及还原性实验中,阿拉伯胶制备的微胶囊抗氧化活性及还原性较高。在此芯壁比条件下,阿拉伯胶可以作为制备方竹叶黄酮微胶囊的较佳壁材。
