PD-1/PD-L1 抑制剂致骨髓抑制不良反应文献分析
2021-11-14刘欣,吴楠*,王玥
刘 欣,吴 楠*,王 玥
1 江苏省肿瘤医院&江苏省肿瘤防治研究所&南京医科大学附属肿瘤医院,南京 210009;2 南京医科大学,南京210029
在肿瘤生长环境中,肿瘤细胞能够表达PD-L1 或PDL1,通过与T 细胞膜上的PD-1 受体蛋白联接,使肿瘤细胞不能被T 细胞发现而逃逸免疫监视和免疫清除作用,促进肿瘤的生长[1]。作用于PD-1 或PD-L1 的免疫检查点抑制剂通过阻断肿瘤免疫逃逸,在非小细胞肺癌(NSCLC)、黑色素瘤(MM)、肾细胞癌(RCC)、头颈部鳞状细胞癌(HNSCC)等多种肿瘤的治疗中已显示出显著疗效[2]。目前国内已有纳武利尤单抗(nivolumab)、帕博利珠单抗(pembrolizumab)、特瑞普利单抗(toripalimab)、信迪利单抗注射液(sintilimab)、卡瑞利珠单抗(camrelizumab)、度伐利尤单抗(durvalumab)和阿替利珠单抗(atezolizumab)共7 个抗癌药品应用于临床。从已有的临床研究报道看,PD-1/PD-L1 抑制剂引起的药物不良反应以皮疹、疲劳、腹泻最为常见[3]。值得注意是,PD-1/PD-L1 抑制剂引起严重骨髓抑制甚至引起患者死亡的案例已有报道[4]。本文通过系统检索相关的个案报道,分析其发生特点,以期为该类药物在临床肿瘤治疗中的安全、合理使用提供参考。
1 资料与方法
1.1 资料来源
检索PubMed 数据库、中国知网(CNKI)、万方医学数据库和维普期刊数据库自建库至2020 年3 月收载的关于PD-1/PD-L1 抑制剂引起骨髓抑制的全部文献。中文检索词包括:程序性死亡受体1;程序性死亡受体配体1;程序性细胞死亡蛋白-1;免疫检查点抑制剂;纳武尤利单抗;帕博利珠单抗;特瑞普利单抗;信迪利单抗;卡瑞利珠单抗;度伐利尤单抗;阿替利珠单抗;骨髓抑制;血小板减少;血细胞下降;白细胞减少;粒细胞减少。英文检索词包括:PD-1;PDL1;Nivolumab;Opdivo;Pembrolizumab;Keytruda;Toripalimab;JS001、Sintilimab;IBI308;Camrelizumab;Durvalumab;Imfinzi;Atezolizumab;Tecentriq;Thrombocytopenia;Myelosuppression;WBC;Neutrophil granulocyte;Granulocytopenia。
1.2 方法
采用回顾性研究方法,提取纳入文献中与PD-1/PD-L1抑制剂引起骨髓抑制相关的信息,包括患者年龄、性别、肿瘤诊断、用药品种、用法用量、不良反应发生时间、临床表现、处理与转归等,提取相关信息进行统计和描述性分析。
纳入标准:PD-1/PD-L1 抑制剂引起骨髓抑制的个案报道。
剔除标准:①综述文献;②基础研究文献;③重复病例文献;④信息不全的个案报道;⑤未公开发表的毕业论文、会议论文。
回顾性统计案例中患者性别、年龄、疾病诊断、用药情况、不良反应发生时间、临床表现、处理与转归等信息,进行描述性分析。根据WHO 对骨髓抑制程度0~Ⅳ的分级定义,对骨髓抑制严重程度进行分级。使用Excel(2007 版)软件进行数据统计分析。
2 结果
共检索到相关文献55 篇,其中中文3 篇,英文52 篇,按照入选标准、剔除标准筛选后,最终纳入20 篇(22 例)个案报道。
使用JBI 循证病例报告质量评价工具[5]对纳入的20 篇(22 例)个案报道质量进行评价。20 篇(22 例)个案报道评价条目均较完整,仅有7 例个案报道中未提及PD-1/PD-L1 抑制剂的用法用量。
2.1 年龄、性别分布
在22 例PD-1/PD-L1 致骨髓抑制不良反应患者中,男性14 例(占63.6%),女性8 例(占36.4%),51~80 岁年龄段的患者占比80%以上,其中51~60、61~70、71~80 年龄段各占27.3%(6/22)。
2.2 原发疾病情况
在22 例患者中,原发疾病为肺癌的患者10 例占比最多(45.6%),包括非小细胞肺癌6 例、肺腺癌2 例、小细胞肺癌2例。原发疾病为黑色素瘤的患者8 例,占比(36.4%)次之。
2.3 用药情况
在22 例患者中,均使用了nivolumab 或pembrolizumab治疗。根据药品说明书推荐,nivolumab 常规剂量为3 mg·kg-1/3 周,pembrolizumab 常规剂量为2 mg·kg-1/3 周。22 例发生骨髓抑制的患者,其药品用法用量均符合该药品说明书规定,无超说明书使用情况。
使用PD-1 或PD-L1 抑制剂单药治疗17 例,占比达77.3%,提示该类药物单独使用时即有可能影响骨髓造血功能。nivolumab 与ipilimumab 联合使用时,骨髓抑制的发生病例数较与pembrolizumab 联合使用时稍多,可能与纳入的病例数较少有关。见表1。

表1 PD-1/PD-L1 抑制剂引起骨髓抑制患者用药情况
2.4 不良反应关联性评价结果
参照《药品不良反应报告和监测管理办法》要求[6],评价22 例个案中不良反应的严重程度及与PD-1/PD-L1 用药的相关性。其中11 例(占50%)评价结果为“肯定”;7 例(占31.82%)评价为“很可能”;3 例(占13.64%)评价为“可能”;1例(占4.55%)评价为“可能无关”。
2.5 骨髓抑制发生时间
在22 例患者中,使用PD-1/PD-L1 抑制剂1 周期后即发生骨髓抑制的病例最多(10 例,占45.45%),其余患者用药2~18 周期后发生骨髓抑制。PD-1/PD-L1 抑制剂用药后首次出现骨髓抑制的时间最短为2 天,最长接近400 天,其中首次用药后8 周内发生的比例稍高(占63.65%)。有19 例记录了骨髓抑制最低值出现的时间,其中6 例(占31.58%)发生在使用PD-1/PD-L1 抑制剂1 周期后。见表2。

表2 PD-1/PD-L1 抑制剂引起骨髓抑制发生时间
2.6 骨髓抑制严重程度
参考WHO 骨髓抑制分级0~Ⅳ标准,将案例中患者发生骨髓抑制最严重时期的全血细胞数进行统计归类并记录级别,其中I~IV 级分别为0,2(9.1%),3(13.7%),17 例(77.3%)。
2.7 骨髓抑制的临床表现
在22 例骨髓抑制患者中,16 例表现为血小板减少症(占72.73%),2 例表现为全血细胞减少症(占9.09%),2 例表现为红细胞减少症(占9.09%),1 例表现为血小板减少症合并红细胞减少症(占4.55%),1 例表现为血小板减少合并中性粒细胞减少症(占4.55%)。
2.8 骨髓抑制的处理及转归
在22 例患者中出现骨髓抑制后,20 例使用了糖皮质激素治疗(占90.91%),10 例给予了血液成分输注或具有促进血细胞生成功能的药物如艾曲波帕(占45.45%),6 例给予了免疫球蛋白(占27.27%),1 例预防性给予抗菌药物及抗病毒药物(占4.55%)。经过对症治疗,13 例血细胞计数恢复正常(占54.55%),4 例血细胞计数好转(占18.18%),2 例未见好转(占9.09%),1 例出现爆发性紫癜后下肢截肢(占9.09%)。死亡病例共8 例,其中骨髓抑制发生在使用PD-1/PD-L1 抑制剂1 周期后5 例(占死亡病例的62.5%)。死亡原因与骨髓抑制直接相关的3 例(占13.63%),均为骨髓抑制发生在使用PD-1/PD-L1 抑制剂1 周期后的病例。见表3。

表3 PD-1/PD-L1 抑制剂引起骨髓抑制的发生时间、处理及转归
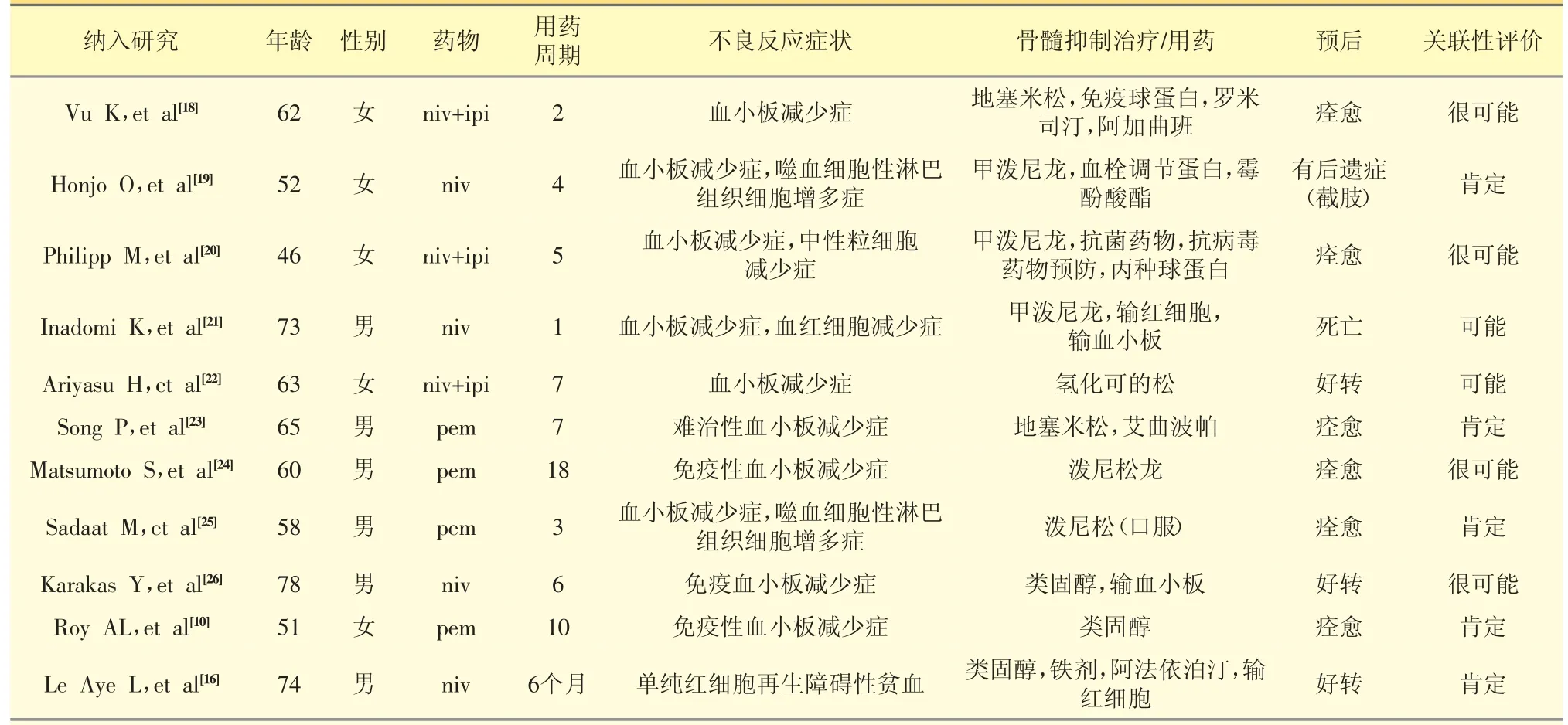
续表3 PD-1/PD-L1 抑制剂引起骨髓抑制的发生时间、处理及转归
3 讨论
通常认为PD-1/PD-L1 抑制剂引起的不良反应的原因可能是药物导致了免疫耐受的不平衡,形成不必要的免疫应答,引起正常组织或者器官的损伤。骨髓抑制是肿瘤患者治疗过程中常见的不良反应,表现为白细胞减少、血小板减少、中性粒细胞减少等,约80%患者在放化疗过程中会出现骨髓抑制[27]。相比之下,不同文献报道的PD-1/PD-L1 抑制剂引起的骨髓抑制发生率仅4.2~5.1%[28]。因此,虽然骨髓抑制是PD-1/PD-L1 抑制剂已知的不良反应,在目前已经上市的该类药品说明书中,均有引起不同类型及程度骨髓抑制反应的相关记载;但相对于发生率较高的疲劳、瘙痒、腹泻、皮疹、恶心等不良反应,临床对其认识还相对较少[29]。
本研究纳入的20 篇文献共22 例由PD-1/PD-L1 抑制剂引起骨髓抑制个案看,该类药物亦可引起严重的骨髓抑制,甚至导致患者死亡[7,13,21]。用药期间应密切监测患者血常规指标及有无出血倾向和体征,如牙龈出血、瘀斑、血尿等症状。如排除其他病因及合并用药因素,则应考虑PD-1/PD-L1引起的骨髓抑制,根据骨髓抑制的分级,可采取暂停用药、对症支持治疗、糖皮质激素类药物治疗甚至永久停药等措施。结合本研究结果,还应注意对某些特殊人群如老年患者、联合用药等加强监测。
在22 例个案中,年龄在51~80 岁的中老年患者占比最高。中老年人合并基础疾病及组织器官生理功能下降情况较为常见。在肿瘤化疗引起的中性粒细胞减少症中,肝、肾功能损伤以及年龄>65 岁者接受足剂量的化疗均为已知的风险因素[30]。建议在临床使用PD-1/PD-L1 治疗时,注意结合患者年龄、基础疾病等加强对血常规指标的监测。
本文调查的使用PD-1/PD-L1 抑制剂单药治疗占77.3%,与Davis EJ[31]报道的55 例PD-1/PD-L1 抑制剂导致的自身免疫性溶血性贫血的案例中使用PD-1/PD-L1 抑制剂单药者占43 例(占78.2%)的结果相近。说明该类药物单独使用时即可影响骨髓造血功能。
在22 例个案中,半数患者在首次接受PD-1/PD-L1 治疗后即出现了骨髓抑制,提示该类药物骨髓毒性与累积剂量相关性较小。与化疗或放疗引起骨髓抑制的时间(1~3 周)不同。本研究中,22 例患者出现骨髓抑制的时间较为分散,从用药后1 周内至1 年以上均有可能出现血细胞下降、血小板或白细胞减少等症状,并且不乏出现严重骨髓抑制甚至导致患者死亡的案例。提示临床对于正在使用PD-1/PD-L1 抑制剂治疗的患者,以及既往曾经使用过该类药物治疗的患者,都应该注意监测骨髓抑制的发生情况。
在22 例个例中,20 例均有血小板减少的表现,其中10例明确诊断为免疫性血小板减少,在2 篇纳入的文献中,对患者进行骨髓穿刺显示血小板抗体的存在。免疫治疗引起血小板减少症可以产生不良预后,一旦发现应及早作激素处理。根据CSCO 指南推荐,免疫性血小板减少的药物治疗可予以泼尼松1~2 mg·kg-1·d-1口服,如果无缓解或者恶化,继续使用泼尼松,并联合静脉输注免疫球蛋白1 g·kg-1,并根据需要重复使用;也可考虑使用抗CD20 单抗利妥昔单抗、血小板生成素受体激动剂艾曲波帕[32]。
在本研究中,大部分患者在骨髓抑制后使用糖皮质激素为基础的药物治疗有效;但也有3 例对激素治疗效果不佳。针对激素效果差者,有学者建议宜早期考虑使用血小板生成素受体激动剂艾曲波帕、抗CD20 单抗利妥昔单抗等药物[33]。
鉴于该类药物进入临床时间相对较短,其引起骨髓抑制的机制、发生率、相关因素及治疗等尚值得进一步观察研究。临床在使用该类药物时,除了常见的皮疹、免疫性肺炎等不良反应外,也应注重骨髓抑制的监测及处理。
