苦参碱对HCCLM3 人高转移性肝癌细胞体外转移的作用及机制研究
2021-11-14汪瑞辰周宋汇
席 昱,汪瑞辰,周宋汇
江苏省肿瘤医院,江苏省肿瘤防治研究所,南京医科大学附属肿瘤医院,南京210009
随着生活环境和饮食习惯的改变,恶性肿瘤的发病率逐年增高,尽管诊疗策略和临床技术的不断提高,但是恶性肿瘤转移依然是致死的主要因素[1]。肝癌是一种常见的恶性肿瘤,其致死人数仅次于肺癌,严重影响了人们的生命健康安全[2]。目前,尽管对于早期肝癌可以通过手术切除、辅以全身化疗的策略以提高患者生存期;但是,在肝癌的诊断过程中,早期肝癌的诊断率极低,同时肝癌细胞又具极强的转移能力,很多患者在确诊时已经处于肝癌的中晚期并伴随着肝癌细胞的转移,大大缩短了患者的生存期。目前靶向制剂索拉菲尼依然是转移性肝癌治疗的一线用药[3],尽管其在一定程度上提高了转移性肝癌患者的总体生存质量;但是索拉菲尼存在厌食、疲劳以及消化道方面的不良反应,严重影响了药物治疗的有效性,导致治疗的失败。因此,研发高效、低毒、价廉的抗肝癌转移药物是当前肝癌治疗的难点和重点。
当前研究表明,肿瘤细胞发生上皮间质转化(Epithelial-mesenchymal transition,EMT)是肝癌细胞发生转移的主要方式[4],在EMT 过程中,肿瘤细胞由上皮样转变成为间质样,细胞的运动能力、侵袭和转移能力显著增加。同时,在癌细胞发生转移的过程中需要分泌较多的细胞外基质金属蛋白酶(Matrix Metalloprotinase,MMP),以降解坚硬的细胞外基质,实现癌细胞远处转移和侵袭,其中MMP-2 和MMP-9 是要降解细胞外基质的蛋白酶[5,6],因而也是肿瘤转移过程中的重要靶标。
苦参碱是中药苦参中的主要活性成分,研究已经表明其具有一定的抗病毒和抗多种肿瘤的药理学特性[7]。基于此,本研究利用HCCLM3 人高转移性的肝癌细胞,探求苦参碱体外抗肝癌细胞转移的作用及机制,以期为药物研究和临床治疗提供实验依据。
1 实验材料
1.1 细胞株
人肝癌高转移细胞株HCCLM3,购自于武汉Procell 生命科技有限公司。该癌细胞培养于含10%胎牛血清的DMEM 培养基中。
1.2 药品与试剂
苦参碱(纯度≥98%,批号:M109843)购自阿拉丁试剂(上海)公司;DMEM 培养基(批号:20200418)购自江苏凯基生物公司;胎牛血清(批号:H2319)购自美国Hyclone;Matrigel 基底胶(批号:6439228)购自美国BD 公司;瑞氏-吉姆萨染色液(批号:205347)购自武汉塞维尔生物科技公司;E-cadherin(E-钙粘蛋白,20874-1-AP)、N-cadherin(N-钙粘蛋白,22018-1-AP)、Vimentin(波形蛋白,10366-1-AP)蛋白一抗、蛋白二抗均购自于武汉Proteintech生物技术公司;MMP -2(ab97779),MMP -9(ab228402)蛋白一抗均购自美国Abcam 公司;其余试剂均为分析纯。
1.3 实验仪器
分析天平,BSA224S 型,购自德国赛多利斯公司;多功能酶标仪,型号Multiskan Fc,购自美国Thermo 公司;蛋白凝胶成像系统,型号GelDoc 2000,购自美国Bio-RAD 公司;倒置显微镜,型号Axio Observer,购自德国Zeiss 公司。
2 实验方法
2.1 CCK-8 细胞增殖实验检测苦参碱对HCCLM3 癌细胞增殖的影响
取对数生长期的HCCLM3 癌细胞,经胰酶消化后,细胞培养基重悬细胞计数加入96 孔细胞培养板中,每孔的细胞数为1×104个,加入200 μL 的完全培养基培养过夜,使细胞贴壁。弃去培养基,分别加入预先配制好的0、4、8、16、32、64、128 mg·mL-1的苦参碱含药培养基于设定的细胞孔中,每个剂量组设置6个复孔,继续培养24 和48 h。待药物作用完毕,小心吸去培养基,重新更换新的培养基后每个细胞孔中加入10 μL 的CCK-8 溶液,充分混匀,继续将细胞培养板置于37 ℃培养箱中继续孵育2 h。待培养板孵育结束后,取出培养板置于酶标仪中检测450 nm 波长处的吸光度值A450。计算细胞增殖抑制率。
抑制率(%)=(1-A药物组/A对照组)×100%。
2.2 细胞划痕检测苦参碱对HCCLM3 癌细胞迁移的影响
取对数生长期的HCCLM3 癌细胞,经胰酶消化,培养基重悬后接种于6 孔细胞培养板中,每孔接种的细胞数量为4×105个。将细胞培养板置于37℃培养箱中培养24 h,Marker 笔进行标记后,采用白色10 μL 移液器枪头沿孔板中线进行垂直划痕,PBS 洗涤两次后置于显微镜下观察,分设4 组:苦参碱0、4、8、16 mg·mL-1组,每组设置6 个复孔,分别加入2 mL 含有药物的新鲜培养基继续置于37 ℃培养箱中培养。培养24 h 后于显微镜下观察,并进行拍照(×100 倍)。
细胞迁移率(%)=(划痕宽度1~24h/划痕宽度0h 时间点)×100%。
2.3 Transwell 小室检测苦参碱对HCCLM3 癌细胞侵袭的影响
于实验前一天在Transwell 小室的上室,采用培养基4 倍稀释的Matrigel 胶,均匀铺被完成后将整个小室置于37 ℃培养箱中培养过夜,使该胶充分凝固。将5×103个HCCLM3 癌细胞种植于上室,上室的培养体系为100 μL 的含药培养基。实验分设4组:苦参碱0、4、8、16 mg·mL-1组,每组设置6 个平行复孔。Transwell 小室下室加入含有20%小牛血清的完全培养基,将整个小室置于37 ℃培养箱中继续培养24 h。待药物作用结束后,采用棉签轻轻将未侵袭的细胞刮去,以PBS 洗涤2 次,4%多聚甲醛充分固定15 min,PBS 洗去固定液,参照瑞氏吉姆萨染色液实验方法进行染色后,将上室底部的膜剪下贴于载玻片上,显微镜下随机选取5 个视野进行拍照,计数视野的平均的侵袭细胞数量。
2.4 RT-PCR 检测HCCLM3 癌细胞E-cadherin、N-cadherin、Vimentin、MMP-2 和MMP-9基因mRNA 的表达
取对数生长期的HCCLM3 癌细胞,经胰酶消化后进行计数,接种于6 孔细胞培养板中,每孔接种数量为2×105个,接种完毕后补充培养基,调整整个培养体系为2 mL,细胞培养过夜,待细胞完全贴壁后小心吸去培养基,实验分设4 组:苦参碱0、4、8、16 mg·mL-1组,每组设置6 个复孔,加入相应的含药培养基,待药物作用24 h 后,小心弃去培养基,采用无菌PBS 清洗细胞孔3 遍,加入Trizol 充分提取细胞中的全部RNA,采用Nanodrop 计算RNA 含量,以500 ng 总RNA 为模板,参照逆转录试剂盒进行逆转录为相应的cDNA,加入cDNA 和相应的扩增试剂,置于实时定量PCR 仪中进行RT-PCR 检测。以GAPDH 作为内参基因,实验结果以2-△△Ct法计算基因的相对表达量。实验所用引物由上海生工生物公司进行合成,引物序列如下:
E-cadherin:F:5’-ACTACCTTGCCCTGCTAAT-3’;R:5’ -TCTACGCTATCTGGGACTACTT -3’;N -cadherin:F:5’ -GTGCGATTAGCCAATTCAGC -3’;R:5’-GCACTCGAATCCCTAGGAGG-3’;Vimentin:F:F:5’-CGCTTCGCCAACTACAAATC;R:5’-AGCCCATCCACTTCTTACAG-3’;MMP-2:F:5’-ATCAACCAACCTTGACCAA-3’;R:5’-TCAGAGACCGACCCTACAA -3’;MMP -9:F:5’ -GACTCGGTCTTTGAGGAGCC-3’;R:5’-GAACTCACGCGCCAGTAGAA-3’;GAPDH:F:5’-GTCGCCAGCCGAGCCACATC-3’;R:5’-CCAGGCGCCCAATACGACCA-3’。
2.5 Western Blot 法检测HCCLM3 癌细胞Ecadherin、N-cadherin、Vimentin、MMP-2 和MMP-9蛋白表达
取对数生长期的HCCLM3 癌细胞,经胰酶消化后进行计数,接种于6 孔细胞培养板中,每孔接种2×105个,然后补充培养基,调整整个培养体系为2 mL,细胞培养过夜,待细胞完全贴壁后小心吸去培养基,实验分设4 组:苦参碱0、4、8、16 mg·mL-1组,加入相应的含药培养基,待药物作用24 h 后弃去培养基,采用无菌PBS 清洗细胞孔3 遍,胰酶消化收集全部癌细胞,加入细胞蛋白裂解液后超声破碎细胞,充分使细胞裂解提取全部蛋白,采用NanoDrop仪器检测蛋白含量,将蛋白样品与上样缓冲液按比例充分混匀后制备蛋白样品,制备完毕后按照每孔50 μg 进行上样,并进行SDS-PAGE 蛋白凝胶电泳。然后作蛋白转膜,PVDF 膜经脱脂奶粉封闭后,加入蛋白一抗置于4 ℃冰箱中过夜孵育。第二天吸去蛋白一抗,洗膜后加入蛋白二抗,室温孵育1.5 h,TBST充分洗膜,将膜置于凝胶成像系统中进行曝光拍照,使用ImageJ 软件对条带进行灰度分析。以苦参碱0 mg·mL-1组目标蛋白灰度值计算蛋白相对表达量。
2.6 统计学方法
采用SPSS 20.0 软件进行统计并作单因素方差分析,采用Student-Newman-Keuls post hoc 检验作组间比较,以P<0.05 为差异具有统计学意义。实验图片采用Graph Pad 5.0 进行作图。
3 结果
3.1 苦参碱对HCCLM3 癌细胞增殖的影响
细胞增殖CCK-8 实验结果显示,苦参碱在32、64、128mg·mL-1剂量下,对HCCLM3 癌细胞增殖有明显抑制作用,且与对照组相比差异具有统计学意义(P<0.01)。而在苦参碱4、8、16 mg·mL-1剂量下对HCCLM3 癌细胞的增殖并不产生抑制作用(P>0.05),见图1。基于这一实验结果,选取4、8、16 mg·mL-1剂量用于苦参碱对HCCLM3 癌细胞迁移侵袭的作用及机制研究。
3.2 苦参碱对HCCLM3 癌细胞迁移的影响
鉴于HCCLM3 癌细胞的迁移能力较强,实验均考察药物作用24h 的迁移和侵袭能力。细胞划痕实验结果显示,苦参碱4、8、16mg·mL-1剂量能够明显减少HCCLM3 细胞的迁移距离并呈现出一定剂量依赖性,且与对照组相比差异具有统计学意义(P<0.05),见图2。
实验结果表明,苦参碱具有较强的抑制HCCLM3癌细胞的迁移能力,进一步采用transwell 实验对其侵袭作用进行研究。
3.3 苦参碱对HCCLM3 癌细胞侵袭的影响
Transwell 小室实验结果显示,在苦参碱4、8、16 mg·mL-1剂量下,HCCLM3 癌细胞侵袭数量明显减少并具有一定剂量依赖性,且与对照组相比差异具有统计学意义(P<0.05),见图3。结果表明,苦参碱能够抑制HCCLM3 癌细胞的侵袭。

图3 苦参碱对HCCLM3 癌细胞Transwell 小室侵袭的影响(,n=6)
3.4 苦参碱对HCCLM3 癌细胞E-cadherin、Ncadherin、Vimentin、MMP-2 和MMP-9 基因mRNA表达的影响
有关研究表明,癌细胞的EMT 是其侵袭和转移的重要过程[8],与此同时癌细胞为穿透坚硬的细胞外基质还需分泌MMP-2、MMP-9 等多种基质蛋白酶,实现细胞外基质的降解,促进发生EMT 的肿瘤细胞转移。对此采用RT-PCR 对肿瘤细胞EMT 过程中的 E -cadherin、N -cadherin、Vimentin 以 及MMP-2、MMP-9 因子mRNA 的表达水平进行检测。RT-PCR 实验结果显示,在苦参碱8、16 mg·mL-1剂量下,能够明显降低HCCLM3 癌细胞中N-cadherin、Vimentin 以 及MMP-2、MMP-9 因 子mRNA水平,并升高E-cadherin mRNA 水平,且与对照组相比差异具有统计学意义(P<0.05),见图4。
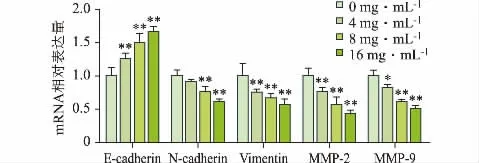
图4 苦参碱对HCCLM3 癌细胞E-cadhein、N-cadherin、Vimentin、MMP-2 和MMP-9 mRNA 表达的影响(,n=6)
3.5 苦参碱对HCCLM3 癌细胞E-cadherin、Ncadherin、Vimentin、MMP-2 和MMP-9 蛋白表达的影响
采用Western Blot 实验对癌细胞中的转移相关的蛋白水平进行检测,结果表明,苦参碱在4、8、16 mg·mL-1剂量下能明显降低HCCLM3 癌细胞中Ncadherin、Vimentin 以及MMP-2、MMP-9 蛋白水平,并升高E-cadherin 蛋白的水平,且与对照组相比差异具有统计学意义(P<0.05),见图5。实验表明,苦参碱可能通过抑制EMT 过程关键蛋白及MMP-2、MMP-9蛋白发挥抗HCCLM3 癌细胞转移和侵袭作用。
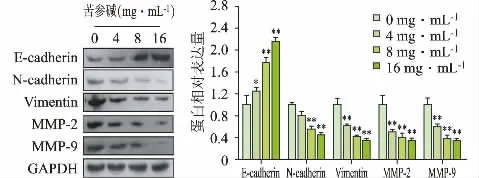
图5 苦参碱对HCCLM3 癌细胞E-cadherin、N-cadherin、Vimentin、MMP-2 和MMP-9 蛋白表达的影响(,n=3)
4 讨论
苦参碱是中药苦参的主要活性成分,当前临床已经开发出苦参碱注射液用于肝炎的治疗[9],同时实验研究已表明,苦参碱注射液具有良好的抗肿瘤效应,与化疗药物联合应用治疗结直肠癌能够提高化疗药物的抗肿瘤效应,并减少化疗药物的毒副作用[10],改善患者的生存质量。此外,研究也表明,苦参碱体外能够剂量依赖性抑制人肝癌细胞HepG2 的增殖等恶性生物学行为,其机制可能与诱导氧化应激和端粒酶活性有关[11]。这些研究表明,苦参碱具有一定的抗肝癌细胞增殖的活性;但是其对于高转移的肝癌细胞转移作用及机制尚不清晰。因此,本研究对苦参碱抗HCCLM3 人高转移肝癌细胞转移的作用及机制进行了研究。
本研究表明,苦参碱在32、64、128 mg·mL-1浓度下,能够剂量依赖性的抑制HCCLM3 癌细胞的增殖;接着选择对肿瘤细胞非直接杀伤的4、8、16 mg·mL-1剂量、研究其对HCCLM3 癌细胞迁移和侵袭能力,结果发现,苦参碱能够剂量依赖性的抑制癌细胞划痕愈合和Transwell 小室癌细胞的侵袭。EMT 过程是癌细胞发生转移和侵袭的作用方式,因而进一步采用RT-PCR 和Western Blot 对HCCLM3 癌细胞在EMT 过程中的关键因子E-cadherin、N-cadherin和Vimentin 的表达水平进行检测,结果发现,苦参碱在4、8、16 mg·mL-1剂量下能够剂量依赖性的减少HCCLM3 癌细胞N-cadherin 和Vimentin 因子mRNA 和蛋白水平,升高E-cadherin 因子mRNA 和蛋白水平,表明苦参碱能够抑制HCCLM3 癌细胞的EMT 过程,发挥抗癌细胞转移的作用。基质金属蛋白酶是肿瘤细胞分泌较多、能够降解ECM 的蛋白酶,癌细胞能够通过分泌MMP-2 和MMP-9 降解坚硬的细胞外基质,为癌细胞的转移和侵袭扫除障碍,因而MMP-2 和MMP-9 也是抑制肿瘤转移的重要靶标[12,13]。因此,本研究对这两个因子的mRNA 和蛋白水平进行检测,结果发现苦参碱在4、8、16 mg·mL-1剂量下能够剂量依赖性的减少HCCLM3 癌细胞MMP-2、MMP-9 因子mRNA 和蛋白水平。这表明苦参碱可能通过抑制MMP-2、MMP-9 表达,以及肿瘤细胞EMT 过程,发挥抗HCCLM3 人肝癌高转移细胞的转移。
综上所述,苦参碱能够抑制人肝癌高转移HCCLM3 细胞的增殖、迁移和侵袭,其抑制HCCLM3癌细胞转移侵袭的作用机制可能是与抑制细胞MMP-2、MMP-9 基质蛋白酶相关因子及EMT 过程有关。实验将进一步通过基因敲除的方式研究苦参碱的作用靶点,为苦参碱后续的抗肝癌转移实验和临床研究提供依据。
