悬浮法及酶消化法分离培养脂肪干细胞
2021-11-13赵雅丽李瑞方熊丽娇曾治平
赵雅丽,李瑞方,熊丽娇,曾治平
(1.赣南医学院2019级硕士研究生;2.赣南医学院第一附属医院全科医学科;3.国家老年疾病临床医学研究中心赣南分中心,江西 赣州 341000)
脂肪干细胞(Adipose-derived stem cells,AD- SCs)是从脂肪组织中分离得到的一种具有异质性的间充质干细胞,它具有多种属性标记,可分化为多种类型的细胞,如脂肪细胞、肌细胞、软骨和骨细胞等[1-2]。ADSCs与骨髓间充质干细胞(Bone mesenchymal stem cells,BMSCs)相比,更容易获得,并且在采集时具有相对较低的供区发病率。单细胞转录表明ADSCs对比BMSCs来说是一种更可控的干细胞来源,在调节炎症方面更具优势[3],且在促进体内外造血方面ADSCs也明显优于BMSCs[4],ADSCs方便分离的特性和强大的体外增殖能力,也使得ADSCs在再生医疗领域中非常受欢迎[5-6]。本文就ADSCs的分离、培养与鉴定进行研究。现报告如下。
1 材料与方法
1.1 实验材料 6周龄的雄性大鼠(由赣南医学院科研动物中心提供),操作前后符合《关于善待实验动物的指导性意见》[7]标准。优质胎牛血清(四季青无噬菌体内毒素),DMEM低糖培养基(Gibco),Trypsin-EDTA(0.25%phenol red),0.2%Ⅰ型胶原酶(Collagenase),磷酸盐缓冲液(PBS,自配),青霉素−链霉素(索莱宝),完全培养基(DMEM低糖完全培养基−初级)、抗坏血酸、β-甘油磷酸钠、地塞米松、胰岛素、吲哚美辛、3-异丁基-1-甲基黄嘌呤、茜素红、油红O等。BBS-SDC医用洁净工作台、Thermo CO2培养箱、DK-8D型电热恒温水箱、TDZ5-WS台式低速离心机、BCD-601WDPR低温冰箱、流式细胞仪、倒置显微镜等(由赣南医学院第一附属医院科研中心提供)。
1.2 实验方法
1.2.1 ADSCs提取
1.2.1.1 胶原酶消化提取法 (1)取6周龄雄性大鼠,将大鼠脱颈处死,在无菌条件下取大鼠腹股沟处脂肪组织,用加入双抗的磷酸盐缓冲盐水(PBS)充分漂洗3~4遍,放入装有PBS的培养皿中,剔除肉眼可见的血管及筋膜组织。(2)将其剪碎,大小最好约1 mm3左右,再用无菌的PBS反复冲洗,尽可能除去红细胞。(3)将其装入50 mL的试剂瓶中,并加入等量的0.2%Ⅰ型胶原酶,于37℃的恒温水浴箱中消化50 min,期间间断摇晃试剂瓶使其消化均匀。(4)加入两倍体积含有PBS的低糖DMEM培养液,轻轻吹打离散细胞团,将形成的单细胞悬液装入15 mL离心管中1690 r·min-1,离心10 min。(5)除去上层的脂肪和上清液,收集所得到的细胞沉淀物,加入DMEM培养液吹打细胞沉淀,并将吹打后的混悬液置入37℃,5%CO2的恒温培养箱中培养。
1.2.1.2 悬浮组织块提取法 (1)第一步同上述胶原酶提取法。(2)将脂肪组织剪成约绿豆大小,用PBS冲洗2~3遍。(3)接种到6 cm的平皿中,每皿放置6~8块已剪好的脂肪组织,加入6~8 mL的DMEM培养液使组织块悬浮。(4)轻轻晃匀后置于37℃,5%的CO2培养箱中培养。(5)5~6 d后首次换液,当细胞达90%融合时用胰酶进行1∶3传代,记为原代P1。
1.2.2 ADSCs传代 两种方法传代方法一致,将提取到的原代ADSCs培养24 h后首次换液,去掉残存的细胞碎片及红细胞,48 h后再次换液,之后每48~72 h换液1次,获得纯化的ADSCs,总计培养8~10 d后。观察原代ADSCs密度,一般融合生长达到90%左右,可进行传代,用0.25%胰蛋白酶常规消化后,进行传代培养。一般传代3代进行细胞鉴定,至5~6代之后可将细胞进行提取,置入液氮冷冻箱中保存。
2 结果
2.1 ADSCs的形态学观察 胶原酶消化法培养原代ADSCs 24 h后就有少量细胞贴壁,细胞呈梭形、三角形或多边形,多为单细胞核,首次换液后细胞生长迅速。7 d后可见细胞逐渐变圆,三角形逐渐消失,细胞大多成长梭形。悬浮法48 h后,可见少量形态以长梭形、圆形为主的细胞。7 d后可见大量长梭形细胞。12 d时,细胞融合达90%,可见大量类成纤维样细胞呈漩涡状生长,初步判断所获得的细胞为ADSCs(图1、图2、图3、图4)。
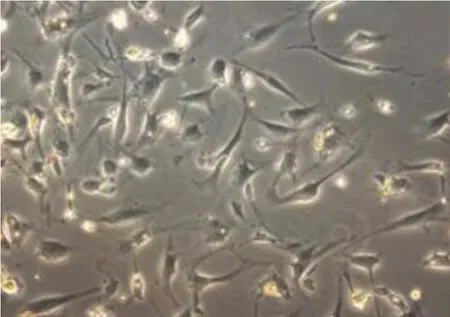
图1 胶原酶法培养第3天的ADSCs(400×)
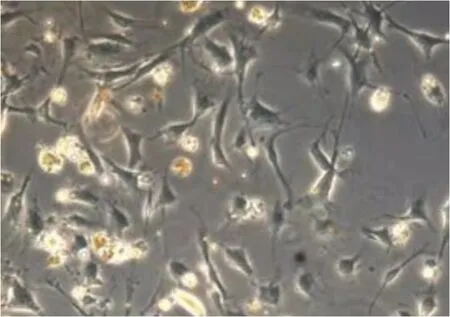
图2 悬浮法传代培养第3天的ADSCs(400×)

图3 胶原酶消化法培养第7天的ADSCs(400×)

图4 悬浮法传代培养第7天的ADSCs(400×)
2.2 细胞生长曲线 胶原酶法获得的细胞在接种的1~3 d缓慢增长,4~7 d进入快速增长期,之后细胞增长进入平台期,整体生长曲线成“S”形。悬浮法所得细胞在第3 d进入生长暴增期,第7 d进入生长平台期,生长曲线也大体呈“S”形(图5)。
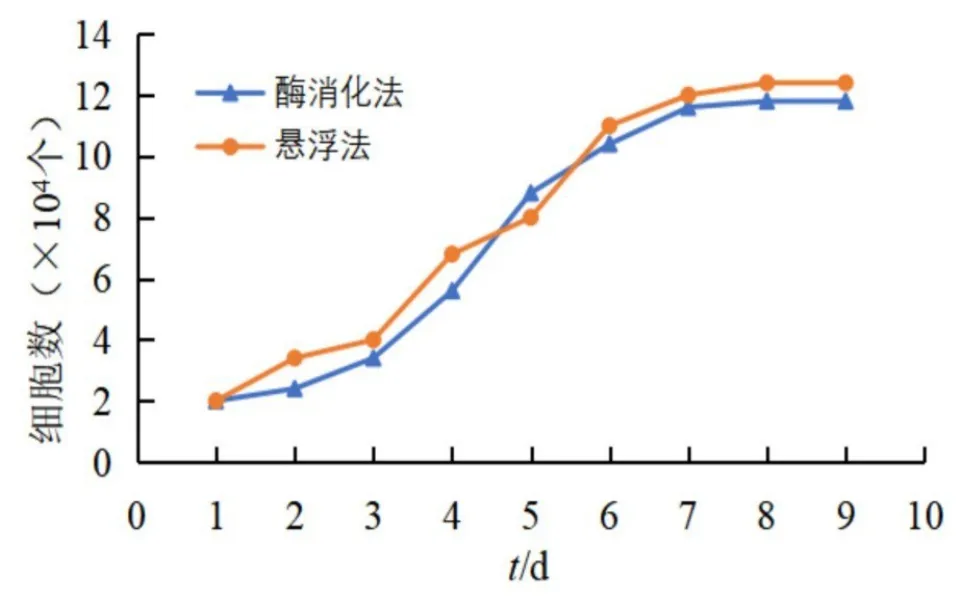
图5 酶消化法与悬浮法的ADSCs生长曲线图
2.3 干细胞的诱导分化能力
2.3.1 干细胞成骨分化能力 分别取酶消化法及悬浮法培养的第3代ADSCs在成骨诱导培养液(完全培养基+50μg·mL-1L-抗坏血酸+10 mmol·L-1β-甘油磷酸钠+0.1μmol·L-1地塞米松)培养,每2 d换液1次。ADSCs成骨诱导7 d左右,悬浮法及酶消化法均可见细胞体积逐渐增大,呈重叠生长,且形态慢慢变为多边形。诱导3周左右,吸出培养基,用PBS清洗3次,4℃下用70%乙醇固定1 h,室温下用2%的茜素红染色10 min,倒置显微镜下观察,两种方法所诱导的茜素红染色无明显差异(图6)。
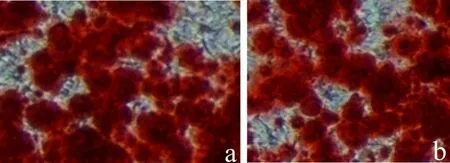
图6 两种培养法SDSCs成骨分化诱导能力(茜素红染色,400×)
2.3.2 干细胞成脂分化能力 取酶消化法及悬浮法培养的第3代ADSCs在成脂诱导培养液(完全培养基+200μmol·L-1吲哚美辛+0.5 mmol·L-13-异丁基-1-甲基黄嘌呤+1μmol·L-1地塞米松+10μg·mL-1胰岛素)培养,每2 d换液1次。成脂诱导7 d左右,细胞体积增大,逐渐变圆,细胞核周围可见少量小脂滴,并随着时间的推移不断融合。培养3周后,吸出培养基,用PBS液冲洗3次,室温下加入4%多聚甲醛溶液固定20 min,再用PBS冲洗3次,加入油红O染液,室温避光染色30 min,PBS冲洗3次,倒置显微镜下观察。悬浮法及酶消化法的油红O染色无明显差异(图7)。
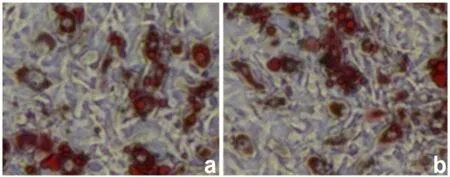
图7 两种培养法SDSCs成脂分化诱导能力(油红O染色,400×)
3 讨论
ADSCs是间充质干细胞(Mesenchymal stem cells,MSCs)的一个亚群,可以比较便利的从脂肪组织中获取,并具有许多与MSCs相同的特性及功能。ADSCs能在体外扩增,并快速繁殖,具有向多种细胞系分化的能力,例如分化为脂肪、骨、软骨和肌源性等细胞。此外,ADSCs还可分化为心肌、平滑肌、内皮、上皮、肝和神经源性等细胞[8-9]。随着医学的发展,细胞治疗的兴起,ADSCs将在美容、康复等领域拥有巨大的潜能。ADSCs有很多提取方法,刘琴等[10]对其分离提取方法进行总结,主要有酶消化法、组织块贴壁法、酶消化法结合组织块贴壁法、悬浮培养法及机械分离方法(涡旋离心法、吸附柱法、超声处理法)等。本文使用了酶消化法及悬浮组织块培养法作对比,比较了两种方法的优缺势,得出结论:两种方法均成功获取大鼠的ADSCs。但与酶消化法相比,悬浮组织块法具有一定的优势:①操作更为简单,酶消化法需要更为精细处理所分离的脂肪组织,而悬浮组织块法只需将其处理成绿豆大小即可。②价格较为低廉,悬浮法无需胶原蛋白酶进一步处理,而改用胰蛋白酶,此举大大降低了实验成本。③此法可克服胶原酶消化法过度消化的问题。④此法可提升脂肪组织利用率。⑤悬浮组织块法接种简单,只需轻轻晃动培养皿即可成功接种。但是在采用悬浮组织块法分离培离ADSCs时有两点注意的事项:①一个约6 cm的培养皿需要加入5~6 mL的培养液让脂肪组织块充分悬浮起来。②成功培养出ADSCs的关键是每皿中放适量的脂肪组织块,如一个6 cm培养皿接种6~8块4~5 mm3大小的组织块即可,接种过多或过少实验均不易成功。总的来说悬浮组织块法对比酶消化法操作更简便,价格更低廉,更具有可行性,但悬浮组织块法更易遭受污染,需较严格把控组织块接种量、培养液的使用及更换。本次实验对比了酶消化法及悬浮组织块法的优缺势,得出结论:对于获取大鼠的ADSCs来说,我们可优先考虑悬浮组织块培养法。
