1,25(OH)2D3对实验性自身免疫性神经炎大鼠肠道菌群的影响
2021-11-13孙俊杰李卓含江冉冉
年 娣,孙俊杰,李卓含,张 楠,江冉冉,时 鹏
(1.蚌埠医学院检验医学系核医学教研室;2.蚌埠医学院2018级本科检验专业;3.蚌埠医学院2019级本科检验专业;4.蚌埠医学院第一附属医院神经内科,安徽 蚌埠 233000)
吉兰−巴雷综合征(Guillain-Barrésyndrome,GBS)又称为急性炎症性脱髓鞘型神经病,是一种累及周围神经系统的自身免疫性疾病,亦是引起急性弛缓性瘫痪最常见原因,病因不明。实验性自身免疫 性 神 经 炎(Experimental autoimmuna neuritis,EAN)大鼠是GBS的经典动物模型,具有外周神经脱髓鞘和炎细胞浸润的病理学特点,临床表现、神经电生理改变与人GBS非常相似,被广泛用于GBS发病机制及治疗的基础研究。
肠道菌群被誉为人体“第二基因组”。生理状态下,肠道菌群与宿主间保持动态平衡,通过调控肠道屏障稳态、调节免疫反应等保护机体免受病原菌侵袭[1-2],微生物−脑−肠轴的紊乱与多种神经系统疾病相关。维生素D(VD)经典生物学作用是其调节钙磷代谢、骨骼新陈代谢作用。但维生素D受体(Vitamin D Receptor,VDR)在人体几乎所有组织类型中均有表达,近年研究表明[3-4],维生素D在抗炎、调节免疫、调节肠道菌群中发挥重要作用。肠道菌群通过调节维生素D吸收、代谢等影响VD/VDR信号通路,益生菌的个体反应可能依赖于VDR基因,维生素D与肠道菌群间相互影响共同参与维持肠道稳态[5-6]。本课题组前期研究发现[7-9],EAN大鼠肠道菌群结构、组成均发生改变,益生菌干预可缓解临床症状,提示肠道微生物可能通过影响肠外和中枢神经系统的免疫反应、炎症反应而参与GBS发病;1,25(OH)2D3可减轻EAN大鼠坐骨神经脱髓鞘和炎细胞浸润,但治疗机制是否与其对EAN大鼠肠道菌群的调节作用有关目前还不清楚。因此,本研究建立EAN大鼠模型,采用16SrDNA高通量测序技术观察1,25(OH)2D3干预后EAN大鼠肠道菌群的变化,从肠道微生态的角度解释1,25(OH)2D3对EAN大鼠的治疗作用。
1 材料与方法
1.1 材料
1.1.1 实验动物 选取6~8周龄健康雄性Lewis大鼠,体重(160±10)g,购自北京维通利华实验动物有限公司。饲养于蚌埠医学院SPF级实验动物中心屏障环境,温度(22±2)℃,12 h明暗交替饲养。
1.1.2 主要试剂与仪器 周围神经髓鞘抗原P0180-199购自上海吉尔生化有限公司;1,25(OH)2D3购自美国Sigma公司;结核杆菌H37Ra购于Difco公司。高通量测序仪Miseq PE300型购自美国Illumina公司。
1.2 方法
1.2.1 EAN模型建立 15只Lewis大鼠随机分3组,每组5只:正常对照组(Control,C),模型组(EAN,E),维生素D干预组(VD)。依照课题组前期建立的模型制备方法[9]采用P0肽主动免疫制备EAN模型,具体方法:模型组和维生素D干预组大鼠均后肢双足底、多点注射致敏剂(250μg P0180-199乳化于等量的完全弗氏佐剂)共100μL/鼠,致敏第0天和24 h后分别尾静脉注射200 ng百日咳毒素;正常对照组双后肢多点注射等量完全弗氏佐剂。维生素D干预组大鼠每天给予1,25(OH)2D31μg·kg-1灌胃,正常对照组和模型组每天同等量花生油灌胃处理,连续2周。
1.2.2 高通量测序分析肠道菌群 无菌收集粪便样本,采用16SrDNA高通量测序技术对粪便菌群进行分析。
1.2.2.1 DNA提取 称取适量大鼠粪便样本,使用E.Z.N.A.®Soil试剂盒提取粪便样本中总DNA,1%琼脂糖凝胶电泳检测,NanoDrop 2000检测DNA浓度和纯度。
1.2.2.2 PCR扩增、高通量测序 采用引物338F(5'-ACTCCTACGGGAGGCAGCAG-3')和806R(5'-GGACTACHVGGGTWTCTAAT-3')对16SrRNA V3-V4可变区进行扩增,Agencourt AMPure XP磁珠对PCR产物进行纯化并完成建库,利用Agilent 2100 Bioanalyzer对文库片段进行检测,检测合格的文库选择Illumina Miseq PE300平台进行测序,由深圳华大基因科技服务有限公司完成检测。
1.3 数据分析 数据过滤、Tags连接后进行分析,利用USEARCH软件,在97%相似度下进行OTU聚类,生成OUTTable。利用R语言等进行物种组成分析,单个样品多样性分析,样品间多样性分析等统计分析。采用SPSS 16.0软件进行分析,计量资料以±s表示,组间比较采用方差分析,多样本间两两比较采用Tukey法,P<0.05为差异有统计学意义。
2 结果
2.1 1,25(OH)2D3对EAN大鼠坐骨神经传导速度和脱髓鞘的影响 本课题沿用课题组前期实验方法:免疫后每天称重、观察发病情况并评分,发病高峰期进行坐骨神经动作电位传导速度、潜伏期测定(图1),E组坐骨神经传导速度(56.98±3.62)m·s-1,低 于C组(99.92±5.13)m·s-1和VD组(70.70±3.07)m·s-1,差异有统计学意义(P<0.05);EAN组坐骨神经动作电位振幅(7.16±0.50)mV,低于C组(16.30±1.38)mV和VD组(14.22±0.88)mV,差异有统计学意义(P<0.05)。发病高峰期取坐骨神经透射电镜(TEM)检测(图2),结果显示C组有髓神经纤维轴索结构正常,髓鞘板层排列规则;EAN组髓鞘板层肿胀呈蜂窝状改变及轴索剥离,VD干预后髓鞘肿胀等病理改变均较EAN组减轻。
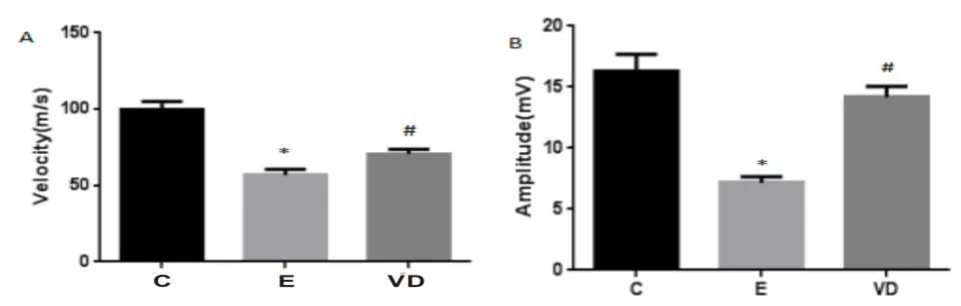
图1 各组坐骨神经传导速度(A)和振幅(B)
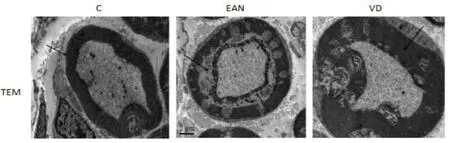
图2 透射电镜检测坐骨神经脱髓鞘
2.2 OUT分析 在97%相似度下对所有序列进行OUT划分并进行生物学信息统计。OUT Venn图显示(图3),3组大鼠共15例粪便标本共获得OUT物种771个,3组共有OUT 525个,C组和VD组各有特有OUT物种37个,E组特有OUT物种41个。
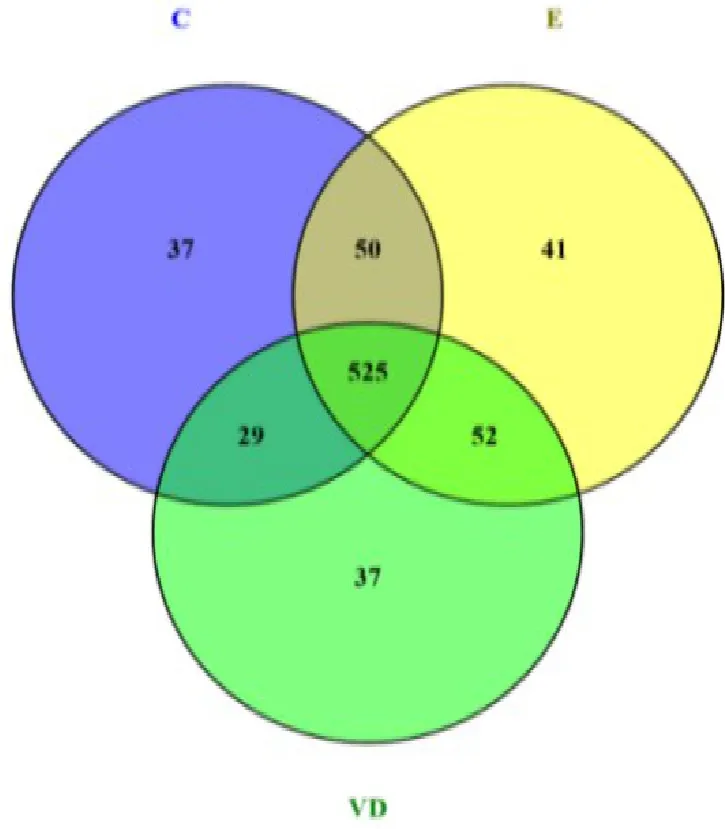
图3 OUTVenn图
2.3 Alpha多样性 基于OUT聚类分析,样本稀释曲线随测序量增加而逐渐趋于平坦,表明测序深度已足以覆盖样品中所有的物种,测序深度足够。进一步进行Alpha多样性分析,估计微生物群落的丰富度、多样性等生物学信息。Chao、Ace、Sobs指数可反映样品中群落中物种的数量,其数值越大,提示样品物种丰度越高;Shannon指数反映群落的多样性,Shannon指数越大说明样本群落的多样性越高;Coverge则反映样本文库的覆盖率即样品的测序深度,样品测序覆盖率高于0.9则说明样本测序覆盖率较高,数据较可靠。
Alpha多样性分析显示(表1),各组Coverge均大于0.99,表明本次测序覆盖度良好,可以代表样品的真实情况。E组Chao、Ace、Sobs指数均较C组降低(P<0.05),C组大鼠肠道菌群多样性最高,EAN组大鼠菌群丰富度较C组大鼠有所减少。1,25(OH)2D3干预后Chao、Ace、Sobs指数显著回升(P<0.05)。
表1 肠道菌群Alpha多样性指数/±s,n=5
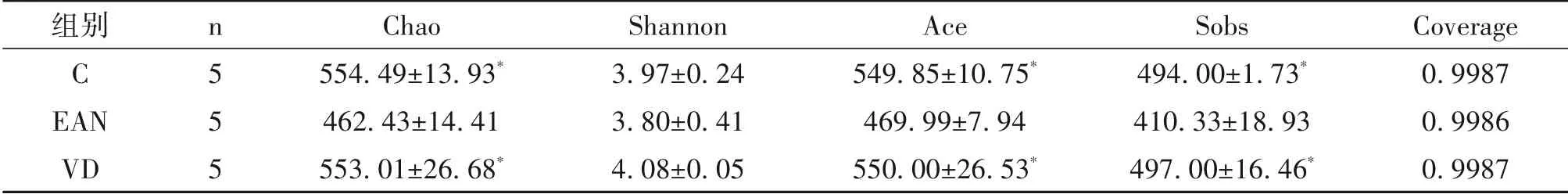
表1 肠道菌群Alpha多样性指数/±s,n=5
注:与EAN组比较,*P<0.05。
组别C EAN VD n555 Chao 554.49±13.93*462.43±14.41553.01±26.68*Shannon 3.97±0.243.80±0.414.08±0.05 Ace 549.85±10.75*469.99±7.94550.00±26.53*Sobs 494.00±1.73*410.33±18.93497.00±16.46*Coverage 0.99870.99860.9987
2.4 Beta多样性分析 热图(图4A)分析显示,与E组相比,VD组和C组样本之间距离较近。Beta多样性指数盒形图(图4B)也显示E组和C组差异较大,VD组和C组较接近(P<0.05)。
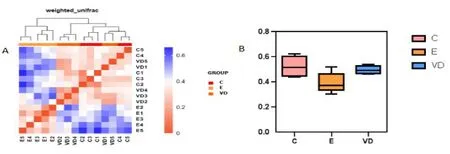
图4 Beta多样性图
2.5 肠道菌群组成结构分析
2.5.1 门水平菌群变化 如图5 Phylum所示,不同组别大鼠菌群结构在门水平相对丰度差异明显。C组大鼠菌群在门水平上主要由厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)构成,相对丰度分别为87.26%、10.23%。E组较C组Firmicutes明显减少、Bacteroidetes增加,相对丰度分别是55.54%、25.90%;疣微菌门(Verrucomicrobia)在E组中表达显著增加,相对丰度为11.86%。经1,25(OH)2D3干预后VD组相比E组Firmicutes显著增加、Bacteroidetes略有减低,Verrucomicrobia显著降低但仍高于C组水平,相对丰度分别是68.23%、23.51%和1.93%。
2.5.2 纲水平菌群变化 如图5 Class所示,C组小鼠肠道菌群纲水平以梭菌(Clostridia)、芽孢杆菌(Bacilli)、拟杆菌纲(Bacteroidia)为主,相对丰度分别 为72.29%、14.57%、10.22%。E组 较C组Clostridia、Bacilli显著减少,相对丰度分别51.08%、3.59%;而疣微菌纲(Verrucomicrobiae)、丙型变形菌纲(Gammaproteobacteria)、拟杆菌纲(Bacteroidia)显著增加,相对丰度为11.86%、3.32%、25.89%。1,25(OH)2D3干预后VD组较E组Bacilli水平大幅度回升,相对丰度13.17%;Clostridia略有回升但变化不明显,相对丰度54.70%;同时Verrucomicrobiae、Bacteroidia等表达水平均有所回落,相对丰度为1.92%、23.50%。
2.5.3 目水平菌群变化 如图5 Order所示,C组小鼠肠道菌群目水平以梭菌目(Clostridiales)、乳酸杆菌目(Lactobacillales)、拟杆菌目(Bacteroidiales)为主,相对丰度分别72.29%、14.55%、10.22%。E组与C组相比Lactobacillales、Clostridiales明显减低,相对丰度分别为3.54%和51.08%,疣微菌目(Verrucomicrobiales)、Bacteroidiales、肠 杆 菌 目(Enterbacteriales)显著增加,相对丰度分别11.85%、25.89%、2.71%。VD组较E组Lactobacillales水平大幅度回升,Clostridiales有回升但不明显,相对丰度分别13.01%和54.69%;同时Verrucomicrobiales显著降低,Bacteroidiales水平略有降低,相对丰度分别1.92%、23.50%。
2.5.4 科水平菌群变化 如图5Family所示,E组毛螺菌科(Lachnospiraceae)、乳杆菌科(Lactobacillaceae)、瘤胃球菌科(Ruminococcaceae)、梭菌科(Clostridiaceae)等均较C组明显减少,疣微菌科(Verrucomicrobiaceae)、肠杆菌科(Enterbacteriaceae)E组较C组明显增加。VD组Lactobacillaceae、Lachnospiraceae水平较 E组显 著回升 ,Verrucomicrobiaceae水平在VD干预后明显降低,S24−7变化不明显。
2.5.5 种属水平菌群变化 如图5 Species、Genus所示,E组瘤胃球菌属(Ruminococcus)、乳酸菌属(Lactobacillus)、颤 螺 菌 属(Oscillospira)、梭 菌 属(Clostridium)、粪球菌属(Coprococcus)等均较C组明显减少,阿克曼氏菌(Akkermansia)、埃希氏杆菌属(Escherichia)、Adlercreutzia、普氏菌属(Prevotella)E组较C组明显增加。VD组Lactobacillus、Ruminococcus水平较E组显著回升,Escherichia、Akkermansia水平在VD干预后明显降低。
2.6 肠道差异菌群分析 肠道菌群主要由Firmicutes、Bacteroidetes等构成,厚壁菌门/拟杆菌门(F/B)比值是评估病理状态的生物标志物[10],如图5 Phylim所示,EAN大鼠肠道菌群组成发生显著改变。与C组相比,E组大鼠Firmicutes相对丰度显著降低,而Bacteroidetes相对丰度显著增加,即F/B比值降低(11.27±6.39 vs 2.29±1.01,P<0.05)。1,25(OH)2D3干预一定程度上增加Firmicutes的丰度,同时降低了Bacteroidetes的丰度,VD组较E组F/B比值由2.29±1.01上升至3.17±1.27(P>0.05)。
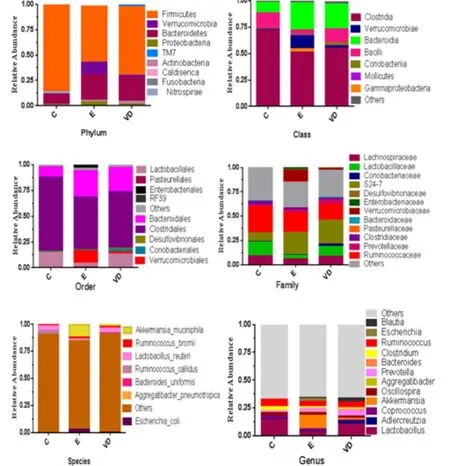
图5 门、纲、目、科和种属水平各组肠道菌群相对丰度
进一步利用LEfSe分析不同组相对丰度显著差异的物种,并选择P<0.05、LDA>2的菌属进行展示,如图6。结果显示EAN组大鼠Enterobacteriales、Enterobacteriaceae、Escherichia显著增多。1,25(OH)2D3干预显著改变EAN大鼠菌群OUT聚类,VD组Coriobacteriia、Coriobacteriaceae、Coriobacteriales、Adlercreutzia显著增加。
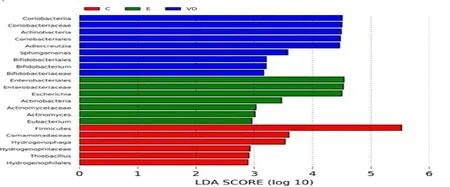
图6 OUT差异显著的LDA值分布柱状图
3 讨论
肠道是人体内微生物主要定植场所,近年研究表明肠道菌群通过调控肠道屏障稳态、调节先天性和适应性免疫反应、维持激素代谢平衡使宿主保持稳定的状态,保护机体免受病原菌侵袭。随着微生物−肠−脑轴研究的深入,人们越来越关注肠道菌群在神经系统疾病发生发展中的作用。CEKANAVICIUTE E等[11]在无菌小鼠体内定植MS患者肠道菌群后,无菌小鼠表现出严重的脑组织炎症反应,推测肠道菌群影响免疫系统引发中枢神经系统炎症可能是多发性硬化症的病因。全基因组关联分析发现VDR基因是影响肠道微生物群的宿主元素,VDR基因与整体微生物变异和个体分类显著相关,益生菌的个体反应依赖于VDR基因[5]。本课题组前期研究发现益生菌干预可缓解EAN大鼠临床症状,1,25(OH)2D3可减轻EAN大鼠坐骨神经脱髓鞘和炎细胞浸润,结合维生素D受体是形成肠道微生物群落的关键因素,我们推测肠道菌群可能是1,25(OH)2D3防治EAN的关键环节之一,故本研究建立EAN大鼠模型,采用16SrDNA高通量测序技术观察1,25(OH)2D3干预前后EAN大鼠肠道菌群的变化,探讨1,25(OH)2D3对EAN大鼠肠道菌群结构的影响。
本研究Alpha多样性分析发现EAN大鼠菌群丰富度指数Chao、Sobs、Ace均较C组降低,说明在EAN病情进展过程中肠道菌群结构和丰度发生了改变。1,25(OH)2D3干预后Chao等指数的回升,提示1,25(OH)2D3可显著提高EAN大鼠肠道菌群的多样性。BASHIR M等[12]、HSIAOEY等[13]研究也表明补充维生素D3可改变肠道菌群丰度,这与我们的研究结果一致。
进一步在肠道菌群组成进行分析发现,EAN大鼠在门水平上虽仍以Firmicutes、Bacteroidetes为主要优势菌群,但相对丰度改变。与C组相比EAN大鼠Lactobacillales、Bacilli、Clostridiales、Lactobacillaceae、Ruminococcaceae、Oscillospira、Coprococcus等均显著减少,而Akkermansia、Verrucomicrobiae、Bacteroidiales、Gammaproteobacteria、S24−7、Verrucomicrobiales、Enterobacteriales、Enterobacteriaceae、Escherichia、Prevotella等显著增加,提示EAN大鼠病情进展过程中肠道菌群结构发生改变,不同水平上肠道菌群丰度发生了改变。TREMLETTH等[14]发现MS患者脱硫弧菌科增多、毛螺菌科和瘤胃菌减少。UNGER MM等[15]发现PD患者粪便拟杆菌门和普雷沃氏菌科减少和同时伴有短链脂肪酸的减少。彭龙等[16]发现代谢综合征大鼠Ruminococcaceae类菌属下降明显。Ruminococcaceae、Clostridiales等菌属代谢产物以短链脂肪酸(SCFAs)为主,其中丁酸盐具有维持肠道屏障功能、调节免疫、抗炎作用,因此推测EAN发病过程中此类菌群减少,可能导致体内免疫调节等功能改变,加速病情进展。
1,25 (OH)2D3干预后发现肠道菌群F/B比值略有回升。与E组相比,Lactobacillales、Bacilli、Lactobacillaceae、Coriobacteriia、Coriobacteriaceae、Coriobacteriales、Ruminococcus、Adlercreutzia等水平显著增加,Verrucomicrobiae、Verrucomicrobiales、Escherichia、Akkermansia、Bacteroidia等表达水平回落。提示1,25(OH)2D3对EAN大鼠肠道菌群失衡有一定的调节作用,结合Alpha多样性、Shannon指数分析此调节作用并未影响肠道菌群整体平衡。有研究发现,VD摄入量不同人群的粪便微生物组成也不同,猜测VD与肠道菌群相互影响而参与疾病进展。F/B比值改变会影响机体的能量吸收利用,肥胖人群体内厚壁菌门丰度降低而拟杆菌门丰度增加。乳酸菌属于厚壁菌门,作为益生菌的一员,目前研究认为其是具有预防肠道炎症的菌群之一。ZAMANI等[17]发现,补充Lactobacillus acidophilus可降低RA患者血清hs-CRP、IL-6水平并缓解临床症状。QIAO等[18]研究表明,乳酸菌通过调节肠道菌群结构、肠道上皮细胞通透性等发挥改善肠道屏障功能作用。本研究显示,EAN大鼠Lactobacillales较C组减低,VD干预后Firmicutes、Lactobacillaceae的丰度一致性升高,再次证实VD干预可调整肠道菌群结构,其对EAN治疗作用可能与乳酸菌有关,具体机制有待于进一步的研究。Akkermansia属于疣微菌门,为革兰氏阴性球菌,可降解肠上皮细胞释放的黏蛋白,目前认为其通过调节肠道黏蛋白而参与肠道黏膜层构成,保护肠道免受病原体侵害,通过修复肠壁黏液层而改善肠道通透性减少内毒素吸收,在糖尿病、肥胖患者中发挥作用[19-22]。可本研究显示EAN组Akkermansia菌属显著增多,1,25(OH)2D3干预后Akkermansia菌属虽减少但仍高于C组,这与传统观点Akkermansia为机体有益菌相反。但JANGI等[23]研究发现,MS患者肠道Akkermansia菌较正常对照组增加。SAUER等[24]研究显示,Zn缺乏小鼠肠道菌群结构改变,疣微菌门丰度增高。高血红素铁膳食导致肠道黏液层损伤的同时A.muciniphila丰度显著增加,抗生素治疗后其丰度也显著降低[25],这与我们结果一致。因此,推测Akkermansia在不同背景下可能具有不同的代谢特征,进而发挥不同的作用。EAN大鼠模型中Akkermansia可能大量降解肠道黏蛋白而削弱肠道黏膜屏障的防御作用,增加了Enterobacteriaceae、Escherichia、Gammaproteobacteria等条件致病菌感染机体的机会,促进了EAN病情的进展。同样定位于肠道黏液层中,同样具有降解黏蛋白的功能的Lactobacillaceae菌属,在EAN大鼠体内为何与Akkermansia呈现相反的变化,二者之间是否存在联系值得进一步研究。
综上所述,本研究检测了EAN大鼠肠道菌群结构的变化以及1,25(OH)2D3对其干预作用。发现在EAN发病过程中肠道菌群结构发生了改变,主要以肠杆菌科、红蝽菌科、疣微菌目、疣微菌科等改变为主。补充1,25(OH)2D3有调节肠道菌群的作用,但具体机制还有待于进一步研究。
