Fe3O4纳米粉体的制备及其脱除亚甲基蓝性能
2021-11-13黄逸鹤郑合胜徐泽忠韩成良
吴 斌,黄逸鹤 ,郑合胜,徐泽忠,韩成良
(合肥学院a.能源材料与化工学院;b.分析测试中心,合肥 230601)
0 引 言
基于吸附和催化去除环境污染物是非常重要和有效的技术,该技术的关键是获取高性能的吸附剂和催化剂。[1-4]Fe3O4纳米材料具有易分离和类芬顿催化特性,且具有结构稳定、易分离和可循环利用。[5]因此,制备高性能Fe3O4纳米材料一直是研究和应用的热点。
首先,共沉淀法[6]是目前制备Fe3O4最普遍的方法,通常是把Fe3+和Fe2+以2:1的比例或者更高的比例均匀混合,然后调节pH值至沉淀生成,最后通过磁分离、洗涤、干燥获得纳米Fe3O4粉体。Victor,Kirillov等[7],利用共沉淀法制备了形态大小可控的磁性纳米Fe3O4颗粒,其机理简述如下:
Fe2++2Fe3++8OH-→Fe3O4+4H2O
该种方法制备出来的四氧化三铁纯度高、粒度分布均匀,而且分散性好,只是在用此方法制备目标产物时,影响因素繁多,如pH值、反应温度、加入沉淀剂的方式以及沉淀剂种类等等,因此难以实现规模化生产。
其次,部分还原法是制备Fe3O4纳米材料的另一个重要方法。[8-10]即利用还原剂对Fe3+的还原作用,将三分之一的Fe3+还原成Fe2+,使得Fe3+和Fe2+以2:1的比例在碱性环境下沉淀,通过加热、除杂和干燥等过程即可获得目标产物从而获得产物,反应过程可表示如下:
部分还原法制备纳米Fe3O4,有着原料简单,形态可控,反应速度可控的优点。但是还原剂的选择和用量,反应条件等方面难以控制。
此外,氧化法是取一定量的Fe2+溶液于反应容器中,在充分搅拌的情况下加入一定量碱,使之变成Fe(OH)2,在保持强碱的环境下,添加适当的氧化剂,将三分之二的Fe(OH)2氧化,最终获得产物。上述反应的反应机理为:
王旭等[10],以六水合硫酸亚铁铵和正丁胺为原料,在室温下成功制备出了Fe3O4纳米晶。用氧化沉淀法方法制备Fe3O4所用的氧化剂通常是指氧气,所以实验操作简单、成本低廉,产物粒度分布均匀,但是用此方法制备出产物的粒度一般较大,改变二价铁的初始浓度会影响沉淀速度,从而影响产物颗粒尺寸。
本文采用改性部分还原法来制备Fe3O4纳米粉体,即以三乙醇胺为还原剂和沉淀剂,以FeCl3.6H2O为单一铁源,采用水热法成功获得了Fe3O4纳米粉体。该法具有使用原料少,操作简单,获得的产物量大以及磁性能和吸附性能均优越等特性,是一种有望用于规模生产Fe3O4纳米粉体的新方法。
1 实验部分
1.1 实验流程
(1)Fe3O4纳米粉体的制备
用电子天平称取FeCl3·6H2O 1.5 g于烧杯中,加入120 mL去离子水充分均匀搅拌而形成溶液,在上述溶液中加入4 mL三乙醇胺(TEA),并用浓氨水调节溶液pH值至7。将上述溶液装入反应釜中,进行水热处理,利用控制变量法研究时间和温度对超顺磁Fe3O4形成的影响。分别设置水热处理的时间为30 min、60 min,90 min,设定温度为180℃;设置水热处理的温度为120 ℃、140 ℃、160 ℃,设定时间为90 min。
(2)吸附实验
吸附动力学:取0.06 g Fe3O4纳米粉体加入到200 mL初始浓度为10 mg/L的亚甲基蓝水溶液中并在不同时间间隔里进行取样测试,分析水溶液中亚甲基蓝浓度随吸附时间的变化关系,即可获得其吸附动力学关系。
吸附热力学:室温下,取0.012 g Fe3O4纳米粉体分别放入5个200 mL烧杯中,分别加入100 mL不同浓度的亚甲基蓝溶液,经过24h 充分吸附后磁分离后测试各烧杯中亚甲基蓝浓度。然后,估算平衡吸附量,最后可得到平衡吸附量与平衡浓度关系。
1.2 表征与测试
在电子显微镜(日立SU8010场发射扫描电子显微镜和日本电子JEM2100透射电子显微电镜)下观察产物的形态和分析显微结构。用ARL 型 X 射线衍射仪(XRD,Cu Kα,λ =0.15406 nm)和振动样品瓷器计(VSM,英国 Nanomagnetics)对产物进行物相纯度和室温磁性性能表征。水溶液中亚甲基蓝浓度估算:首先,用UV-Vis 测试亚甲基蓝水溶液吸光度与波长的关系,然后,在一定浓度范围内,依据吸光度和浓度呈线性关系估算亚甲基蓝浓度。平衡吸附量(qe)依据下列式子计算
其中:C0(mg/L)代表亚甲基蓝初始浓度;Ce(mg/L)为亚甲基蓝的平衡浓度;V(L)是吸附液的体积;m(g)是吸附剂的质量。
2 结果与讨论
图1为反应温度和时间分别为180℃和3h时所得产物的XRD谱图,与标准的Fe3O4谱图(JCPDS:19-0629)相比可知,在该实验条件下所得的产物为单一物相Fe3O4。以(311)晶面依据为例,用谢乐(Scherrer)公式(D=Kλ/Bcosθ,K=0.9,D为晶粒尺寸,B为任一晶面的衍射峰半高宽,θ为衍射角,λ=0.159nm)可以估算出Fe3O4纳米粉体的平均粒径约为10nm。

图1 Fe3O4 纳米粉体XRD谱图
图2表示 Fe3O4纳米粉体的形态与结构,其中图2(a)是最佳反应条件下(180℃,3h)所得产物的场发射扫描电子显微镜(FE-SEM)照片,由图可知:产物的形状为无规则颗粒状,分散性较好。图2(b)为图2a对应的颗粒分布图,由结果可知,产物颗粒尺寸分布范围较窄,其平均粒径约10nm。图2(c)是产物的低倍投射电子显微镜(TEM)照片,由该图可知产物的二维形态为无规则颗粒,与图2a中的结果基本一致。图2(d)为相应产物的高分辨电子显微照片,对晶格相表征后可知,每个Fe3O4纳米颗粒均为单晶态,这与图1中XRD结果分析是一致的。

图2 Fe3O4 纳米粉体的形态与结构:(a)产物SEM;(b)产物粒度分布图;(c)产物TEM;(d)产物HRTEM
利用VSM测试了在反应温度180℃ 时,反应时间为3h下获得的Fe3O4纳米粉体的室温磁学性能,其结果如图3所示。由图3可得该样品的矫顽力(Hc)和剩余磁化强度(Mr)几乎为零,具有超顺次特征。产物的磁化强度(Ms)约为40 emu/g。
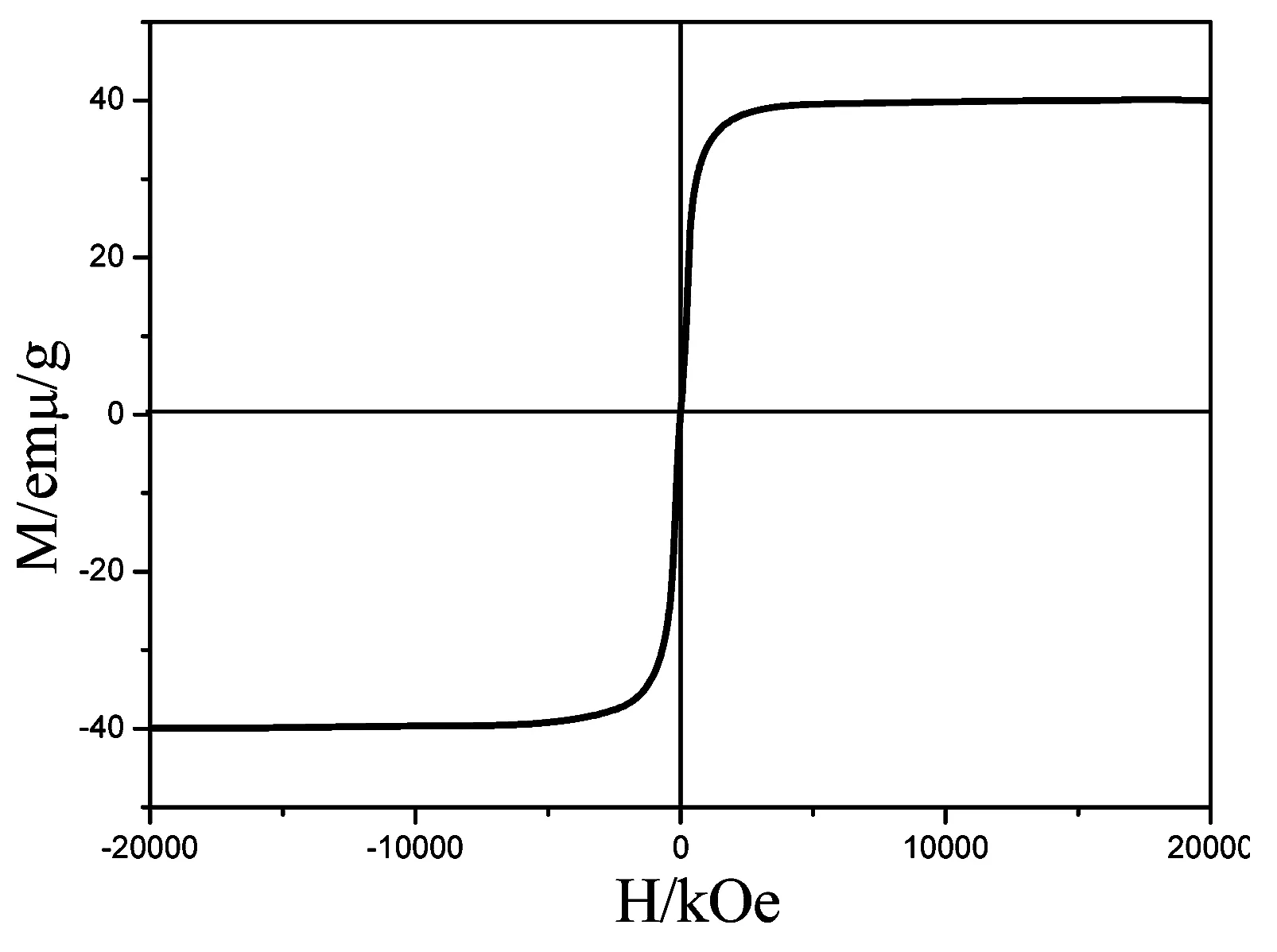
图3 室温下Fe3O4纳米粉体磁性性能
在水热反应时,保持反应温度为180℃,改变反应时间可以获得不同产物,对此进行XRD分析测试,其结果如图4所示。由图4可得,当反应温度保持不变时,随着反应时间的延长,产物颜色由棕红逐渐变黑、磁性逐渐增强(对实际产物进行观察和磁分离可知,文中未列出此结果。),当反应时间达2h后,产物为高纯Fe3O4物相(见图4XRD谱图)。

图4 不同反应时间所得产物的XRD谱图
在TEA-Fe3+构成的水反应体系中,反应温度对产物形成的影响也是很大的。实际研究发现,当反应温度低于140℃时,反应产物极少,且为非目标产物。当反应温度达140℃后,生成产物为水合铁氧化物(Fe2O3.xH2O),见图5中曲线(a)所示。而当反应温度为160℃时,将获得高纯的Fe3O4物相(见图5中曲线(b))。反应温度为200℃时,获得的Fe3O4粒度较大。因此,在反应时间一定时,最佳的反应温度可控制在160℃~200℃之间。

图5 不同反应温度下获得产物的XRD谱图:(a)140℃;(b)160℃;(c)200℃
通常,Fe3O4物相的形成与制备方法有关,水热法制备高纯Fe3O4物相则主要与其使用的铁原料有关。例如,以单一二价铁盐或其配合物为原料,在碱性反应体系中,通过水热反应以部分氧化方式便可获得Fe3O4。[10,11]同样,以单一三价铁盐或其配合物为原料,在水热条件下通过部分还原反应也可得到高纯Fe3O4物相。[9,12-14]基于已报道水热体系中Fe3O4形成机理以及本文实验结果研究,可以认为在TEA-Fe3+水热反应体系中,Fe3O4形成有以下几个过程:首先,常温下,在碱性三乙醇胺水体系中,Fe3+与TEA可形成水溶性配位离子(Fe(TEA)3+);其次,当加热到一定温度和一定时间后,Fe(TEA)3+将发生强迫水解生产Fe(OH)3(见式(1));接着,随着反应时间延长,Fe(OH)3将发生脱水反应得到γ-Fe2O3(见式(2));最后,γ-Fe2O3在含有一定浓度的TEA水系中通过结构微调得到了Fe3O4物相,如式(3)所示。
Fe(TEA)3++3H2O→Fe(OH)3+TEA+3H+
(1)
2Fe(OH)3+TEA→Fe(OH)2+H2O
(2)
Fe(OH)2+2Fe(OH)3→Fe3O4+H2O
(3)
需要指出的是,和已有文献报道相比较,实验中所使用的三乙醇胺在水热反应中分别起到了沉淀剂、配位剂和还原剂三重作用。因此,制备Fe3O4时,具有所需原料少、操作简单和成本低等优点。
以亚甲基蓝为目标污染物,初步研究了实验获得的Fe3O4纳米粉体对水体中染料的吸附脱除规律。图6a是在100 mL亚甲基蓝初始浓度为10 mg/L的水体中加入一定量Fe3O4纳米粉体后,溶液中亚甲基蓝浓度与时间的变化关系。可以看出,随着时间的延长,溶液中亚甲基蓝的浓度逐渐降低。由图6(b)是对图6(a)的数据进行线性拟合分析得到的结果,由图6(b)可知,Ct/C0与lnt 成线性关系(相关性系数(R2)的值约为0.99),二者的关系式为:Ct/C0=1.05-0.025*lnt,说明该吸附动力学过程符合准二阶动力学方程。

图6 Fe3O4 纳米粉体吸附水中染料动力学:(a)Ct~t关系;(b)Ct~ln(t)关系
图7表示 Fe3O4纳米粉体吸附水中染料热力学图像。由图7(a)可得,Fe3O4纳米粉体对水体中亚甲基蓝的最大吸附量可达28 mg/g,其吸附量高于文献[15-17]报道。用Freundlich等温模型(4)对其吸附数据进行拟合分析后可知,超顺磁Fe3O4纳米粉体对水体中一定浓度的亚甲基蓝等温吸附过程符合多层吸附模型。

图7 Fe3O4 纳米粉体吸附水中染料热力学:(a)qe~Ce关系;(b)log(qe)~log(Ce)关系
(4)
其中,Kf和n是Freundlich常数,分别代表吸附能力和吸附强度。
依据上述吸附动力学和等温吸附曲线结果分析,认为实验获得的Fe3O4纳米粉体去除水体中亚甲基蓝的可能机理如下:(1)物理吸附,Fe3O4纳米粉体具有较高的比表面积且表面荷负电荷,可以有效吸附水体中表面荷正电的亚甲基蓝分子;(2)化学吸附,在三乙醇胺体系中制备出的Fe3O4纳米颗粒表面富有氨基和羟基,可以与亚甲基蓝分子发生配位作用,从而达到捕获亚甲基蓝分子效果。然而,除了静电作用和配位作用外,去除水体中亚甲基蓝等污染物是一个复杂的过程,可能包括多个步骤,同时可能存在多种机制协同作用[18-20]。要确认其真正机理还有待后续进一步详细研究。
3 结 论
在三乙醇胺-Fe3+水体系中,当反应时间和温度分别为:2h和180℃时,将获得高纯Fe3O4纳米粉体。X射线衍射(XRD)、场发射扫描电子显微镜(SEM)、透射电子显微镜(TEM)和磁强振动仪(VSM)综合分析结果表明,实验制备出的Fe3O4纳米粉体为无规则形状,其平均粒径约10nm,产物具有超顺次特性。该超顺磁Fe3O4纳米粉体对水体中一定浓度的亚甲基蓝的吸附动力学满足准二阶动力学方程,等温吸附模型满足Freundlich多层吸附模型。具有较强吸附性能的Fe3O4纳米粉体可作为染料污染废水的修复剂,且能方便进行分离和回收再使用。
