杂环手性辅助剂不对称合成方法综述
——纪念有机立体化学名家Ernest L. Eliel 敎授
2021-11-13何煦昌
何煦昌
(中国科学院 上海药物研究所 上海 201203)
立体化学是研究化合物三维空间的化学。许多分子具有三维结构,通常能分为静态和动态立体化学。前者是分子的立体化学,处理立体异构的种类、结构和命名。后者是反应的立体化学,分析各类化学反应的立体化学要求和结果,包括立体异构体的分离和相互转变,往往又与反应机理交织在一起。不仅在有机化学领域,而且在其他各化学分支中,特别是迅速发展的分子生物学领域,立体化学已经渗入它们的研究。
立体化学起源于19世纪初期,科学家发现若干有机化合物具有旋转偏振光的性质。无论它们是固体或液体,甚至在溶液状态中,都具有旋光性,因此认识到这是组成物质的分子性质。1848年,法国科学家Pasteur首次成功地从外消旋体中分离出右旋和左旋的酒石酸钠铵盐,提出右旋和左旋酒石酸分子间呈对映形态。1858年,Kekule、 Cooper等提出分子结构理论,阐明碳的四价键结构。1874年,Van’t Hoff和Le Bel分别独立提出碳化合物的正四面体立体结构,四个取代基在四面体的顶端。这样碳化合物Cabcd(取代基a≠b≠c≠d)能排列成两个互为镜像的对映体,解释了存在各种立体异构体的可能, 从而奠定了有机立体化学的基础。
20世纪40年代,Hassel用电子衍射法等方法证实环己烷分子呈椅式构象,环己烷上取代基呈平伏键和直立键两种构象。随后,50年代,Barton在研究甾族化合物中,分析了平伏键和直立键取代基的不同反应性。1951年,Bijvoet应用X射线衍射的反常散射技术,测得右旋酒石酸铷钠盐的绝对构型,使早期德国化学家Fischer用(+)-甘油醛作标准,通过化学合成的一系列构型相关的化合物具有绝对构型的意义。20世纪50年代应用了X-射线衍射结晶学技术,Pauling等研究α-角蛋白结构,发现了它的螺旋空间结构。随后Watson和Crick阐明了脱氧核糖核酸的双螺旋结构,显著地促进了结构生物学的发展。
虽然有机化学教科书在谈及机理问题时会述及立体化学关联,但当时缺少系统介绍立体化学基础内容的敎科书。上世纪60年代初,Eliel敎授将其在美国Notre Dame大学的授课内容,用3年时间整理后出版了有机立体化学教科书 “Stereochemistry of Carbon Compounds”[1]。当时出版新的立体化学敎科书唤起有机化学界的极大的注意。加州大学Heathcock敎授当时评论此书和Eliel与他人合作的“Conformational Analysis”[2], 是上世纪中最有影响之两本立体化学教科书。前者己被译成徳文、日文、俄文等多种文本。虽然作者称此书是为学生获得基本知识的敎科书,然而书中包含了的引证文献以及详细注释,事实上是立体化学基础知识参考书[3]。
在随后的30年间,立体化学得到了极大的发展,特别是若干新概念术语的出现、立体化学术语的引入和它的正确定义是立体化学发展的标志之一。20世纪60年代中期,‘手性’术语正式引入至有机立体化学, ‘手性’确切表达分子存在对映异构体的必要和充分条件。由Cahn、Ingold和Prelog等人发展的‘顺序规则’方法,用R/S系统指明分子构型,进而‘前手性’概念引入,使分子中处于不同原子或基团位置环境,即‘立体异位’的概念有了明确的立体化学表达和识别。 随后‘立体异构源因素’(stereogenic element)引入,又逐步取代手性因素即手性中心、轴和面命名。
随着科学技术的发展,核磁共振光谱仪,旋光谱、圆二色散以及各种气、液相色谱工具,为立体异构体定量分析提供有力的方法。用单一波长测定化合物比旋光值,不再是一个必要的方法。因此‘光学异构’、‘光学拆分’ 前缀的术语逐步淘汰。
为了达到最新的发展立体化学广泛内容教科书,在1994年Eliel和Wilen以及Mander合作,经过多年修改补充最新资料,出版新书“Stereochemistry of Organic Compounds”[4]。尽管作者在新书序言中阐明,由于篇幅限制排除了某些范围,如髙聚物、Woodward-Hoffmann轨道对称规则,但仍引証参考文献。书末附有立体化学词汇表,IUPAC(纯粹和应用化学国际协会)随后推荐的立体化学基本术语‘Basic Terminology of Stereochemistry(IUPAC Recommendations 1996)’[5],其中多采用了Eliel的提法。Seeman博士对此书提出了高度评价:很难想象在那个阶段, 由任何其他作者或小组能更详情、更完整的完成权威性単独壹卷的立体化学题目。此书己成为有机化学工作者和药物研究人员查询立体化学基本知识的小百科全书。
立体异构体,特别是对映体之间,具有不同的生理活性。上世纪90年代开始,药审部门提倡对单一立体异构体进行药理和临床试验。以单独立体异构体上市, 手性药物的发展[6]是药物发展的新里程碑, 它有力推进更安全、更有效的药物的上市。
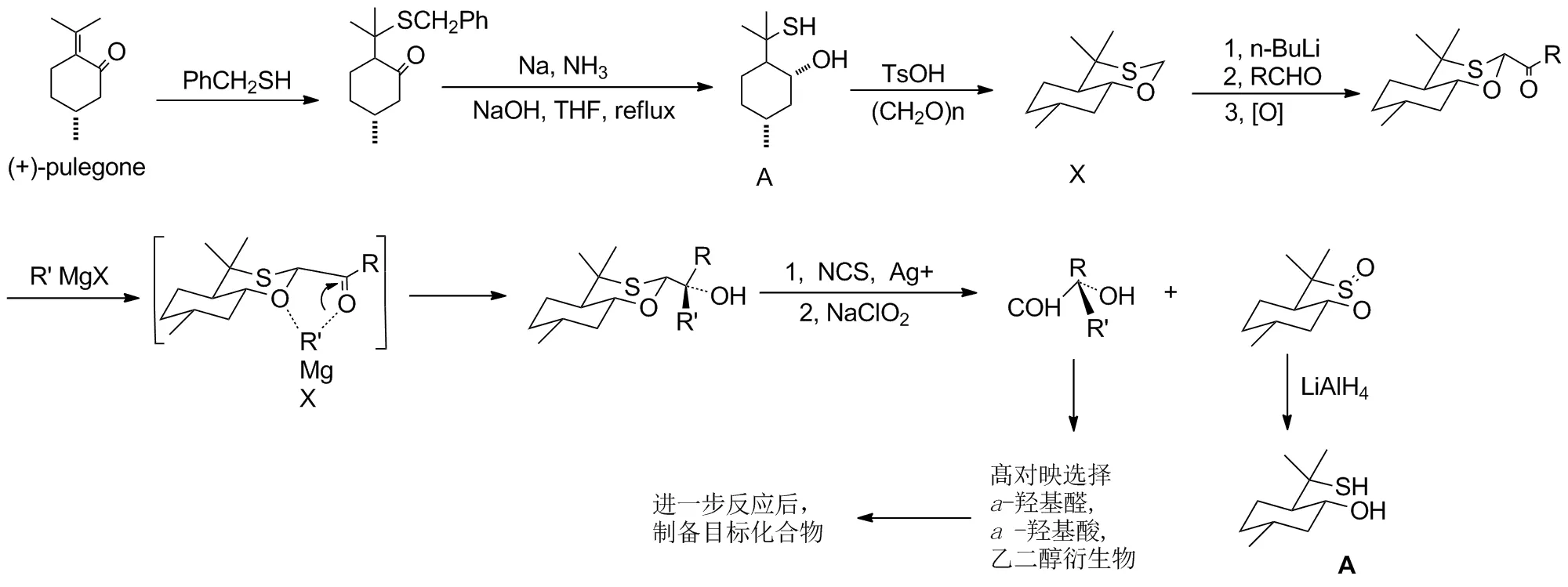
Scheme 1
2001年,Eliel又与Doyle合作,删去迅速发展的立体选择性合成的内容,出版了缩写本“Basic Organic Stereochemistry”[7]。随后由邓并组织主译成中文版的“基础有机立体化学”[8]己经在2005年闻世,极大方便中国有机化学工作者查阅立体化学基本知识。
随着20世纪的最后一年人类基因组框架的描述,21世纪又揭开蛋白组学研究的篇章。运用分子生物学各种手段,对蛋白质、核酸、糖类和脂类各种形式复合物的立体三维精细结构和功能,揭示生命活动的规律和本质,对科技工作者提出极大的挑战。现代的有机立体化学的书也向结合生物医学方向发展[9]。
关于Eliel 教授大量立体化学研究, 特别是构象分析的工作,可以从他的书中和文献里查阅到。我在此文中仅述及讨论我在他组工作时的不对称合成的研究,从中可以了解他基础研究的设计思路。
2.1 不对称合成的手性辅助剂的目标和控制反应的有利条件
上世纪七十年代前,不对称合成经历起始的过程, 需要的立体异构体产率并不高,同时伴随不需要的异构体,往往不易分离纯化,也就缺乏实际应用价值。1974年Eliel研究的不对称合成的文章中[10]先简要总结了当时不对称合成的形势,在仅有的数种高立体选择反应中,如硼氢化反应, 反应产物超过90%的光学纯度,但是手性试剂不能回收。Eliel提出了应用手性辅助剂的不对称合成基础研究目标:(1)需要高立体选择和化学产率的立体异构体;(2)使用了手性辅助剂, 手性产物需要很容易与辅助剂分离;(3)除非手性辅助剂相较产物是非常便宜,手性辅助剂需要回收且没有减小其纯度。Eliel根据自己构象分析的经验,结合他人高立体选择性的反应,提出了不对称合成的3个控制反应有利条件:(1)控制反应底物为相对刚性环。使试剂从一边比另一边更容易进攻;(2)多功能团的手性辅助剂能够有两个配位位点与金属试剂鳌合后,控制进攻试剂方向;(3)反应物和试剂形成相当紧凑的络合物,来控制试剂进攻底物两个前手性面的其中一个方位。尽管在当时高立体选择合成的范例不多,提出这3条控制反应因素,至今在设计不对称反应时仍具有参考价值。
2.2 采用1,3-氧硫杂环己烷手性辅助剂
Eliel研究的手性辅助剂的不对称反应设计的研究程序:首先是从自己构象分析研究中,研究六元环不同构象中取代基位置的反应性能,又在杂环之间分析优选,挑选出1,3-氧硫杂环己烷(1,3-oxathiane)进行手性辅助剂不对称合成[11]:从单环1,3-氧硫杂环己烷的反应结果[12],进而设计合成了更刚性二元反式并环作为手性辅助剂,从天然产物(+)-胡薄荷酮[(+)-pulegone]得到反式全氢苯并1,3-氧硫杂环己烷手性辅助剂X(见Scheme 1)。关键的立体选择性反应按照Cram规则,格氏试剂中金属元素与酰基上氧和杂环上氧原子同时鳌合,直链反应底物醛基嵌入1,3-氧硫杂环己烷的2位,有效地保护醛基又符合他提出的反应环境来控制关键的立体选择性,反应后释放的醛基被进一步改造,可合成手性叔a-羟基醛,a-羟基酸和取代乙二醇等类化合物,得到较高的立体选择性产物。回收的手性辅助剂前体羟基硫醇A,可进一步循环使用[13]。
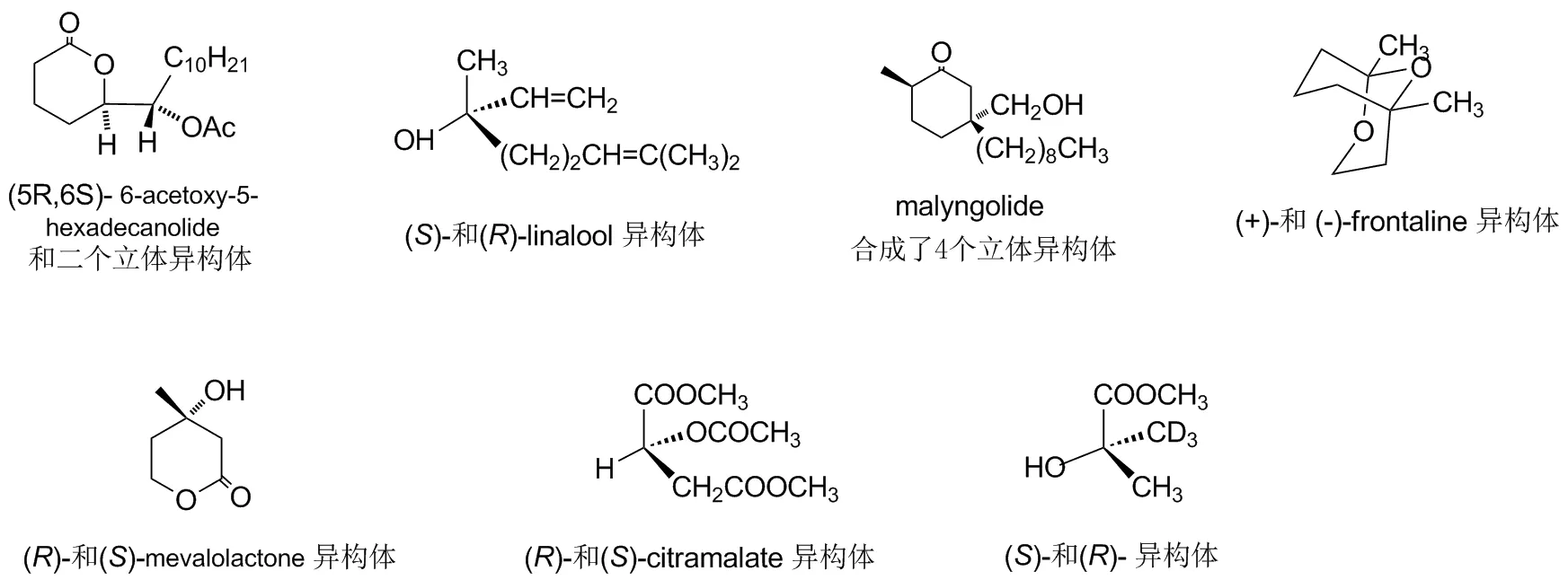
Chart 1
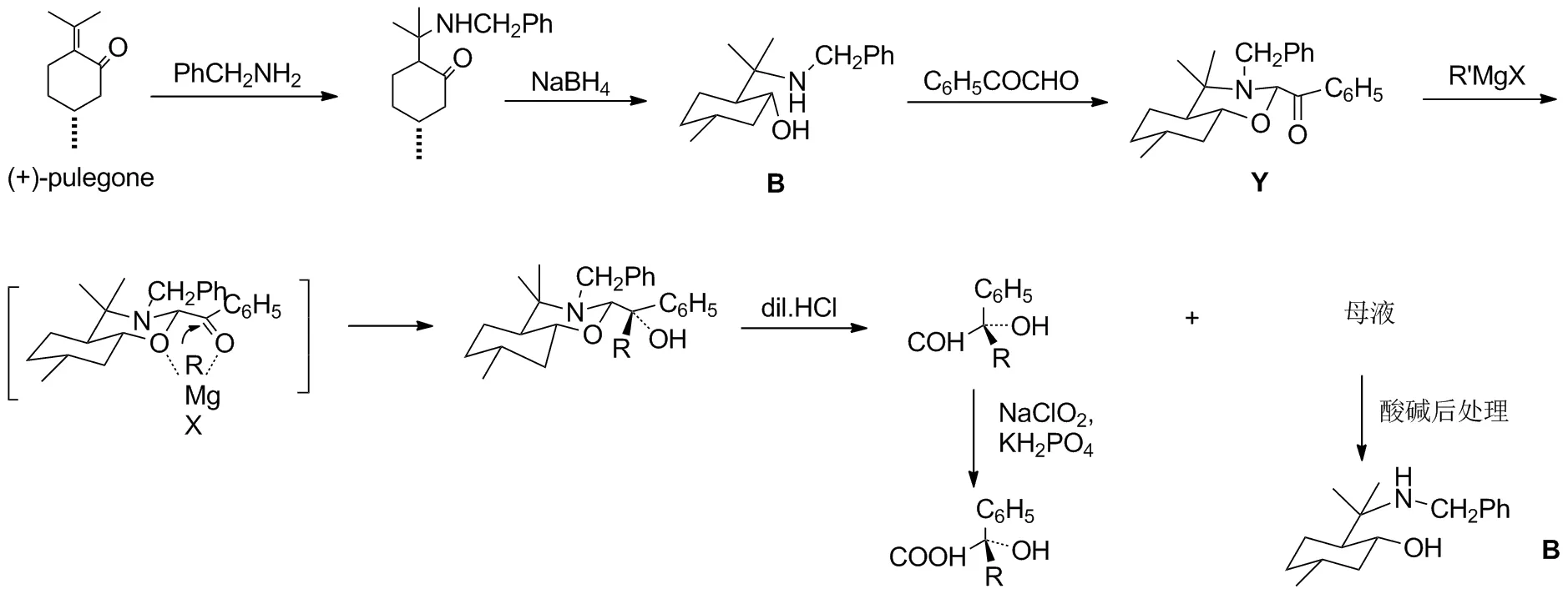
Scheme 2
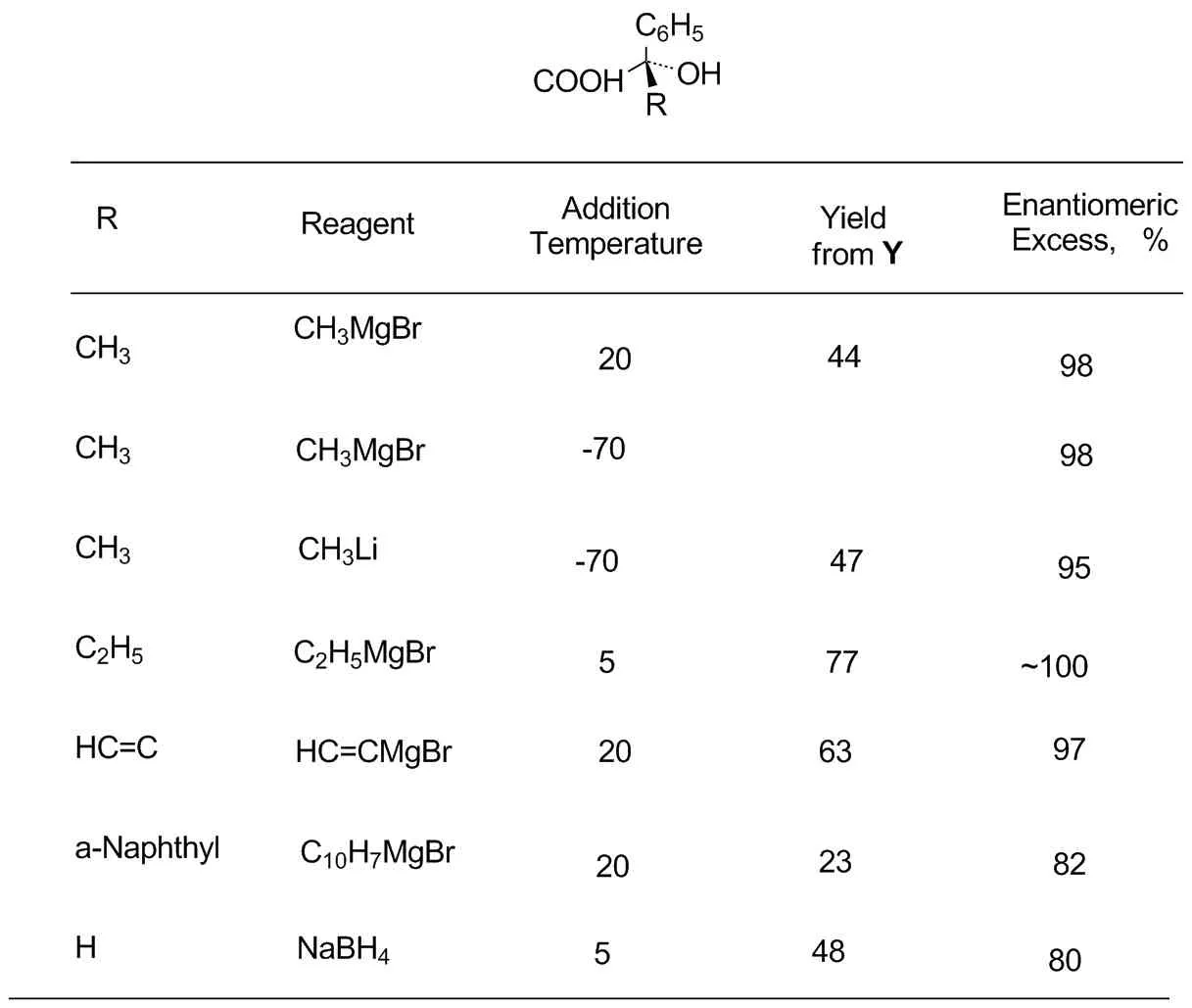
表1 产物的立体选择性
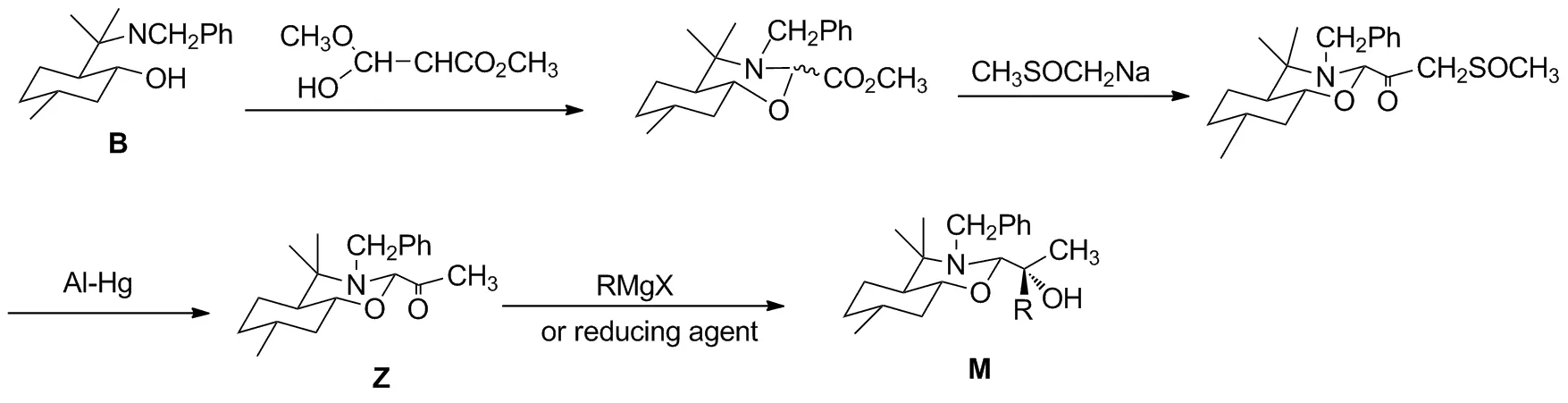
Scheme 3
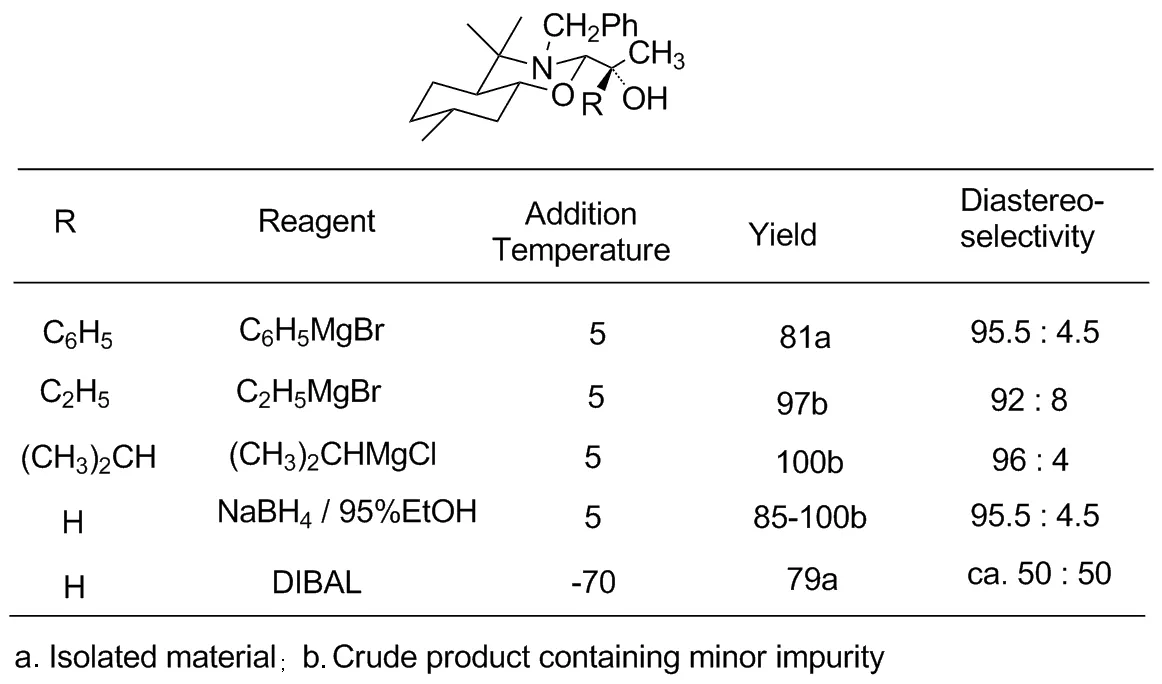
表2 产物立体选择性
2.3 采用1,3-氧硫杂环己烷手性辅助剂合成目标化合物
利用全氢苯并1,3-氧硫杂环己烷手性辅助剂, 在他的研究小组合成了一系列髙纯度的立体异构体目标化合物,见Chart 1。
2.4 合成1,3-氧氮杂环己烷手性辅助剂
Eliel敎授将手性辅助剂应用进行改进:将1,3-氧硫杂环己烷中的硫原子改为氮原子,成为1,3-氧氮杂环己烷(1,3-oxazine),这个研究任务在我申请到他研究组的研究位置后,由我起始执行,首先制备了N-苄基-4,4,7a-三甲基-trans-八氢-苯并1,3-氧氮杂环己烷作为手性辅助剂(Scheme 1 中Y),其关键反应同样按照Cram 规则,立体选择性是很高的[14](表1)。
手性辅助剂2-位上烷基酮合成比芳香基酮稍复杂,相应2-位甲基酮辅助剂Z合成[15]见Scheme 3。
Z反应生成2-位烷氧基加成物,或者是被还原产物(R=H)M,其反应立体选择性初步结果见Table 2。
由1,3-氧氮杂环己烷Y作为手性辅助剂的优点是显著的,首先制备方法更容易(比较Scheme 1和3),由我发展制备的羟基胺B与有机芳香酸成盐结晶,能达到高纯度的手性辅助剂前体B。 这在手性辅助剂进行不对称合成中很重要, 除了手性辅助剂易于纯化,还影响反应产物立体选择性的正确结果。 除了在辅助剂Y反应底物成刚性杂环控制格氐试剂进攻方向,并且由于氮原子上带有苄基有效阻拦住另一面方向,使反应在室温下进行,仍获得高度立体选择性结果,最后如需要的产物不带碱性基团,普通的酸碱后处理, 手性辅助剂前体B就回收了,非常方便可进一步使用。这显然更符合他提出的不对称反应目标。
2.5 采用1,3-氧氮杂环己烷手性辅助剂合成各种目标化合物
1991年,由于Eliel已退休,N-苄基-4,4,7a-三甲基-trans-八氢-苯并1,3-氧氮杂环己烷Y作为手性辅助剂工作在他研究组没有进一步继续。然而这个手性辅助剂前体B(或者改变氮上取代基)因为它的制备纯化容易的优点,它又符合绿色化学的标准(相对于含硫化合物的异味,1,3-氧氮杂环己烷衍生物没有任何嗅觉味),被其他研究组陆续开发应用到各种类型不对称合成中使用。例如:高对映选择合成伯胺类[16],进而合成对映纯伯胺类化合物([17];使用TMSCF3加成,得到相应对映致富的三氟甲基的1,2-醇或1,2-氨基醇[18]; 用2-位上取代的双键底物和PhSeCl进行反应,得到区域和立体选择甲氧硒化产物[19];制备对映纯1-取代1H-2-苯并吡喃[20];与氧化腈的1,3-环化和偶极环加成用于2-异噁唑烷类化合物[21];用于合成对映纯七元环1-氧杂-4-氮杂环庚烷类化合物[22];合成催化剂,用于二乙基锌对映选择加成到醛类化合物[23];用于非对映选择择Yang光环化反应,合成2,3-取代-氮杂环丁醇-3类衍生物[24];作为屏蔽醛和手性模板进分子间Pauson-Khand反应[25];用于合成含氧或氮杂环化合物,使用闭环烯烃换位反应[26];用于合成对映纯cis-3,4-二取代-3-羟基-吡咯烷类化合物[27];用于合成3-取代异苯并呋喃酮杂环化合物[28];应用Diels-Alder反应的手性模板,作为合成三取代四氢环氧异吲哚酮类化合物[29];在Eliel敎授获得“手性奖”的专辑中,手性辅助剂Y应用于各种目标不对称合成,被人称为“Eliel合成子”(Eliel-synthon)[30]。由于手性药物发展的需要,为了提供单一的立体异构体,立体选择合成是近年来有机合成发展最快领域之一。使用手性催化剂是不对称合成发展最有效领域。2001年,3-位催化不对称合成的研究学者,Knowles, Sharpless和Noyori获得诺贝尔化学奖就是例证。不对称合成各种方法是相互补充的[31]根据实际需求,选择不同方法不对称合成,提供各种不同目标化合物[32]。进而催化不对称合成的研究中,除了由金属催化外,也出现有机小分子催化[33]。应用各种手性辅助剂不对称反应,反应过程中要引入和除去手性辅助剂,额外增加了两步。但是在需要小量样品, 如初步药理筛选仅需要小量样品,使用手性模板,即反应后手性辅助剂部分结合至反应产物(上述若干例子中辅助剂上氮原子上取代基改变后,结合到反应产物中而辅助剂本身无法回收)也是可以选用的方法之一。
Eliel敎授的研究首先是清晰的认定目标,然后是‘坚持’。他指出在科学领域,甚至最好的设计思想也经常末达到,要及时变换你的方法,判断成为合理性的过程。如果你立刻放弃,就根本得不到任何东西。除了自己提出方案还要与他人讨论听取意见,最后权衡各因素作出调整决定。
从基础研究到推广应用往往需要多年的工作积累。想短期内基础研究取得成果的机会是少的,要长期的不断努力。另外,他讲述自己研究的习惯是扩展思路,了解世界上科学发展情况,甚至离开实验室不直接做研究还是阅览各种期刋。以便在谈论、写书或评审稿件时,知悉各种新进展,否则是学术僵化[34]。
讲到要保持技术领先,基础研究是至关重要的。Eliel得到美国化学会中最高级的Priestley奖[35],他得奖演讲中谈到基础研究的重要意义[36]。强调基础研究中他同时也谈到“偶然性”,例举了1946年美国物理学家F.Bloch和E.M.Purcell独立核磁共振研究,发现核磁矩和顺磁现象,1952年获得诺贝尔物理奖。不久之后其他科学家发现可应用于检测化学结构的质子和碳-13,为化学工作者提供了分子结构讯息。随后科学家应用3D技术,核磁共振能够显现动物和人类的器官,观察其机能。没有早期物理家的基础研究,就不会有现今的应用奇迹。Eliel还举了不少例子,如作为延迟艾滋病药物的AZT,它是在上世纪六十年代筛选癌症化疗药物时合成、但被筛选掉的。但是20年后发现它有效抑制了逆转录酶病毒。这些都是了历史上的基础研究和技术应用相互交织的范例。可见基础研究成是成为应用技术结果的先驱力量。 当然我们在基础研究中要经得起‘失败’的考验,新药开发中成功率不高,要经受‘失败’的准备,但没有前期的工作,也没有AZT的“偶然性”。据报导美国FDA统计进入临床一期的药物,最终获得批准上市的成功率不足10%。我们每个做基础研究人不是都能变成‘大咖’,但总有人能‘冒泡’。
Eliel不仅回忆现今的技术应用许多都是二次大战前后的基础研究的成果,更是预警了将来的若干问题。如能源问题,石油资源终将会耗尽,他提出了核能是否为将来的安全能源?还有癌症的治疗,气候变化预报等诸多问题。他强调要增加基础研究投资,并提出要促进研究单位和工业单位加强合作。Eliel又进一步指出当今化学家面临的挑战:化学仍然是主要的科学,然而它振奋人心的范围已经向着外围进展,如材料科学,环境化学或化学生物学。我们能看到近年来诺贝尔奖化学奨获得者并非纯化学研究,似乎是交义学科居多。此外,哈佛大学的化学系二十多年前,就改为化学和化学生物系了。保持化学的核心的存在,还要转向这些前沿的交叉领域科学。另外一个问题是一般公众缺乏对科学理解,需要进一步扩大宣传,这是科学工作者的应尽责任。
我们广大科技工作者要从国家的需要出发,在核心领域加强原创性,以坚定的决心,面对世界科技前沿,努力实现高水平科技自立自强。
Eliel在他的职业领域众多贡献,包括立体化学和构象分析研究影响众多的化学工作者, 他从事专业教学50年,培养了上百位博士生和博士后研究人员,科学著作除了前面述及的敎科参考书,从1967起组织出版20多卷“Topics in Stereochemistry”,包含了立体化学的各方面进展前沿,并发表了近300篇研究论文[37]。还在通俗的 J Chem Edu上曾发表十余篇普及文章,例如1971年的关于化学命名的文章[38],讲述了他的1962敎科书出版后十年间立体化学命名的重要进展。Eliel在美国国内和国际上获得了许多奖项,1972年他成为美国科学院院士。从上世纪50年代起他长期在美国化学会中担任多个职务,1985~1993年任美国化学会董事会成员,其中1987~1989年任主席。1992年当选为美国化学会会长[39]。
在推进全球化加强国际化学交流中, 他在世界各国用英文,徳文或西班牙语做报告,进行学术交流。上世纪八十年代中曾经访问中国,我在上海有机化学研究所听过他的不对称合成的报告。
2016年,在Eliel敎授去世8年后,美国化学会在费城秋季全国会议举办了专题讨论会“Connectivity and Global Reach of Chemistry: Honoring the Life and Scientific Contributions of Ernest L. Eliel”,为纪念他在有机立体化学尤其构象分析的科学贡献,以及作为美国化学会的领导,认识到全球化的重要,促进化学的国际交流所作的贡献。会后,美国化学会出版专题论文集辑“Stereochemistry and Global Connectivity: The Legacy of Ernest L. Eliel”1257和1258卷[40], 书中总结Eliel敎授他的立体化学和化学交流全球化的二大突出贡献,尤其提到他的立体化学敎科书影响了几代有机化学工作者。
书中Eliel的好友Seeman博士准备了第一手资料详细敍述他一生的成长,包括科学专业贡献以及服务于社会推动国际化学专业交流。我也从他的回忆中,深入解了Eliel专业生涯外和他的传奇人生[41]。此外,Eliel在美国化学会长期工作,特别在担任化学会会长期间,依靠他能掌握西班牙语,扩大加强与拉丁美洲各国化学界联系,尤其克服障碍促进和古巴的联系,被古巴的科学家记录在论文集中[42]。
在Eliel敎授实验室,我学会了操作高分辨核磁共振仪,并发表了两篇论文。其中氢谱和碳谱均为自己动手完成的测试。通常自己当天分析出谱,提高了工作效率。以后还学会DEPT技术以及质子和碳-13二维相关图谱操作,对证明分子结构极有帮助。
回国后我调往上海药物所工作,针对于国际上兴起更有效和安全的单独立体异构体上市的趋势,综述了手性药物的发展[6]。 针对国内有机敎科书立体化学术语中若干问题,写了综述有机立体化学中若干术语和命名的讨论[43], 在起草中, 我有些问题询问过他,不久他详细回复我问题。在我们自己执行不对称合成中,综述了不对称有机合成和反应的分类[31]。阅读了Eliel指出的不适当的立体化学命名[44]等有关文章后,针对‘手性’术语的过度使用,与吴毓林合作讲述立体化学术语‘手性’及其应用范围[45]。由中国化学会有机化合物命名审定委员会组织的“有机化合物命名原则(1997)”,我参与起草了其中第七章立体化学的内容[46]。
谨以此文回忆Eliel教授的所作的若干有机立体化学中卓越的贡献和影响,以及介绍他在全球化学交流中的作用,纪念他的壹佰周年诞辰。
致谢:首先非常感谢美国友人Jeffrey I. Seeman博士赠送的大量资料,使我能够更深切地了解Eliel敎授。其次要感谢多位同事和学生在文献查询方面提供的帮助。没有他们的协助,我无法完成此文。
