十二烷基硫醇催化合成2-芳基苯并呋喃
2021-11-13万顺莉梅青刚杨海君
万顺莉, 王 淳, 梅青刚, 杨海君,
(1. 中国科学院 成都生物研究所,四川 成都 610041; 2. 绵阳师范学院 生命科学与技术学院,四川 绵阳 621000; 3. 西南科技大学 材料科学与工程学院,四川 绵阳 621010; 4. 中国科学院大学,北京 100049)
2-芳基苯并呋喃作为一种重要的杂环芳烃化合物,具有多种生物活性,如抗癌[1-2]、抗病毒[3]、抗炎[4-5]、抗氧化[6-7]等,在野生鹰嘴豆、牛肝草、桑树等多种植物中均有发现[8-10]。然而,这些植物中的2-芳基苯并呋喃含量低、分离纯化难度较大。因此,通过化学合成途径获取结构多样的2-芳基苯并呋喃类化合物,并进一步研究其构效关系,有利于对该类化合物药用价值的开发。
目前通过不同前驱体合成2-芳基苯并呋喃的方法已有较多报道,包括2-炔基苯酚的环化法[11],邻羟基二芳基乙烯的氧化环合法[12],一锅串联催化卤代芳烃和卤代酚[13],铜催化脱羧分子内碳-氧偶联[14]等。其中,邻羟基二芳基乙烯的氧化环合法,因合成路线短而受到广泛关注。该方法的关键在于使用不同的氧化剂构建2-芳基苯并呋喃骨架。目前多采用DDQ、m-CPBA/TsOH、 I2/K2CO3等3种氧化系统[15-17],但均存在局限性。例如,采用DDQ氧化存在后处理操作复杂的缺点;采用m-CPBA/TsOH的催化体系只适用于不含有给电子基的底物,限制了底物适用范围;采用I2/K2CO3氧化同样存在底物普适性不广的弊端。

Scheme 1
十二烷基硫醇作为一种重要的化工原料,常用做自由基聚合的调节剂。前期研究表明,十二烷基硫醇可用作邻羟基二芳基乙烯环合的催化剂,构建2-芳基苯并呋喃骨架,并且能解决现有方法存在的操作复杂、底物普适性不广等问题,并且该方法未见文献报道。
本文以邻羟基二芳基乙烯衍生物为底物(1),以十二烷基硫醇(C12H25SH)为催化剂,在无溶剂、氧气氛围的条件下,合成了一系列2-芳基苯并呋喃类化合物(2, Scheme 1, Table 1),产物结构经1H NMR、13C NMR、 HR-MS(ESI)和LR-MS(APCI)确证。

表1 底物拓展
1 实验部分
1.1 仪器与试剂
Bruker Ascend III 400 MHz型核磁共振仪(DMSO-d6或CDCl3为溶剂,TMS为内标);Waters Vion IMS QTOF型高分辨质谱仪;Waters Xevo TQ型低分辨质谱仪。
苯硫酚,分析纯,西亚试剂;其余所用试剂均为分析纯。
1.2 合成
(1)1的合成[18](以1a为例)
向干燥的两颈烧瓶中加入锌粉2.67 g(41.00 mmol),密封脱气,在氩气保护下加入无水四氢呋喃50 mL,冷却至-5 ℃,用注射器缓慢加入四氯化钛2.25 mL(20.50 mmol),缓慢升温至20 ℃,搅拌反应30 min;加热至回流,反应2.5 h。将反应液降温至-5 ℃,加入水杨醛855 μL(8.20 mmol)和苯甲醛1.01 mL(9.80 mmol)的四氢呋喃混合溶液,升温至回流,反应20 h(TLC监测)。冷却至室温,加入50 mL 10%NaHCO3溶液,用乙酸乙酯(3×50 mL)萃取,合并有机相,用无水硫酸钠干燥,过滤,滤液减压蒸除溶剂,粗品经硅胶柱层析(洗脱剂:乙酸乙酯/石油醚=1/15,V/V)纯化得白色固体1a560 mg,产率56%;1H NMR(400 MHz, CDCl3)δ: 7.56(d,J=7.5 Hz, 3H), 7.45~7.33(m, 3H), 7.32~7.10(m, 3H), 6.98(t,J=7.5 Hz, 1H), 6.84(d,J=8.0 Hz, 1H), 5.03(s, 1H);13C NMR(101 MHz, CDCl3)δ: 152.98, 137.57, 130.18, 128.67, 127.63, 127.24, 126.55, 124.67, 122.98, 121.17, 115.92; HR-MS(ESI)m/z: Calcd for C14H11O{[M-H]-}195.0815, found 195.0820。
(2)2a~2k的合成(以2a为例)
向15 mL单口反应管中加入(E)-2-苯乙烯基苯酚(1a)100 mg(0.50 mmol)和十二烷基硫醇200 μL(1.00 mmol),氧气氛围下于140 ℃搅拌反应24 h(TLC监测)。用10 mL饱和NaHCO3溶液淬灭反应,用乙酸乙酯(3×15 mL)萃取,合并有机相,依次用饱和食盐水(2×10 mL)洗涤,无水硫酸钠干燥,过滤,滤液减压蒸馏,粗品经硅胶柱层析(洗脱剂:乙酸乙酯/石油醚=1/10,V/V)纯化得白色固体2a80 mg,产率80%。
用类似的方法合成2b~2k。
2-苯基苯并呋喃(2a): 白色固体,产率80%;1H NMR(400 MHz, DMSO-d6)δ: 7.94(d,J=7.5 Hz, 2H), 7.67(d,J=7.6 Hz, 1H), 7.64(d,J=8.2 Hz, 1H), 7.52(t,J=7.6 Hz, 2H), 7.46(s, 1H), 7.42(t,J=7.4 Hz, 1H), 7.37~7.30(m, 1H), 7.27(t,J=7.4 Hz, 1H);13C NMR(101 MHz, DMSO-d6)δ: 155.63, 154.68, 130.19, 129.53, 129.34, 129.28, 125.12, 125.08, 123.72, 121.64, 111.59, 102.48; HR-MS(ESI)m/z: Calcd for C14H11O{[M+H]+}195.0804, found 195.0799。
2-(4-甲氧基苯基)苯并呋喃(2b): 白色固体,产率85%;1H NMR(400 MHz, DMSO-d6)δ: 7.87(d,J=8.8 Hz, 2H), 7.61(t,J=8.5 Hz, 2H), 7.27(m, 3H), 7.08(d,J=8.8 Hz, 2H), 3.83(s, 3H);13C NMR(101 MHz, DMSO-d6)δ: 160.26, 155.87, 154.47, 129.57, 126.73, 124.48, 123.59, 122.86, 121.23, 114.99, 111.39, 100.64, 55.77; HR-MS(ESI)m/z: Calcd for C15H13O2{[M+H]+}225.0910, found 225.0903。
7-甲氧基-2-苯基苯并呋喃(2c): 淡黄色固体,产率76%;1H NMR(400 MHz, DMSO-d6)δ: 7.92(d,J=7.2 Hz, 2H), 7.52(t,J=7.6 Hz, 2H), 7.43(s, 1H), 7.41(d,J=7.4 Hz, 1H), 7.26~7.16(m, 2H), 6.97~6.94(m, 1H), 3.98(s, 3H);13C NMR(101 MHz, DMSO-d6)δ: 155.58, 145.39, 143.76, 130.84, 130.16, 129.53, 129.29, 125.08, 124.47, 113.71, 107.62, 102.78, 56.26; HR-MS(ESI)m/z: Calcd for C15H13O2{[M+H]+}225.0910, found 225.0910。
2-(4-氯苯基)-7-甲氧基苯并呋喃(2d): 淡黄色固体,产率45%;1H NMR(400 MHz, DMSO-d6)δ: 7.96~7.90(m, 2H), 7.61~7.54(m, 2H), 7.48(s, 1H), 7.26~7.16(m, 2H), 6.97~6.95(m, 1H), 3.98(s, 3H);13C NMR(101 MHz, DMSO-d6)δ: 154.42, 145.40, 143.84, 133.72, 130.73, 129.59, 129.04, 126.80, 124.60, 113.80, 107.84, 103.51, 56.27; HR-MS(ESI)m/z: Calcd for C15H12O235Cl{[M+H]+}259.0515, found 259.0520; Calcd for C15H12O237Cl{[M+H]+}261.0491, found 261.0489。
5-氯-2-(4-氯苯基)苯并呋喃(2e): 白色固体,产率 72%;1H NMR(400 MHz, DMSO-d6)δ: 7.95(d,J=8.6 Hz, 2H), 7.76(d,J=2.1 Hz, 1H), 7.68(d,J=8.7 Hz, 1H), 7.59(d,J=8.6 Hz, 2H), 7.49(s, 1H), 7.36(dd,J=8.7, 2.2 Hz, 1H);13C NMR(101 MHz, DMSO-d6)δ: 156.09, 153.24, 134.26, 130.84, 129.68, 128.58, 128.21, 127.07, 125.22, 121.15, 113.23, 102.88; LR-MS(APCI)m/z: Calcd for C14H935Cl2O{[M+H]+}263.00, found 262.89; Calcd for C14H935OCl37Cl{[M+H]+}265.00, found 264.73; Calcd for C14H9O37Cl2{[M+H]+}267.00, found 267.05。
2-(4-氟苯基)苯并呋喃(2f): 白色固体,产率40%;1H NMR(400 MHz, DMSO-d6)δ: 8.02~7.94(m, 2H), 7.68~7.62(m, 2H), 7.43(s, 1H), 7.40~7.23(m, 4H);13C NMR(101 MHz, DMSO-d6)δ: 162.74(d,JC-F=242.9 Hz), 154.76, 154.67, 129.29, 127.38(d,JC-F=8.4 Hz), 125.07, 123.75, 121.63, 116.59(d,JC-F=22.0 Hz), 111.57, 102.35; HR-MS(ESI)m/z: Calcd for C14H10OF{[M+H]+}213.0710, found 213.0709。
5-氯-2-苯基苯并呋喃(2g): 白色固体,产率91%;1H NMR(400 MHz, DMSO-d6)δ: 7.91~7.85(m, 2H), 7.57(d,J=2.0 Hz, 1H), 7.52~7.44(m, 3H), 7.41(t,J=7.4 Hz, 1H), 7.26(dd,J=8.7, 2.1 Hz, 1H), 6.99(s, 1H);13C NMR(101 MHz, DMSO-d6)δ: 157.39, 153.25, 130.58, 129.96, 129.01, 128.87, 128.48, 125.06, 124.40, 120.43, 112.13, 100.81; LR-MS(APCI)m/z: Calcd for C14H9O35ClNa{[M+Na]+}251.02, found 251.11; Calcd for C14H9O37ClNa{[M+Na]+}253.02, found 253.04。
7-甲氧基-2-(4-甲氧基苯基)苯并呋喃(2h): 白色固体,产率87%;1H NMR(400 MHz, DMSO-d6)δ: 7.84(d,J=8.9 Hz, 2H), 7.25(s, 1H), 7.19~7.13(m, 2H), 7.07(d,J=8.9 Hz, 2H), 6.92~6.90(m, 1H), 3.97(s, 3H), 3.83(s, 3H);13C NMR(101 MHz, DMSO-d6)δ: 160.23, 155.81, 145.28, 143.46, 131.13, 126.69, 124.33, 122.85, 114.98, 113.41, 107.17, 100.95, 56.22, 55.76; HR-MS(ESI)m/z: Calcd for C16H14O3Na{[M+Na]+}277.0835, found 277.0832。
2-(萘-2-基)苯并呋喃(2i): 淡黄色固体,产率49%;1H NMR(400 MHz, DMSO-d6)δ: 8.48(s, 1H), 8.09~8.01(m, 3H), 7.98~7.94(m, 1H), 7.73~7.65(m, 2H), 7.61~7.54(m, 3H), 7.40~7.33(m, 1H), 7.30(t,J=7.4 Hz, 1H);13C NMR(101 MHz, DMSO-d6)δ: 155.69, 154.86, 133.47, 133.35, 129.37, 129.15, 128.84, 128.19, 127.56, 127.36, 127.23, 125.26, 123.78, 123.71, 123.21, 121.72, 111.58, 103.25; HR-MS(ESI)m/z: Calcd for C18H13O{[M+H]+}245.0961, found 245.0959。
2-(4-氯苯基)-5-甲基苯并呋喃(2j): 白色固体,产率40%;1H NMR(400 MHz, DMSO-d6)δ: 7.93(d,J=8.6 Hz, 2H), 7.57(d,J=8.6 Hz, 2H), 7.51(d,J=8.4 Hz, 1H), 7.45(s, 1H), 7.42(s, 1H), 7.18~7.12(m, 1H), 2.41(s, 3H);13C NMR(101 MHz, DMSO-d6)δ: 154.53, 153.20, 133.63, 132.80, 129.57, 129.28, 129.19, 126.74, 126.54, 121.44, 111.18, 103.03, 21.38; LR-MS(APCI)m/z: Calcd for C15H12O35Cl{[M+H]+}243.05, found 242.95; Calcd for C15H12O37Cl{[M+H]+}245.05, found 244.84。
2-(4-氯苯基)苯并呋喃(2k): 白色固体,产率42%;1H NMR(400 MHz, DMSO-d6)δ: 7.95(d,J=8.6 Hz, 2H), 7.68(d,J=7.5 Hz, 1H), 7.64(d,J=8.1 Hz, 1H), 7.58(d,J=8.6 Hz, 2H), 7.51(s, 1H), 7.35(t,J=7.1 Hz, 1H), 7.28(t,J=7.2 Hz, 1H);13C NMR(101 MHz, DMSO-d6)δ: 154.74, 154.47, 133.77, 129.61, 129.17, 129.08, 126.84, 125.38, 123.85, 121.79, 111.65, 103.24; LR-MS(APCI)m/z: Calcd for C14H9O35ClNa{[M+Na]+}251.02, found 251.11; Calcd for C14H9O37ClNa{[M+Na]+}253.02, found 252.97。
2-(4-(三氟甲基)苯基)苯并呋喃(2l): 白色固体,产率28%;1H NMR(400 MHz, CDCl3)δ: 7.99(d,J=8.2 Hz, 2H), 7.72(d,J=8.3 Hz, 2H), 7.65(d,J=7.6 Hz, 1H), 7.58(d,J=8.1 Hz, 1H), 7.37(t,J=7.7 Hz, 1H), 7.29(t,J=7.5 Hz, 1H), 7.16(s, 1H);13C NMR(101 MHz, CDCl3)δ: 155.12, 154.20, 133.71, 130.10(q,J=32.6 Hz), 128.83, 125.81(q,J=3.8 Hz), 125.11, 124.97, 124.07(q,J=273.10 Hz), 123.27, 121.32, 111.37, 103.27; LR-MS(APCI)m/z: Calcd for C15H10OF3{[M+H]+}263.06, found 262.92。
2-(4-甲基苯基)-5-甲基苯并呋喃(2m): 白色固体,产率81%;1H NMR(400 MHz, CDCl3)δ: 7.78(d,J=8.2 Hz, 2H), 7.42(d,J=8.3 Hz, 1H), 7.38(s, 1H), 7.31~7.25(m, 2H), 7.11(d,J=8.3 Hz, 1H), 6.93(s, 1H), 2.48(s, 3H), 2.43(s, 3H);13C NMR(101 MHz, CDCl3)δ: 156.27, 153.21, 138.45, 132.25, 129.47(3C), 127.91, 125.26, 124.82(2C), 120.60, 110.58, 100.35, 21.41, 21.38; HR-MS(ESI)m/z: Calcd for C16H15O{[M+H]+}223.1117, found 223.1122。
7-甲氧基-2-(4-甲基苯基)苯并呋喃(2n): 白色固体,产率79%;1H NMR(600 MHz, CDCl3)δ: 7.78(d,J=8.2 Hz, 2H), 7.24(d,J=8.0 Hz, 2H), 7.18~7.12(m, 2H), 6.95(s, 1H), 6.80~6.79(m, 1H), 4.05(s, 3H), 2.39(s, 3H);13C NMR(151 MHz, CDCl3)δ: 156.34, 145.28, 143.99, 138.57, 131.07, 129.39, 127.61, 125.00, 123.49, 113.21, 106.58, 100.87, 56.17, 21.35; HR-MS(ESI)m/z: Calcd for C16H15O2{[M+H]+}239.1067, found 239.1067。
2 结果与讨论
2.1 反应条件优化
以1a为模板反应底物,对反应条件进行了优化,结果见表2。首先对催化剂十二烷基硫醇的用量进行了筛选(表2, Entries 1~4),当用量为2 eq.时催化效果最好(表2, Entry 3)。随后对溶剂进行了筛选,当以DMSO为溶剂时产率较低,换用DMF作溶剂时几乎没有产物生成,结果发现,在无溶剂条件下该反应产率较高(表2, Entries 3, 5 and 6)。最后,考察了反应时间的影响,发现反应24 h产率最高,延长反应时间,产率并没有明显变化(表2, Entries 3, 7 and 8)。值得注意的是,反应需要在有氧的条件下反应,无氧条件下只有极少量的产物生成(表2, Entry 9), 而且氧气浓度越高,反应效果越好(表2, Entries 3 and 10)。
考察了以芳基硫醇为催化剂对反应的影响,选用苯硫酚(PhSH)、苄硫醇(BnSH)两种芳基硫醇,发现分别以两种芳基硫醇为催化剂催化1a,都没有2-芳基苯并呋喃产物2a的生成(表2, Entries 11 and 12)。
因此,最佳的反应条件为:在氧气氛围、无溶剂条件下,十二烷基硫醇(2 eq.)做催化剂, 反应24 h。与现有邻羟基二芳基乙烯的氧化环合法的条件相比,该方法具有操作简单、底物普适性广以及反应体系单一的优点。
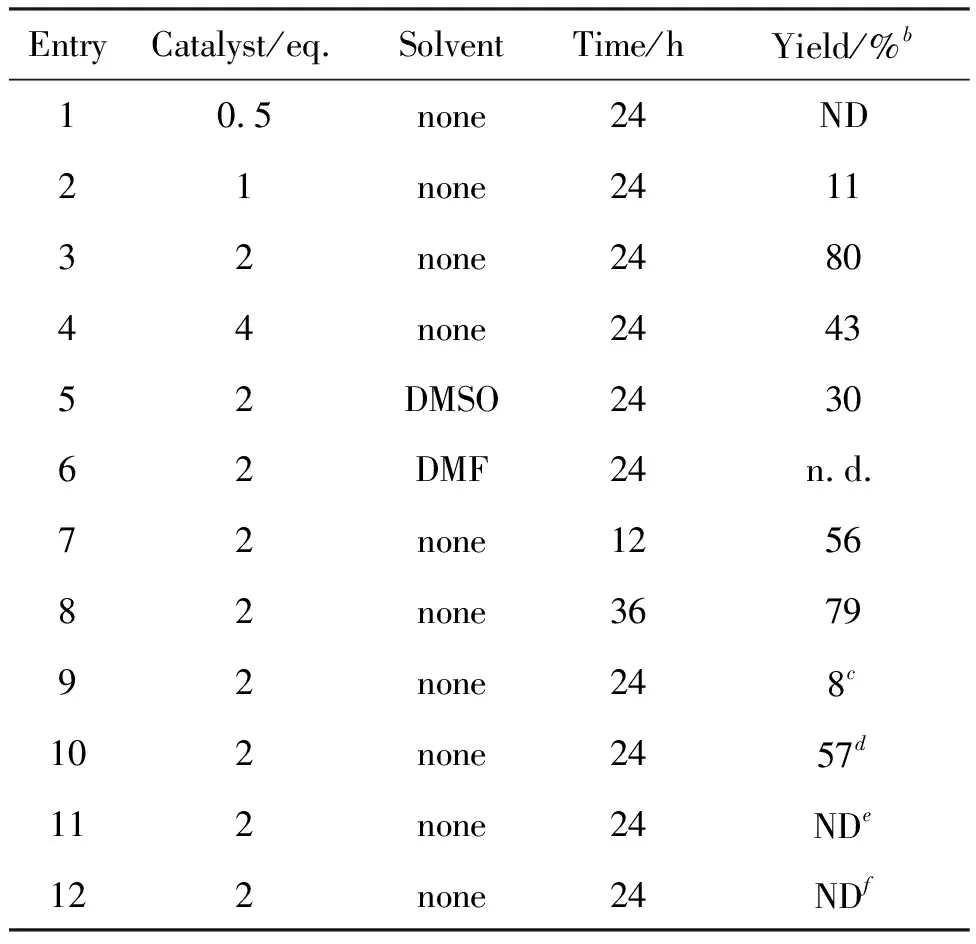
表2 反应条件的优化a
2.2 底物扩展
首先考察了取代基对反应的影响。当A环有吸电子基取代,如R为氯,产率较高(表1, Entry 7); A环有供电子基取代,如甲基和甲氧基,对产率的影响不明显(表1, Entries 1 and 3, 10 and 11)。相对于B环无取代的底物,B环上有供电子基取代的邻羟基二芳基乙烯能以高产率转化得到2-芳基苯并呋喃(表1, Entries 1 and 2); 而当B环上有吸电子基取代,如氯、氟或三氟甲基时,产率会明显降低(表1, Entries 6, 11 and 12)。随后对位阻进行了考察,当B环连有较大位阻的取代基时,仍能转化得到2-芳基苯并呋喃,但相对B环无取代时产率会下降(表1, Entry 9)。上述结果表明,该反应的底物普适性较好。探索取代基的影响,结果表明,A环吸电子取代,B环供电子取代的邻羟基二芳基乙烯反应效果最好; 对位阻影响的探究,结果显示,当B环连有大位阻取代基时,反应的产率会下降。
以邻羟基二芳基乙烯为底物,十二烷基硫醇为催化剂,在无溶剂、氧气氛围的条件下合成了14种2-芳基苯并呋喃类化合物。与现有的邻羟基二芳基乙烯的氧化环合法相比,该方法具有操作简单、底物普适性好且反应体系单一等优点,为巯基催化合成2-芳基苯并呋喃类化合物提供了新思路。
