脂质组学在慢性肾病研究中的应用
2021-11-13高芯李长印段徐彬丁选胜
高芯,李长印,段徐彬,丁选胜
(1. 南京医科大学附属妇产医院 南京市妇幼保健院药学部,江苏 南京 210004;2. 南京中医药大学附属医院临床药理实验室,江苏 南京 210029;3. 中国药科大学基础医学与临床药学学院,江苏 南京 211198)
慢性肾病(chronic kidney disease,CKD)是由多种原因引起的肾脏结构与功能的慢性障碍,包括肾小球的病理损伤、血液或尿液成分异常、估计肾小球滤过率(estimated glomerular filtration rate,eGFR)下降超过3个月[1]等。各种原发性、继发性肾脏疾病或肾损伤均可导致CKD。尽早发现疾病、定期监测肾功能并对症治疗对于CKD及其并发症的治疗至关重要。目前,临床上常用的肾功能标志物为血肌酐、尿蛋白-肌酐比率与eGFR,但这三者对检测早期阶段肾病均不够敏感[2]。故研究机体代谢物的水平和功能变化对CKD的机制及新型治疗策略的研究具有重要意义[3]。
近年来,CKD与脂质代谢的关系开始被广泛关注。脂质是生物体的基本组成物质之一,也是人体内极为重要的一类代谢产物。研究表明,肾脏对物质的分解、合成和代谢功能与脂质代谢关系密切,在CKD疾病状态下,机体会发生多种脂质代谢紊乱[1,4]。脂质组学是利用分析化学的原理和技术对生物体内脂质进行研究的一门学科[5],于2003年由Han等[6-7]提出,随着质谱分析技术的不断革新,这一新兴学科发展迅速。脂质组学能够通过单个脂质的变化来研究细胞代谢,为研究疾病状态下的脂质代谢变化提供了强大的技术支持[8]。近年来,脂质组学在CKD相关疾病研究中的应用日益广泛,脂类代谢物在CKD的诊断、治疗中的重要性逐渐受到关注。本文对近6年(2015—2020年)应用脂质组学技术开展的CKD相关研究进行综述,同时也涉及了与慢性肾功能障碍表现类似的肾脏老龄化和药物性肾损害,以期为相关研究提供参考。
1 文献检索与分析
在中国知网数据库中进行中文文献检索,未检索到摘要中同时含有“慢性肾病”和“脂质组学”的期刊文献。在PubMed数据库中进行英文文献检索:文献发表时间设定为2015年1月1日至2020年12月31日;在摘要Abstract中搜索同时出现lipidomics/lipidomic/lipidome和chronic kidney disease/chronic renal disease/chronic nephropathy的文献,去重后得关键词包含“慢性肾病”和“脂质组学”的研究文献共31篇(见表1)。结果表明:“脂质组学”在英文文献中常用lipidomics表示,出现lipidomic的文献中多数也会出现lipidomics一词;而“慢性肾病”更多地用“chronic kidney disease”表示,“chronic renal disease”次之,“chronic nephropathy”最少。
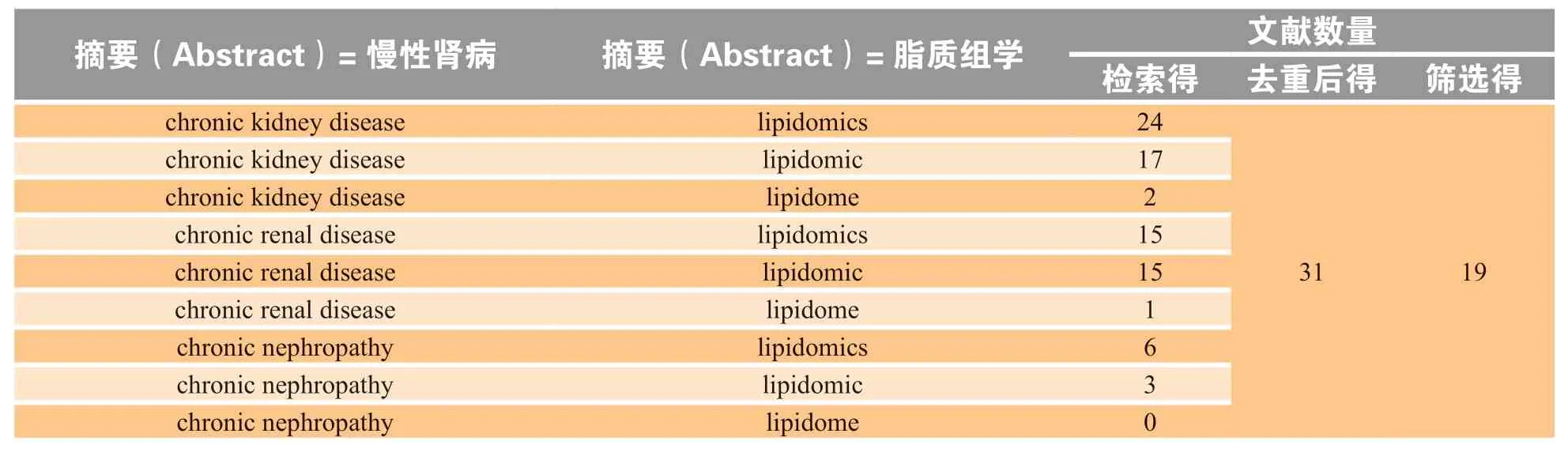
表1 PubMed数据库中2015—2020年脂质组学与慢性肾病相关文献数量Table 1 Numbers of published papers in PubMed database associated with lipidomics-based study of chronic kidney disease from 2015 to 2020
进一步对31篇文献按如下标准进行筛选。纳入标准:1)样本为生物样品(组织、血清、血浆等);2)采用脂质组学技术平台[气相色谱-质谱联用技术(GC-MS)、液相色谱-质谱联用技术(LC-MS)、磁共振等];3)选择和评估出适当的生物标志物(单变量分析、多变量分析等);4)有生物标志物的评价指标[准确性、敏感度、特异度、受试者工作特征曲线(ROC)下面积等]。排除标准:1)非对照实验;2)主要研究对象不是CKD类疾病;3)综述、信件、评论、会议海报或会议记录。经筛选后,共得19篇符合纳入和排除标准的CKD相关脂质组学文献。通过提取研究的基本信息(第一作者、发表年份)、样品特征(患者/实验动物样品类型、患者/实验样品数目、疾病状态、治疗过程等)、所采用的脂质组学平台(技术方法、靶向或非靶向)和研究结果(生物标志物、变化趋势),对19篇文献基本信息进行初步整理与分析(见表2)。2015—2020年,CKD相关的脂质组学研究呈逐年增多的趋势,涉及靶向和非靶向脂质组学,并以非靶向研究方式居多。研究所用的分析技术平台则以LC-MS为主;近6年来,基于脂质组学的CKD临床研究和动物实验研究交替出现,动物样本量6 ~ 48例不等,这与研究者选用的动物模型有关;临床样本量有逐渐增多的趋势,从20例到1 000余例,呈爆发式增长。研究样本多为血液或肾脏组织,尿液样本的研究较少。这19项研究多数集中于疾病标志物的发现,少数涉及治疗药物或方式的评估,发现的潜在生物标志物也不尽相同。
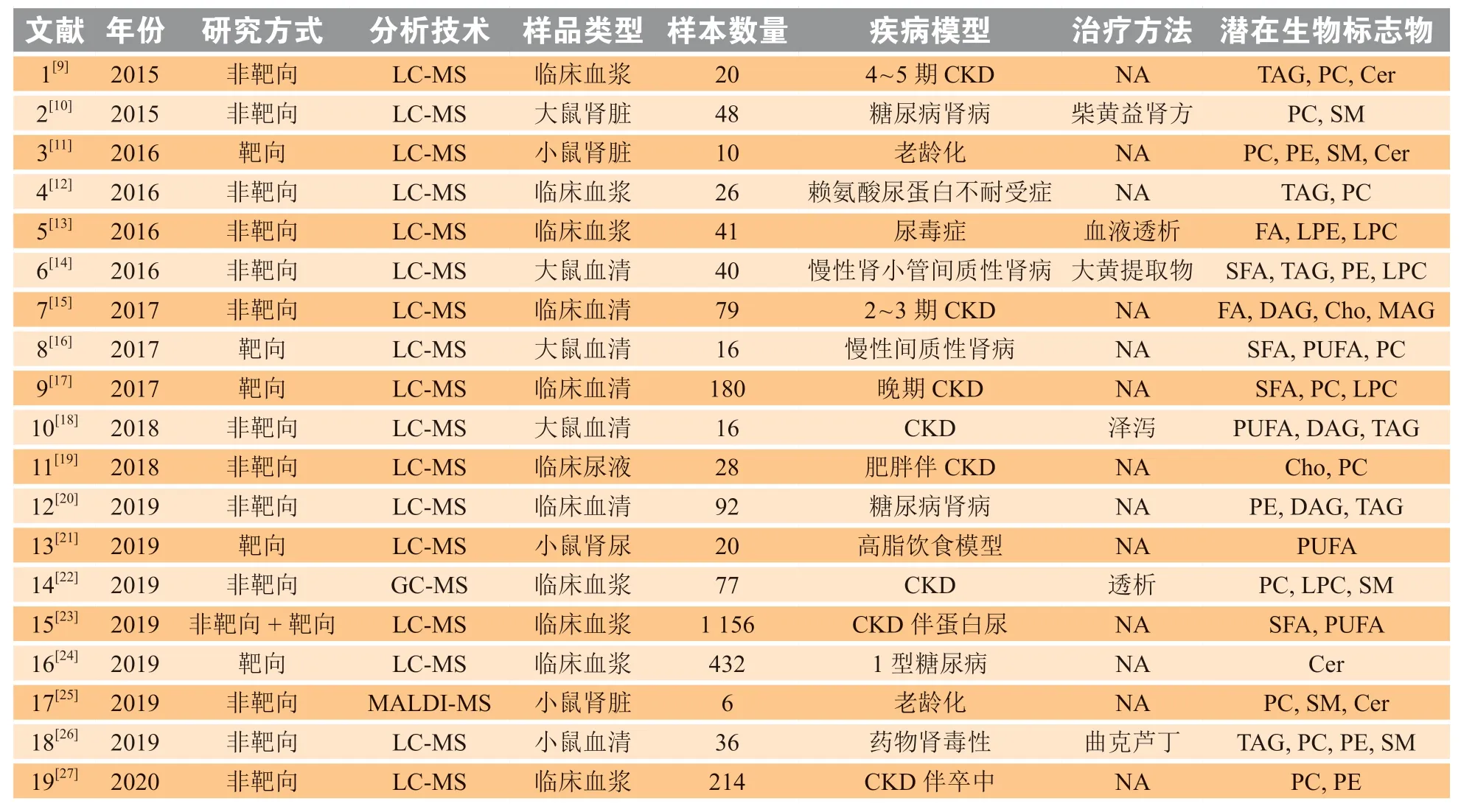
表2 慢性肾病相关脂质组学研究19篇文献基本信息Table 2 Basic information of 19 selected papers associated with lipidomics-based study of chronic kidney disease
2 脂质组学在慢性肾病中的应用
脂质是可溶于非极性有机溶剂的生物分子,通常不溶于水,其分子构成丰富多样,与机体内多个代谢途径和多种生物功能均有着密切的联系。在人体内,脂质参与了以能量储存和代谢为代表的复杂生理和生化过程[28-29]。此外,脂质也是细胞膜和锚蛋白的主要成分和信号传导分子[30-31]。根据结构及功能的不同,脂质可以分为脂肪酰基类、甘油酯类、磷脂类、鞘脂类、甾醇类、异戊烯醇类、糖脂类和聚酮类[32]。其中,前5类为人体内源性脂质[32-33],异戊烯醇类、糖脂类和聚酮类的脂质则多存在于植物及化学合成物中[32]。内源性脂质在生物转化过程中联系密切,互为前体,且它们与CKD均有着紧密的联系,故以下着重对这5类人体内源性脂质在CKD中的研究进展及脂质间相互的生物转化通路进行探讨。
2.1 脂肪酰基类脂质及其在慢性肾病中的脂质组学研究
脂肪酰基类脂质通常也被称为脂肪酸(fatty acid,FA)[28]。根据化学结构(见图1)是否含不饱和双键,FA可分为饱和脂肪酸(saturated fatty acid,SFA)和不饱和脂肪酸(unsaturated fatty acids,UFA)[28]。SFA可通过去饱和酶生成双键,从而转化为单不饱和脂肪酸(monounsaturated fatty acids,MUFA)和多不饱和脂肪酸(polyunsaturated fatty acids,PUFA),后者在一系列肾病相关的生物转化过程中发挥了重要作用[15]。依据化学结构的不同,PUFA通常根据从尾部(即非羧酸端)算起的首个双键的位置(ω)进行分类与命名[33],其中,ω-3 PUFA以及ω-6 PUFA为人体必需脂肪酸,是PUFA中最广为人知的家族。ω-3 PUFA以亚麻酸(α-linoleic acid,ALA)为母体,可以通过多步反应转化为二十碳五烯酸(eicosapentaenoic acid,EPA)、二十二碳六烯酸(docosahexaenoic acid,DHA)等下游代谢物,这些代谢产物可以通过不同途径降低人体内心血管疾病和炎症的发生概率[34]。ω-6 PUFA以亚油酸(linoleic acid,LA)为母体,可以通过脂氧合酶(lipoxygenase,LOX)、前列腺素内过氧化物合酶2(prostaglandin-endoperoxide synthase 2,PTGS2)或细胞色素P450等酶的反应进一步代谢成各类二十烷酸[34],例如花生四烯酸(arachidonic acid,AA)和二十碳三烯酸(epoxyeicosatrienoic acid,EET),这是2种被广泛研究的脂质信号前体。研究显示,AA和EET在炎症反应[34]和表观遗传学[35]等方面均发挥了独特的作用。
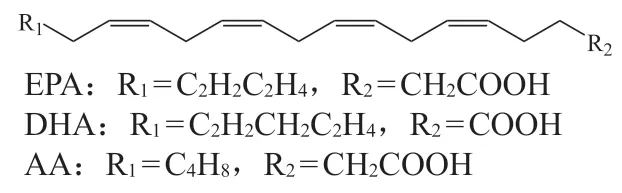
图1 脂肪酰基类脂质的化学骨架Figure 1 The chemical skeleton of fatty acyl lipids
研究表明,CKD可使大鼠血液中SFA水平发生显著变化[14-16]。Zhang等[14]研究发现,慢性肾功能衰竭大鼠的血浆中棕榈酸和蓖麻油酸水平明显降低。棕榈酸是动物中最常见的SFA之一,可诱导内质网应激反应,导致近端肾小管细胞系的凋亡和坏死。另有研究发现,给予中药大黄治疗可使慢性肾衰大鼠血浆中的棕榈酸恢复到正常水平,证实了药物可以通过改善SFA代谢紊乱而起到治疗CKD的作用[14]。Chen等[16]对慢性肾间质疾病模型的大鼠血清进行检测发现,包括四乙酸、十八碳酸在内的SFA含量较健康大鼠有显著性上升,这可能涉及核因子蛋白通路的激活,促炎性、促氧化和促纤维化蛋白的上调,转录因子Nrf2(NF-E2-related factor 2)活性及其下游抗氧化和细胞保护蛋白的下调。
血液中PUFA的水平在CKD状态下则通常呈下降趋势[19,24]。Feng等[23]通过靶向和非靶向的临床脂质组学研究,从1 156例CKD伴蛋白尿的患者血浆样品中鉴定出多种差异脂质,其中PUFA较健康对照者水平显著降低。Dou等[18]通过研究发现,CKD模型大鼠血清内的EPA,DHA以及8,9-EET显著性下调,证实了PUFA作为炎症因子在慢性肾功能损伤中起到了一定作用,这些发现可能与核因子κB(nuclear factor κB,NF-κB),Nfr2以 及 促纤维化信号通路的激活有关。与血液中情况不同,CKD或其相关疾病状态下的肾脏组织中PUFA水平多呈上调趋势。Decleves等[21]采用基于LC-MS的靶向脂质组学方法,测定了高脂饮食模型小鼠肾脏及血浆内PUFA的含量,结果表明:高脂饮食小鼠的血浆中DHA与EPA的含量较正常饮食组有所减少,DHA下游代谢物10-羟基二十二碳六烯酸、13-羟基二十二碳六烯酸、20-羟基二十二碳六烯酸等降低,AA水平呈上升趋势;而在高脂饮食小鼠的肾脏组织中,AA及DHA的含量均显著上升,认为可能是因为高脂饮食条件下肾脏磷脂酶的表达被上调,从而增加了肾脏中促炎AA和抗炎DHA的产生;高脂饮食状态下,小鼠肾脏中DHA衍生的LOX、细胞色素P450和非酶降解的代谢产物含量均有所增加,EPA衍生的LOX和非酶降解代谢产物含量减少,这种差异可能系部分DHA相关代谢物在肾脏局部合成,较少进入血液循环所致。
2.2 甘油酯类脂质及其在慢性肾病中的脂质组学研究
甘油酯主要通过激活细胞内的蛋白激酶,进而磷酸化一系列底物蛋白,产生相应的代谢产物[36-38]。由1,2或3个脂肪酰基与甘油进行酯化反应所产生的甘油酯,分别称为单酰甘油(monoacylglycerol,MAG)、二酰甘油(diacylglycerol,DAG)和三酰甘油(triacylglycerol,TAG),见图2。目前,针对MAG功能的研究比较少,DAG与TAG则被广泛研究。DAG参与了细胞膜的形成[39]和突触囊泡的周期反应[40],也可作为二级脂质信使,发挥如胰岛素信号转导等作用[41]。TAG则是人体主要的储能分子,参与脂肪酸及其他甘油酯的代谢过程[42]。
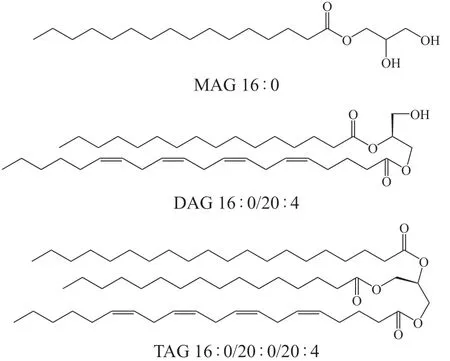
图2 甘油酯类脂质的化学骨架Figure 2 The chemical skeleton of glyceride lipids
在诸多研究[9,12,15,20]中,大部分DAG在CKD状态的血液中呈下调趋势,而多数TAG呈上调趋势。Dou等[18]在CKD模型大鼠血清中检测到,随着疾病的进展,TAG(46∶6,64∶9,60∶14,68∶12)含量显著性上升,DAG(44∶6,35∶1,40∶9,42∶4,46∶6)含量则呈显著性下降趋势;给予中药泽泻进行治疗可回调上述脂质的异常变化;CKD会引起血液中TAG水平升高,可能与脂蛋白脂肪酶和极低密度脂蛋白受体下调导致的TAG清除受损有关;而NF-κB信号通路的活化、促氧化和促炎活性的上调、Nrf2活性及其下游抗氧化剂和细胞保护蛋白的下调也同样会导致甘油酯代谢紊乱。Yang等[26]对曲霉素引起的药物肾脏脂质毒性进行研究发现,小鼠血清中长链FA、磷脂酰胆碱(phosphatidylcholine,PC)、磷脂酰乙醇胺(phosphatidylethanolamine,PE)等多种脂质水平显著升高,同时多种TAG(12∶0/16∶1/18∶2,18∶0/18∶1/18∶1,12∶0/16∶0/18∶2,14∶0/16∶0/18∶1)也呈上调趋势;推测TAG的形成主要受脂质积聚的影响,其上调同时也伴随着药物引起的肾毒性的增强。这些研究提示TAG可作为预测和监测CKD发生发展的潜在生物标志物。
2.3 磷脂类脂质及其在慢性肾病中的脂质组学研究
磷脂又称甘油磷脂,是组成细胞双分子层的关键成分,在细胞的生理功能[43]、内吞作用[44]和有丝分裂过程[45]中起重要作用。磷脂的一端为含磷的亲水端,另一端为疏水亲油的长烃基链。根据磷脂甘油骨架和极性头部基团的不同,磷脂可分为不同的亚类,如甘油磷脂酸(phosphatidic acid,PA),磷脂酰丝氨酸(phosphatidylserine,PS),PE,PC等(见图3)。其中,溶血磷脂酸(lysophosphatidic acid,LPA)是相对分子质量最小、结构最简单的磷脂。此外,磷脂还可以充当信号分子,调节脂质代谢相关基因的表达[46]。磷脂可以被磷脂酶水解1个酰基,从而代谢成为溶血磷脂,后者表面活性较强,能使红细胞及其他细胞膜破裂,引起溶血或细胞坏死[45]。磷脂是肾脏脂质的主要成分,含量超过50%。在各类磷脂中,PC和PE与CKD发病的关系最为密切。

图3 磷脂类脂质的化学骨架Figure 3 The chemical skeleton of phospholipids
2.3.1 磷脂酰胆碱PC是真核细胞膜中最丰富的甘油磷酸脂,在细胞膜的构架中起关键性作用[47]。其参与机体的抗炎反应[48]、胆固醇代谢[49]和神经元分化[50]。溶血磷脂酰胆碱(lysophosphatidylcholine,LPC)是血液中含量最丰富的溶血磷脂,其水平与线粒体主要功能(如氧化率)的变化和线粒体的通透性密切相关[51]。饱和的LPC可致白细胞外渗和促炎介质的形成,从而引发炎症反应,而多不饱和LPC如LPC 20∶4和LPC 22∶6等可抑制炎症反应[9,52]。研究显示,与健康对照组相比,糖尿病肾病大鼠模型[11]和老龄化小鼠模型[11,15]肾脏样本中的PC均呈下调趋势,LPC水平则显著性增加。而在赖氨酸尿蛋白不耐受症导致肾损伤的患者[12]和晚期CKD患者[17]的血液样本,以及肥胖伴CKD患者[19]和肾小球硬化症患者[53]的尿液样本中,PC水平下调,LPC与磷脂酶A2(phospholipase A2,PLA2)水平显著性增加。
PLA2在肾功能不全和器官损伤中起着关键作用,它可以通过水解反应从PC中除去1个脂肪酰基,从而产生LPC;这一机制调节了PC的代谢,使得PC在酶的刺激下分解[14,17]。Noh等[25]基于基质辅助激光解吸电离质谱成像技术平台对老龄化大鼠的肾脏进行研究发现,PLA2在老化的肾小球、管周毛细血管和血管内皮细胞中均高度表达,老龄化大鼠有典型的脂质沉积,从而导致肾脏中LPC水平显著升高。
2.3.2 磷脂酰乙醇胺PE是PC生物转化的前体,这类磷脂可以影响细胞膜拓扑结构,从而促进细胞膜的活化[20]。细胞培养实验表明,暴露于PE后,细胞膜会失去不对称的氨基磷脂,这会促进细胞的凋亡和自噬[27]。Zhang等[14]发现,慢性肾小管间质性肾病大鼠血清中多种PE(包括38∶1,38∶4,44∶1等)的含量较健康对照组均显著下调。Braun等[11]也发现,在老龄化肾脏组织中,PE(包括38∶4,38∶6,40∶6等)也显著性下调。由于PE在磷脂酰乙醇胺N-甲基转移酶的作用下可转化为PC,这些研究结果与上述CKD中PC的下调具有一致性。
PE并非在所有CKD中均呈下降趋势。Afshinnia等[20]检测了患有糖尿病肾病的美洲印第安人种的血清样本,结果显示,疾病进展程度较高的患者体内PE均有显著性上调,表明PE丰度和糖尿病肾病的进展呈正相关。该团队在前期研究中也从糖尿病肾病小鼠模型中发现了PE在肾小管细胞中的聚集[54],与该观察结果一致。随后,研究人员建立了疾病进展的风险预测模型,在该模型中,PE每增加1个标准差,疾病进展的风险增加1.78倍(95%CI:1.24 ~ 2.57,P= 0.002),证实PE可作为监测并预测早期糖尿病肾病疾病进展的生物标志物[20]。
2.4 鞘脂类脂质及其在慢性肾病中的脂质组学研究
鞘脂的化学结构特征是存在1个鞘氨醇基团(十八碳烯氨基二醇)(见图4)。这一复杂的化合物家族包括鞘氨醇(sphingosine,Sph)、神经酰胺(ceramide,Cer)、鞘磷脂(sphingomyelin,SM)、糖类鞘氨醇(脑苷)及各类的衍生物。其中,Cer是所有鞘脂的基本结构。鞘脂是真核细胞中的主要脂质之一,在细胞的多种生物学反应和细胞信号转导途径中发挥着重要的作用。鞘脂代谢紊乱与糖尿病、非酒精性脂肪性肝炎、肾脏疾病、心血管疾病、免疫和炎症过程以及神经退行性疾病有关[55]。其中,与CKD密切相关的鞘脂包括Cer与SM,二者也是血液循环中含量最丰富的鞘脂。
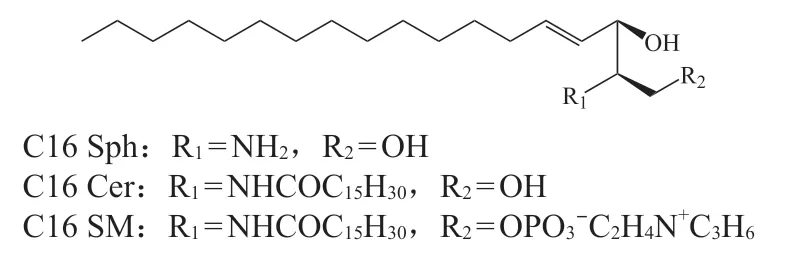
图4 鞘脂类脂质的化学骨架Figure 4 The chemical skeleton of sphingolipids
2.4.1 神经酰胺Cer又名酰基神经鞘胺醇,是一类由神经鞘氨醇和长链FA通过共价缩合而成的物质,当细胞受到紫外线照射、热击、化疗药物等外界条件刺激后,内源性的Cer开始合成并作为细胞内第二信使,参与细胞的增殖、分化和凋亡等多种生理、病理过程。冠心病、高血压、肥胖、糖尿病患者Cer水平升高,富含Cer的低密度脂蛋白可导致胰岛素抵抗,并促进炎症因子白细胞介素-6介导的巨噬细胞炎症反应[56-57]。老年小鼠肾脏内,Cer总量显著降低;老年肾髓质中酸性神经酰胺酶(Asah1)含量升高,可催化Cer降解[11,25]。Cer的减少可以改变细胞存活、凋亡、迁移和细胞骨架排列。其酶解产物的磷酸化形式S1P是5种G蛋白偶联受体的配体,已被证实可直接介导肾纤维化。因此,Cer水平的下调可能直接影响肾脏的衰老过程。
Lopes-Virella等[24]研究发现,随着1型糖尿病伴蛋白尿患者蛋白尿的进展,乳糖Cer(C24:1-L,C26-L和C26:1-L)显著性降低,但与eGFR变化无关;与维持持续正常肾功能的患者相比,1型糖尿病伴肾功能不全患者的己糖Cer C24:1-H呈下降趋势,而Cer C18-H,Cer C18:1-H,Cer C20-H,Cer C20:1-H以及Cer C26-H有所上调;糖尿病会导致多个组织中FA碳链延伸率下降,从而导致长链FA的形成减少,因此,长链Cer及其衍生物的水平也随之减少;该研究证实了一些长链Cer与蛋白尿的风险显著相关,血浆中Cer水平的变化能够预测1型糖尿病患者的蛋白尿的发生。目前,这些鞘脂在肾脏中的积聚是否与糖鞘脂在尿液中的排泄增加相关尚不明确,有待进一步研究。
2.4.2 鞘磷脂SM是真核细胞和血浆中含量最丰富的鞘脂。其是细胞膜的组成部分之一,参与了机体的炎症反应[58]、细胞死亡[55]和自噬过程[59]。SM是Cer的下游产物,是由Cer的C1羟基上连接了磷酸胆碱或磷酸乙醇胺构成的鞘脂,二者可通过鞘磷脂磷酸二酯酶和神经酰胺激酶相互转化[60]。
在CKD[11]、老龄化[11,25]及药物肾毒性[26]模型中,SM均呈下调趋势。Noh等[25]发现,在老龄化小鼠肾脏皮质中,Cer与SM水平显著降低,在肾髓质中则无明显差异。Braun等[11]亦发现,在老龄化小鼠的肾脏中Cer与SM的水平有所下调。Zhao等[10]对糖尿病肾病模型大鼠的肾脏进行研究发现,糖尿病肾病状态下SM(d18:1/16:1,d20:1/23:0,dC18:1/C16:0)均较健康对照组有显著性下调,给予柴黄益肾方治疗后则有所回调,推测SM异常可能与鞘脂代谢酶的异常表达有关。Yang等[26]通过脂质组学方法研究了曲霉素A的肾毒性,发现在模型小鼠肾脏中,SM(d16:1/25:0,d16:1/24:0,d16:1/25:1,d16:1/23:0)下调,而鞘磷脂酶(sphingomyelinase, SMase)上调,在给予曲克芦丁解毒后,SM与SMase均回调;SMase是SM和氯调节通道激活的上游调节剂,其上调可导致毒性的累积,曲克芦丁可能通过减轻SMase的上调和调控受损肾脏中氯调节通道的活化来改善曲霉素A的肾毒性。
2.5 甾醇类脂质及其在慢性肾病中的脂质组学研究
甾醇是由乙酰辅酶A合成的两亲性脂质,以稠合的四环结构作为核心(见图5)。甾醇参与细胞膜的合成,影响膜流动性和渗透性,并在多个生理过程中充当了信号分子和激素等作用[49]。人体中含量最多的甾醇是胆固醇,其可调节人体的多种生理功能状态[49]。
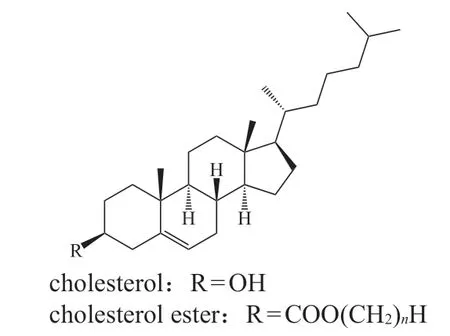
图5 甾醇类脂质的化学骨架Figure 5 The chemical skeleton of sterol lipids
目前,CKD相关研究中关于甾醇类脂质的研究相对较少。Afshinnia等[15]研究发现,CKD患者血清胆固醇的下游代谢物胆固醇酯(cholesterol ester, CE)的水平显著下降,推测这可能与蛋白激酶C和有丝分裂原蛋白酶被激活,使得CE在肾小球皮质或肾小管中的利用率增加有关。Rampanelli等[19]对肥胖伴CKD患者的肾脏样品进行研究发现,与健康对照组相比,肥胖伴CKD患者胆固醇和磷脂的水平明显上调,原因可能是近端小管上皮细胞磷脂堆积,阻碍了胆固醇的外排。
2.6 脂质间的生物转化
结合上述研究可见,CKD疾病状态下,机体内脂肪酰基类、甘油酯类、磷脂类、鞘脂类、甾醇类5类脂质均会发生不同程度的代谢紊乱:血液中SFA会因种类不同而呈现上升或下降的不同变化趋势,PUFA在血液中通常呈下降趋势,在肾脏中则多呈上升趋势;血液中DAG多呈下调趋势,而TAG多呈上调趋势;肾脏和尿液中PC下调,LPC水平显著增加;血液中PE在多数CKD中呈下调趋势,但在患者血液中呈上调趋势,且与糖尿病肾病疾病进展紧密相关;肾脏中Cer总量的减少与肾脏衰老直接相关,1型糖尿病患者血浆中Cer水平的变化则能够预测患者蛋白尿的发生,而SM在CKD状态下往往呈下调趋势;CKD状态下,肾脏胆固醇水平会明显升高。需要指出的是,上述结果仅仅是某一类CKD疾病模型的研究发现,不一定适用于所有CKD,但可为研究CKD的发病机制和治疗手段提供重要参考,深入挖掘并验证上述各种变化间的内在联系对于最终全面描述CKD状态下脂质代谢网络的整体变化模式十分必要。上述5类脂质间可能的相互转化通路情况见图6。
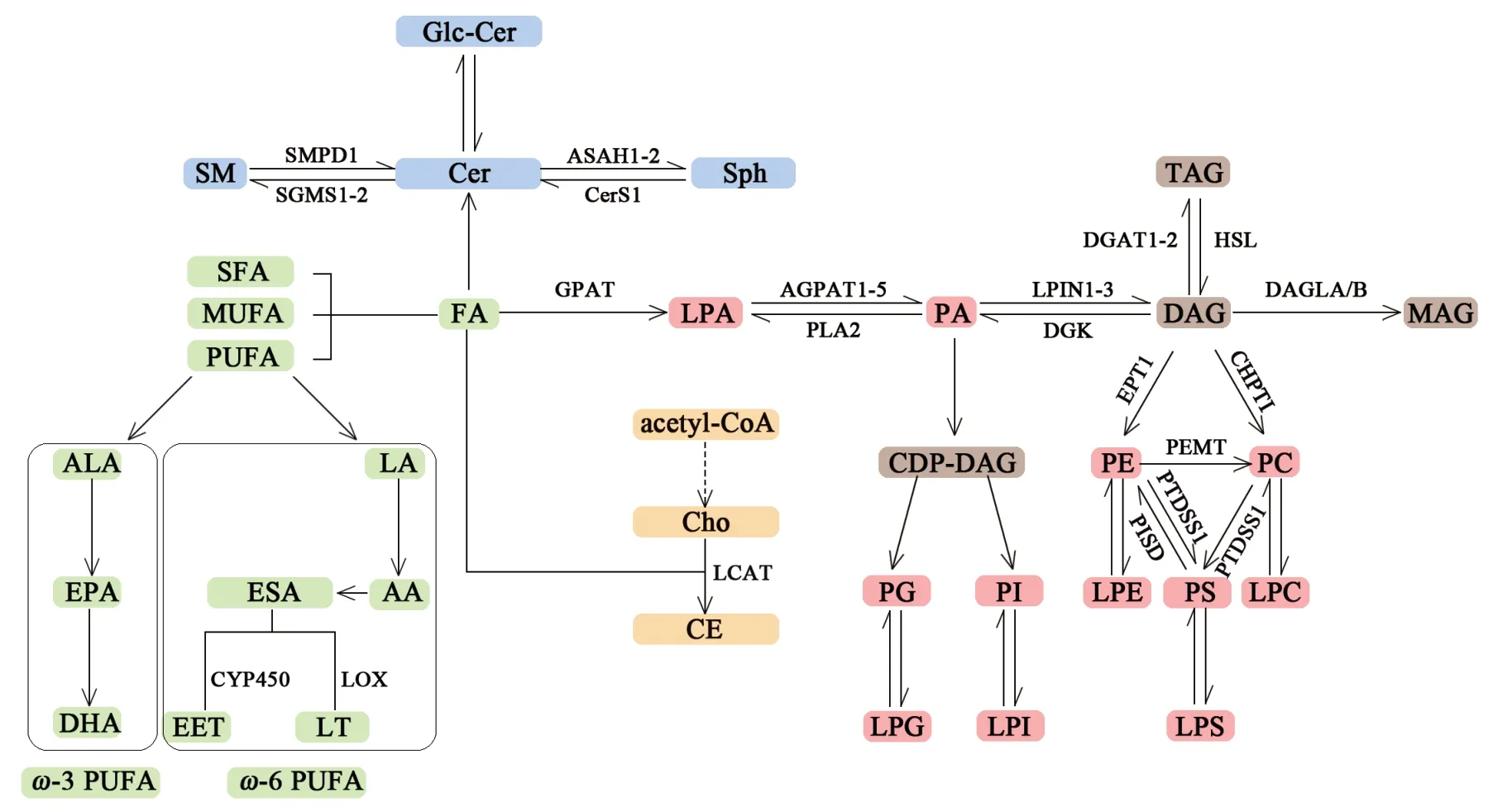
图6 脂肪酰基类、甘油酯类、磷脂类、鞘脂类、甾醇类脂质的生物转化过程Figure 6 Biotransformation process of fatty acyl lipids, glyceride lipids, phospholipids, sphingolipids and sterol lipids
甘油酯的合成从FA开始,然后通过多种酶依次转化为LPA和PA。脂素1-3(lipin1-3,LPIN1-3)可将PA转化为DAG,这一步骤可被二酰甘油激酶(diacylglycerol kinase,DGK)所逆转。从DAG开始,1个FA基团可以通过二酰甘油-酰基转移酶1-2(diacylglycerol acyltransferase 1-2,DGAT1-2)添 加到甘油结构的主干中,从而产生TAG,这一步骤可以被激素敏感性脂肪酶(hormone-sensitive triglyceride lipase,HSL)所逆转。此外,二酰基甘油脂肪酶A/B(diacylglycerol lipase A/B,DAGLA/B)可以从DAG中去除1个FA基团,从而产生MAG。甘油磷酸酰基转移酶(glycerol-phosphate acyltransferase,GPAT)可以将FA转化为LPA,这是磷脂代谢转化的开始。1-酰基甘油-3-磷酸O-酰基转移酶1-5(1-acylglycerol-3-phosphateO-acyltransferase1-5,AGPAT1-5)可将LPA代谢为PA;而通过磷脂酶A2(phospholipaseA2,PLA2),该反应可被逆转,将PA转化为LPA。随后,DAG可通过胆碱磷酸转移酶1(choline phosphotransferase 1,CHPT1)转化为PC,或通过乙醇胺磷酸转移酶1(ethanolaminephosphotransferase 1,EPT1)转化为PE。磷脂酰乙醇胺N-甲基转移酶(phosphatidylethanolamineN-methyltransferase,PEMT)可将PE转化为PC。PC和PE都是磷脂酰丝氨酸合成酶1(phosphatidylserine synthase 1,PTDSS1)合成PS的前体,而磷脂酰丝氨酸脱羧酶(phosphatidylserine decarboxylase,PISD)可逆转PE向PS的转化。此外,PA可代谢为胞苷二磷酸二酰甘油(cytidine diphosphatediacylglycerol,CDP-DAG),然后通过不同通路转化为磷脂酰肌醇(phosphatidylinositol,PI)和磷脂酰甘油(phosphatidylglycerol,PG)。
在FA转化为Cer后,鞘磷脂合成酶1-2(sphingomyelin synthase 1-2,SGMS1-2)可将PC与Cer结合,生成SM;而鞘磷脂磷酸二酯酶1(sphingomyelin phosphodiesterase 1,SMPD1)可将SM代谢为Cer。Cer也可通过N-酰基鞘氨醇酰胺水解酶1-2(Nacylsphingosine amidohydrolase 1-2,ASAH1-2)转化为Sph,该过程可依次通过神经酰胺合酶1(ceramide synthase 1,CerS1)的作用逆转。Cer可通过添加半乳糖分子来进行糖基化反应,生成半乳糖基神经酰胺(glucosylceramide,Glc-Cer)。另外,乙酰辅酶A(acetyl coenzyme A,acetyl-CoA)是甾醇类脂质代谢的源头,通过复杂的生物转化过程,可代谢为胆固醇(cholesterol,Cho)。Cho可被氧化成多种固醇类化合物,还可以通过磷脂酰胆碱-甾醇酰基转移酶(lecithin-cholesterol acyltransferase,LCAT)与FA结合,从而合成CE。
3 结语与展望
过去几年中,CKD相关的脂质研究主要集中在脂蛋白或主要肾功能指标的变化趋势上。CKD患者具有较高的心血管病变率,这是肾脏疾病患者过早死亡的主要原因,血脂的异常也导致了这种风险的增加[2]。对于合并动脉粥样硬化等疾病的CKD患者,既往CKD的脂质参数信息已无法解释其病理机制[33]。故此,脂质组学技术开始在CKD研究中得到大规模应用。目前研究表明,CKD状态下的脂质谱以DAG降低[15,18,20]、TAG升高[19,12,26]、PC下调[10,16-17,25]、SM下调[11,22,26]等代谢变化为特点,伴有多种脂肪酸与甾醇类化合物的代谢紊乱。作为脂质研究强有力的手段,脂质组学方法可以帮助研究者发现CKD疾病状态下紊乱的脂质代谢物及其相关通路,为CKD的预测与治疗提供了新的角度。
由于脂质是一个极其庞大且复杂的生物分子群,目前尚缺乏关于脂质生物学意义的精确阐释,这就带来了两大挑战。首先,由于分离方法的局限性,目前很难对样品中所有脂质的特征进行全方位描述,故无法对所有脂类同时分析,特别是受到同分异构体等存在的阻碍;其次,目前精确测定各种脂质浓度的方法尚在不断完善中[4],这阻碍了脂质研究的进展与可靠数据库的建立,而这些数据库反过来又阻碍了研究者确定脂质种类组合在机体中具体起到哪些作用[61]。
在过去30年中,基于质谱技术的数据采集方法不断改进,这些技术的进步以及数据解析能力的提高为解决临床实际问题提供了新的机会。所以,研究者有必要进行广泛的临床结果研究,以评估脂质作为生物标志物的临床应用效果。基于临床样本的脂质组学研究,尤其是靶向脂质组学是未来可能的发展趋势。脂质组学不仅在生物标志物的发现方面有实用价值,也是在系统生物学背景下发现并揭示代谢紊乱趋势的有力工具。有足够证据表明,脂质在CKD或药物导致的肾损伤发展中起着核心作用,有作为评价疾病进展或药物治疗作用的生物标志物的潜质[2-3]。但目前的脂质研究不够系统,阻碍了研究者对脂质参与的特定病理机制的阐述。因此,需要借助先进的分析技术,深入开展肾脏疾病的脂质组学研究,并整合代谢组学、蛋白组学、基因组学和分子生物学等多学科的相关研究,推动肾脏疾病生物标志物和药物治疗靶点的发现和最终确定。
