T细胞受体工程化T细胞的临床应用及肿瘤特异性抗原和T细胞受体的筛选策略
2021-11-13黄倩茹朱一成李扬扬李斌
黄倩茹,朱一成,李扬扬,李斌
(上海交通大学医学院 上海市免疫学研究所,上海 200025)
恶性肿瘤已成为许多国家70岁以下人群的第一大死亡原因。由于人口老龄化的加剧,全球癌症负担在20年后将增加近50%[1]。同时,由于中国巨大的人口基数,2020年全国新发癌症人数和癌症死亡人数均居全球第一。近数十年来,虽然早期检测的落实和免疫治疗的突破在一定程度上延长了癌症患者的生存期,但免疫治疗领域仍然存在着许多有待攻克的难题,如靶向药物难以避免的耐药性,免疫检查点抑制剂有限的反应率和嵌合抗原受体T细胞(chimeric antigen receptor T cells,CAR-T)疗法对实体瘤效果较差等。T细胞受体工程化T细胞(T cell receptor-engineered T cells,TCR-T)利用基因工程技术在T细胞上表达特异性识别肿瘤抗原的T细胞受体(T cell receptor,TCR),使之能特异性地靶向肿瘤细胞,清除肿瘤,被认为有机会突破实体瘤的细胞治疗困境,并通过个性化设计避免耐药、提高反应率。
肿瘤抗原,包括肿瘤中过表达的肿瘤相关抗原(tumor associated antigen,TAA)和肿瘤特异性抗原(tumor specific antigen,TSA),被主要组织相容性复合物(major histocompatibility complex,MHC)递呈后可选择性地增强T细胞反应从而控制肿瘤生长。目前,TCR-T的临床应用常基于高通量测序获得肿瘤细胞非同义突变的信息,结合预测算法识别潜在的肿瘤抗原,并对肿瘤浸润淋巴细胞进行筛选,获得反应性TCR序列,之后利用慢病毒载体在患者自体T细胞中过表达反应性TCR序列,再将能靶向肿瘤抗原的工程化T细胞回输到病人体中启动抗肿瘤免疫(见图1)。近期的临床研究展示了TCR-T富有希望的治疗效果,但由于肿瘤抗原的个体特异性及TCR库的丰富性,识别新的肿瘤抗原和与之配对的抗原特异性TCR极具挑战性,而这将十分有助于拓展TCR-T的临床应用范围。本文将综述近年来开展临床应用的TCR-T类型,总结当前的一些富有新意的筛选策略,并对TCR-T的未来发展进行展望。
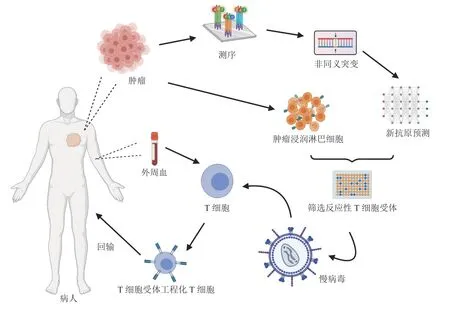
图1 肿瘤特异性抗原反应性T细胞免疫治疗的基本步骤Figure 1 The basic steps of tumor-specific antigen-reactive T cell immunotherapy
1 T细胞受体工程化T细胞的临床应用
早在2002年,Dudley等[2]报道在体外多轮筛选肿瘤浸润淋巴细胞(tumor-infiltrating lymphocytes,TILs),得到携带特异性TCR的T细胞进行回输治疗;其进一步的临床研究筛选了靶向人类白细胞抗原(human leukocyte antigen,HLA)-A*02限制性的MART-126-35(MART-1: melanoma antigen recognized by T cells 1,T细胞识别黑色素瘤抗原1)和gp100209-217(gp100: glycoprotein 100,糖蛋白100)的细胞回输治疗后,35名转移性黑色素瘤患者中18人(51%)出现客观临床治疗反应[3]。然而这种多轮富集筛选得到的肿瘤特异性淋巴细胞通常数量较少且属于鸡尾酒疗法,所含细胞的背景信息了解不透彻。2006年,该研究团队利用基因工程改造T细胞使之具有专一靶向HLA-A*02:01限制性MART-1抗原的TCR,对17名黑色素瘤患者的回输治疗中有2人出现了完全的疾病消退[4]。
TCR-T作为当前免疫治疗的研究热点,临床研究的试验数量逐年增加。根据美国 ClinicalTrials.gov 网站的数据(截至2021年3月31日),笔者总结了临床研究中登记收录的靶向肿瘤抗原类型(见图2A),可主要分为三大类:肿瘤相关抗原(tumor associated antigen,TAA),TSA和 病 毒编码的抗原(oncoviral antigen)。其中,纽约食管鳞状细胞癌-1(New York esophageal squamous cell carcinoma-1,NY-ESO-1)、黑色素瘤抗原基因(the melanoma antigen gene,MAGE)家 族 和EB病 毒(Epstein Barr virus,EBV)是这三大类抗原中的热点靶标。从图2B中可以看出,TCR-T在实体瘤领域具有很好的应用前景,黑色素瘤、头颈部肿瘤、非小细胞肺癌和肝癌等实体瘤中已有多项临床研究开展。由于TCR识别抗原受MHC限制性的影响,HLA-A*02:01,HLA-A*02:06,HLA-A*02:05和HLA-A*11:01是目前开展研究最多的前4种HLA类型。虽然目前的研究集中在HLA-I类分子,但针对HLA-DP*04:01这一HLA-II类分子也有3项研究在开展,表明CD4+T细胞在该领域也极富潜力(见图2C)。以下将按照肿瘤抗原类型详述近年部分具有代表意义的TCR-T临床研究,了解改造TCR-T以增强其抗肿瘤效果的新策略。
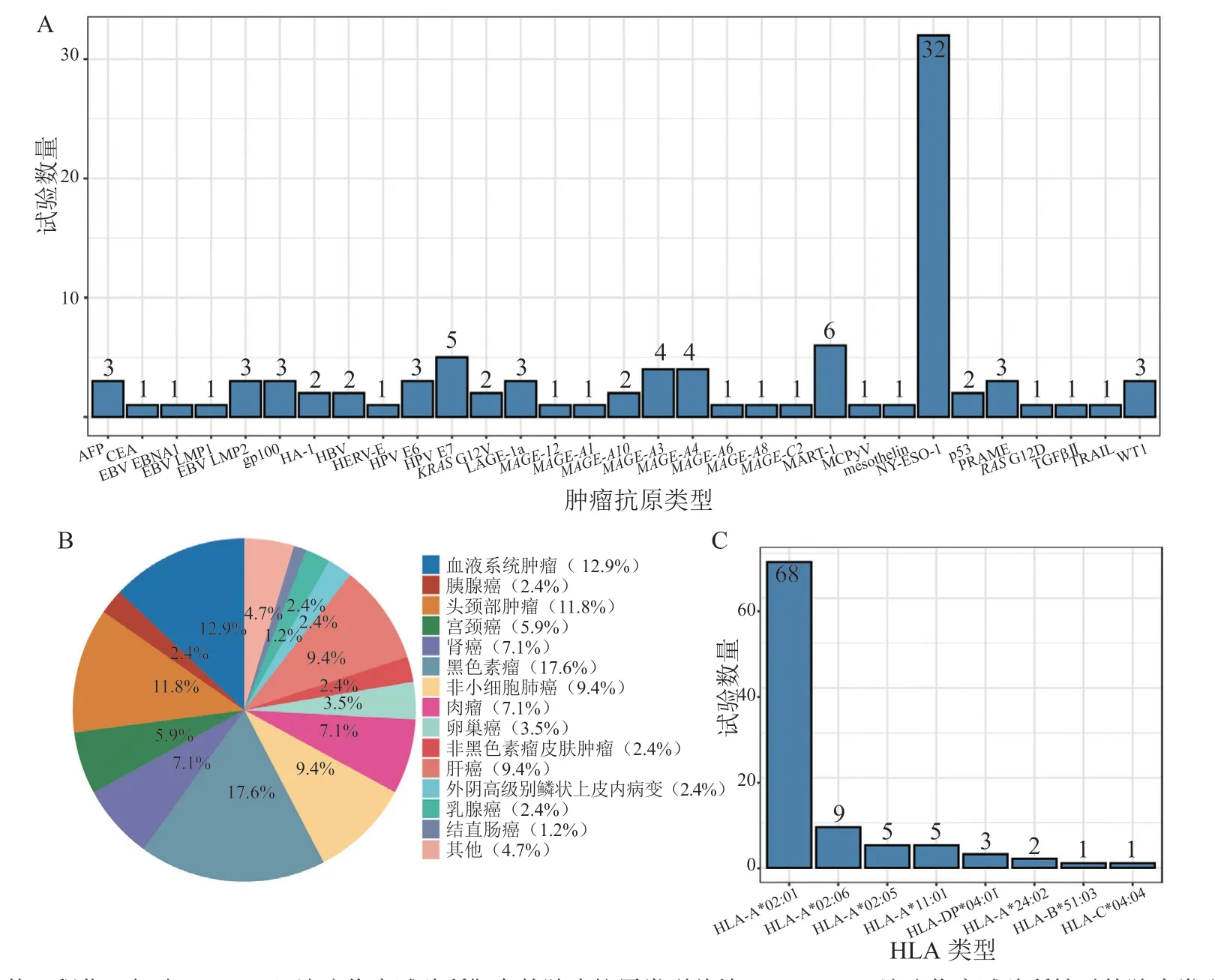
图2 近年开展的T细胞受体工程化T细胞治疗临床试验统计Figure 2 Recent clinical trials of T cell receptor-engineered T cells therapy
1.1 靶向肿瘤相关抗原
TAA是一类在肿瘤细胞中高表达,但在正常组织(如生殖细胞)中受限表达的抗原,其最具代表性的一类抗原家族是癌睾抗原(cancer-testis antigen,CTA),CTA在缺乏MHC-I的睾丸等生殖系统组织中表达,并在多种上皮来源的肿瘤中高表达,如黑色素瘤、肺癌、膀胱癌等,目前已被认为可诱发自发的体液免疫和细胞免疫反应[5]。NYESO-1是该家族中最具免疫原性的成员,目前开展的临床研究也最为丰富。由于NY-ESO-1与L抗原1(L-antigen 1,LAGE-1)有高达94%的同源性,2015年的一项Ⅰ/Ⅱ期临床试验通过慢病毒介导靶向NY-ESO-1/LAGE-1来源的SLLMWITQC 抗原肽(HLA-A*02:01限制性)的NY-ESOc259TCR 在CD3+T 细胞表达,回输治疗多发性骨髓瘤,结果显示80%的病人出现了令人鼓舞的疾病缓解(16/20)[6]。近期,有研究在对2例晚期难治性骨髓瘤和1例转移性肉瘤的治疗中,结合成簇规律间隔的短回文重复序列及其相关蛋白9(clustered regularly interspaced short palindromic repeat/CRISPR associated protein 9,CRISPR-Cas9)敲除内源性TCR和程序性死亡受体1(programmed cell death 1,PD-1),可避免TCR错配产生靶向分子不确定的TCR,使回输到体内靶向NY-ESO-1的工程化T细胞存在时间延长到9个月以上,并在病人体内观察到肿瘤部位靶抗原的减少[7]。有研究利用HLA-A*02转基因小鼠识别出靶向肝癌生物标志物甲胎蛋白(alpha fetoprotein,AFP)的TCR序列,并在小鼠模型中显示出强大的肿瘤清除效果,之后进行的一系列体外实验进一步筛选出亲和力更强且不存在交叉反应的TCR序列,目前基于以上研究的临床试验(NCT03971747)正在上海中山医院开展[8-9](见表1)。
1.2 靶向肿瘤特异性抗原
肿瘤细胞基因编码区通常存在许多突变会产生变异蛋白,若变异的蛋白可被MHC递呈激活免疫细胞杀伤功能,这一被递呈的肽段便是富有治疗潜能的TSA。由于这类抗原在正常组织中不表达,其特异性T细胞可以逃避胸腺中的阴性选择因而储备丰富,但此类抗原常存在极高的个体特异性。目前的研究主要集中在靶向致癌基因和肿瘤抑制基因突变,即所谓的“热点”突变。如靶向KRASG12D和KRASG12V突变抗原的TCR逐渐被挖掘并改造以提升亲和力[10-11],在对6例转移性癌症患者的外周记忆T细胞进行高度敏感的体外刺激和细胞富集后,科研人员在3例患者中鉴定出靶向突变KRASG12D和KRASG12V变异的CD4+和CD8+记忆T细胞;在另外2例转移性结肠癌患者中,则检测到针对突变SMAD5和MUC4蛋白的CD8+肿瘤抗原特异性细胞[12]。在针对1例转移性结直肠癌患者的治疗中,回输4种不同的靶向HLA-C*08:02限制性KRASG12D抗原的T细胞观察到了肺转移病灶的肿瘤消退,然而在9个月后1个转移病灶中的HLA-C*08:02分子表达缺失促使了肿瘤免疫逃逸[13]。据美国ClinicalTrials.gov网站登记显示,上海长海医院自2019年开启了一项针对携带KRASG12V晚期胰腺癌患者的HLA-A*11:01限制性的TCR-T回输治疗临床试验(NCT04146298,见表1)。
除了单核苷酸变异外,近年发现移码突变、剪接变异、基因融合和内源性逆转录基因也会产生值得靶向的肿瘤特异性抗原[14]。一些个性化的多靶点治疗也在开展,在一项关于化疗难治性转移性乳腺癌的研究中,利用测序确定肿瘤中的突变蛋白,联合使用针对由SLC3A2,KIAA0368,CADPS2和CTSB这4种蛋白的非同义突变形成的新表位的TILs和白细胞介素-2(interleukin-2,IL-2)治疗,并进行短暂的免疫检查点治疗,实现了超过22个月的肿瘤完全消退。由于不是每个突变表位都能被MCH递呈并激活T细胞反应,所以如何确定肿瘤抗原和配对的TCR是一大难点,后文将对目前已有的策略展开探讨。
1.3 靶向病毒编码的抗原
据世界卫生组织估计约13%的癌症发生与感染相关,其中中国占发生数的1/3[15]。一些病毒可长期潜伏在细胞中,甚至将自身遗传物质整合到宿主细胞的基因中从而诱发细胞癌变,同时也会使病毒特异性的蛋白在肿瘤细胞中组成性表达。这类蛋白表达特异,通常免疫原性强,可作为理想的TCR-T靶向抗原,科研人员正在开展相关临床研究。例如,人乳头瘤病毒(human papillomavirus,HPV)相关恶性肿瘤,包括子宫颈、口咽、肛门、外阴、阴道和阴茎部位的肿瘤,发生转移后通常对标准治疗耐药,难以治愈。HPV阳性的肿瘤细胞组成性表达促癌的HPV E7抗原,该抗原在胞内表达从而难以使用抗体或CAR-T进行靶向,实验人员通过HLA-A*02:01-E711-19四聚体筛选出1个能限制小鼠HPV-16相关肿瘤生长的高亲和力TCR[16]。近期开展的一项临床研究,使用靶向HPV-16 E7的TCR-T治疗转移性HPV相关的上皮癌,结果12例患者中有6例出现了肿瘤消退[17]。同时,使用靶向HPV-16 E6的TCR的自体基因工程T细胞的Ⅰ/Ⅱ期单中心临床试验也已开展,结果显示12例接受治疗的患者大部分都出现了不同程度的肿瘤消退[18]。EBV则与多种淋巴瘤、鼻咽癌和胃癌的发展有关,靶向EBV编码蛋白LMP2和BMLF1等的研究也在开展中,研究人员使用肽段-MHC四聚体筛选出首个功能性的HLA-A*01:01限制性的EBV-LMP2特异性的TCR,拓展了这一领域的应用范围[19],而一类针对HLA-A*11:01限制性的EBV-LMP2特异性的TCR已被证明可在小鼠中抑制人鼻咽癌肿瘤细胞的生长[20]。据美国ClinicalTrials.gov网站登记显示,目前国内有3家医院正在开展针对复发和转移性鼻咽癌患者或头颈部肿瘤患者的靶向EBV编码抗原的TCR-T治疗的临床试验(见表1)。
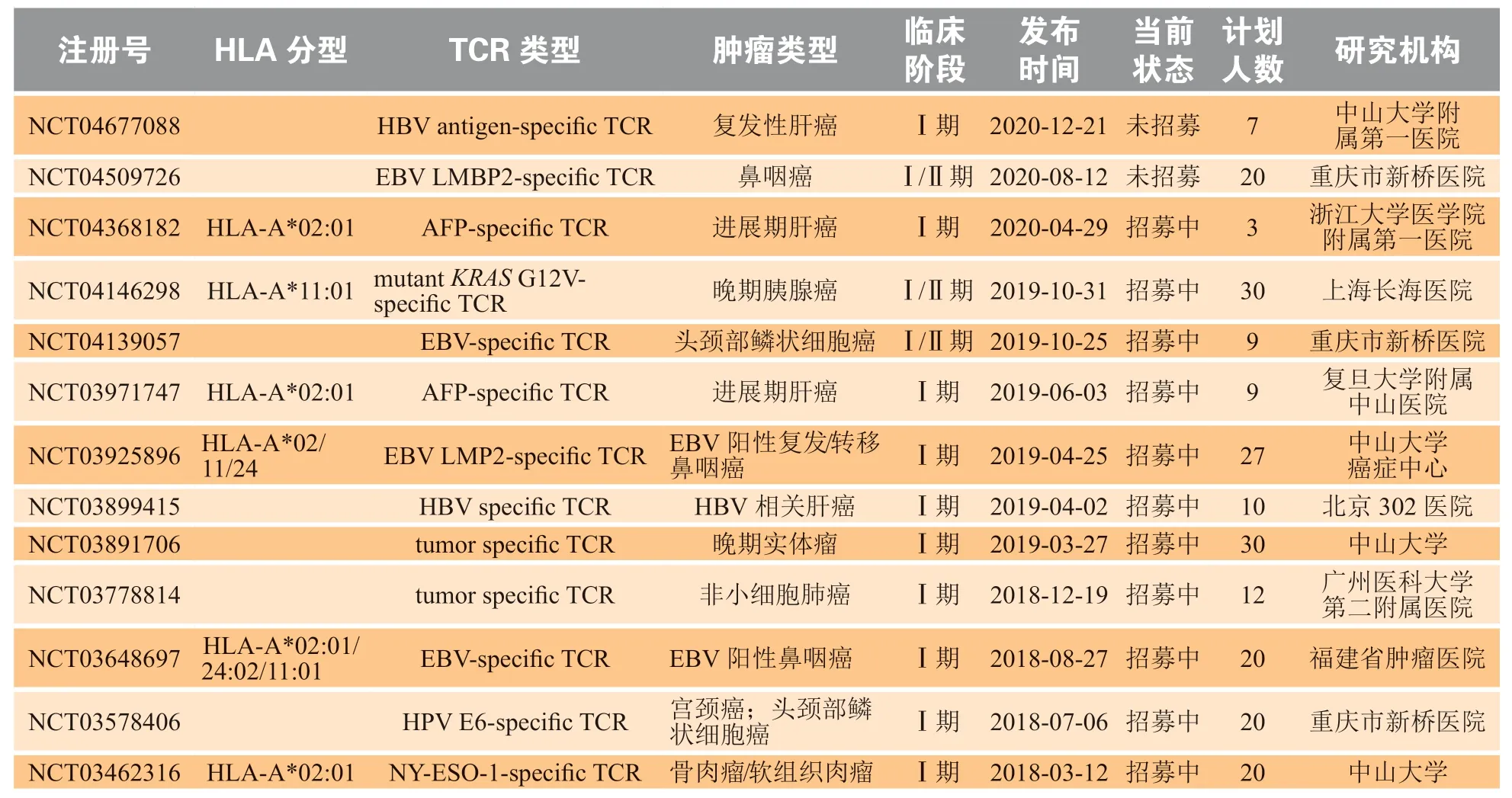
表1 国内正在开展的T细胞受体工程化T细胞治疗临床试验统计△Table 1 Ongoing clinical trials of T cell receptor-engineered T cells therapy in China
2 肿瘤抗原和肿瘤抗原特异性T细胞受体的 筛选策略
虽然目前开展了一系列的TCR-T临床治疗研究,但其靶向的抗原类型和针对的癌症类型仍有很大局限性,所以筛选富有治疗潜力的肿瘤抗原是当前的研究热点之一。随着癌症突变、HLA基因型和免疫治疗反应相关临床数据集的扩增,以及生物信息算法提升和合成生物学的发展,越来越多的努力付诸于识别肿瘤特异性抗原及其配对的TCR(见图3)。
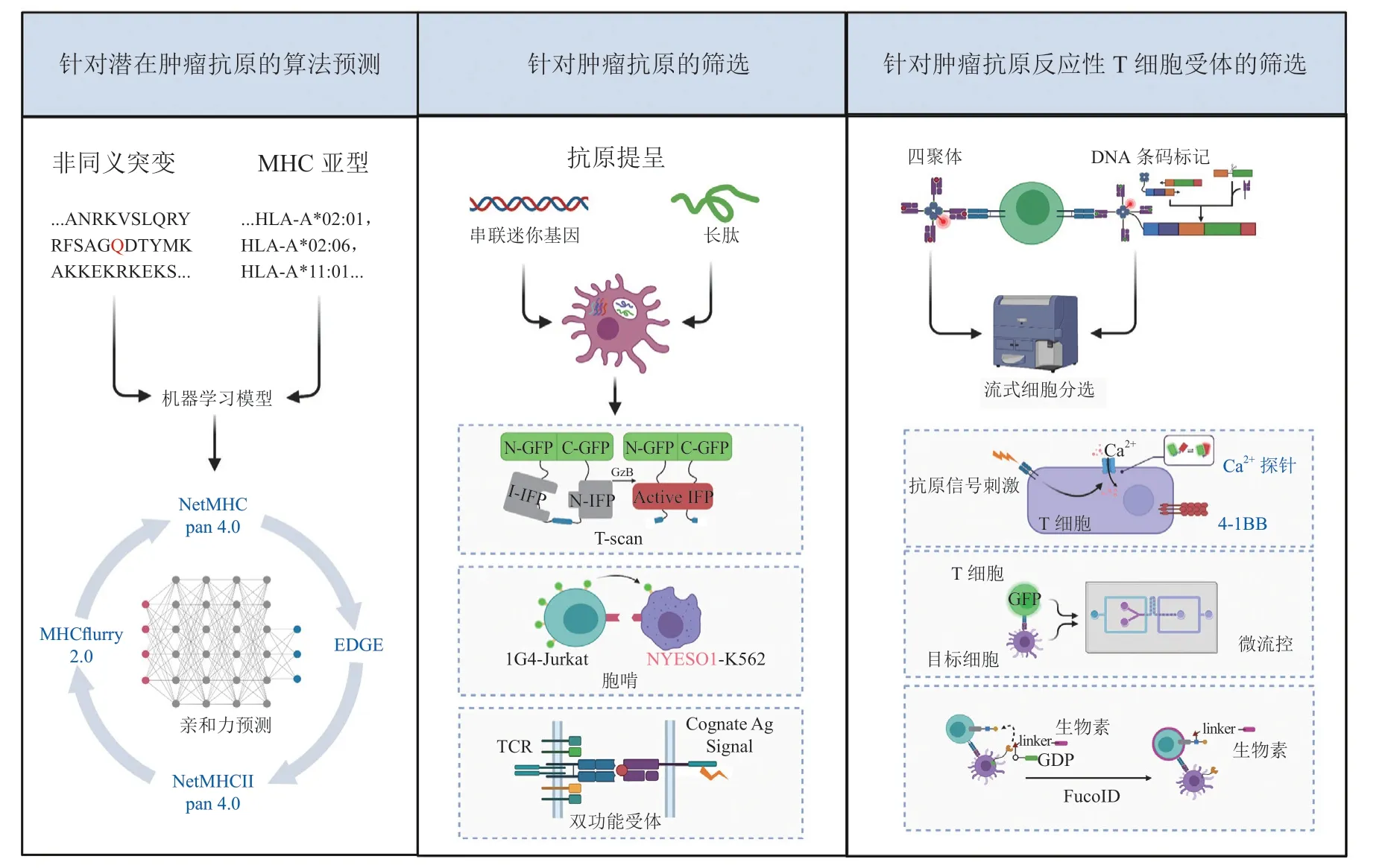
图3 针对肿瘤抗原和肿瘤反应性T细胞受体的筛选策略Figure 3 Screening strategies for tumor antigens and tumor-reactive T cell receptors
2.1 针对潜在肿瘤抗原的机器学习算法预测
识别和选择病人特异的潜在肿瘤抗原是开展治疗的关键。目前的流程大致是:比较肿瘤细胞和正常细胞的测序数据(DNA或RNA序列)鉴定出非同义变异;之后使用机器学习模型预测非同义突变中潜在的肿瘤抗原,这样有助于降低筛选成本并提高筛选效率。预测模型的搭建依赖于对肽-MHC结构建模进行分子动力学模拟或利用已知的MHC结合序列分析氨基酸偏好序列[21]。当前使用的大部分模型聚焦于预测肽-MHC(特别是MHC-I)的结合亲和力,如NetMHCpan 4.0利用质谱洗脱数据和亲和力数据训练出神经网络模型,可预测亲和力和MHC特异性肽长度的结合偏好[22]。由于肿瘤抗原预测的重要性,也存在专门运用肿瘤病人数据聚焦于肿瘤抗原预测的算法,如EDGE是利用涉及8种肿瘤类型的74名患者的质谱和测序数据深度学习后构建的,在抗PD-1治疗后转移的非小细胞肺癌患者的样本中均能使用EDGE预测到至少1个T细胞反应性肽段[23]。虽然与MHC的高亲和力是肽呈现的最重要的选择要求,但抗原递呈的过程还包括蛋白质合成、蛋白酶体降解、HLA结合和转运等,其中许多细节的研究尚不清楚。MHCflurry 2.0利用目前积累的质谱识别的MHC-I配体数据,综合MHC等位基因依赖效应和非等位基因依赖效应,训练了2个模型并通过逻辑回归将二者整合得到递呈分数,虽然与先前的模型相比,MHCflurry2.0的阳性预测值(positive predictive value)增加40%以上[24];但难以模拟抗原递呈的全过程,常会输出相对较高的假阳性结果,且预测得分与真实的抗原递呈间会存在显著偏差。此外,与CD4+T细胞相关的MHC-II结合表位也逐渐受到关注,专门用于预测MHC-II抗原表位的MARIA[25]和NetMHCIIpan4.0[22]陆续被开发。但由于MHC-II的肽结合沟相对较浅且两侧是开放的,所以其结合肽的长度变化较大(9 ~ 22残基),因而针对MHC-II的肽结合预测更为困难。尽管如此,相信随着MHC-抗原肽数据的积累、抗原递呈复合物结构的识别和算法的优化,HLA结合抗原预测的准确性有望得到提升。
TCR识别抗原的预测主要基于保守基序进行判断,逐渐出现一些基于深度学习的模型如ERGO[26]。同一TCR可以识别不同肽段,而不同的TCR也可以识别相同肽段,基于后者利用聚类来寻找识别共享抗原的TCR也取得了一些进展,如基于深度学习构建的DeepTCR可以分析单细胞数据,揭示TCR抗原性的决定序列[27]。近期,GLIPH2帮助在178例非小细胞肺癌患者中实现了对435个肿瘤富集的抗原表位特异的TCR分组,并结合酵母展示系统发现了“S%DGMNTE CDR3β”基序,该基序可识别上皮蛋白TMEM161A产生的病毒和非突变抗原交叉表位[28]。研究表明TCR库中可能存在1011~ 1012个独特的TCR,这是强大的肿瘤杀伤武器库,但这也增大了筛选肿瘤抗原反应的TCR的挑战性[29]。在未来,TCR特异性的表位预测将是肿瘤抗原表位预测的主要方向。
2.2 针对肿瘤抗原的筛选策略
将TILs与抗原递呈细胞(antigen presenting cell,APC)共培养是检测抗原反应原性最直接的手段。在早期,抗原递呈是通过将潜在抗原的完整蛋白质编码基因导入表达特定HLA亚型的APC来完成的[30],该方法可模拟天然的抗原递呈过程,但对于大规模筛选则显得笨拙且耗时。之后,潜在抗原肽以串联迷你基因(tandem minigene,TMG)或长肽的方式被导入细胞,可让1个细胞同时递呈多种候选抗原分子从而极大提升了筛选效率[31]。TMG携带多个迷你基因,每个迷你基因存在1个突变核苷酸,可编码1个新的抗原表位;长肽则是多个潜在抗原肽的串联,每个抗原肽中存在1个突变氨基酸。这2种方式目前已成功应用于胃肠道癌症、转移性黑色素瘤和上皮性癌症的临床试验[32-33]。
然而,上述2种方式还存在许多不足之处,首先是跳过了抗原肽的天然加工过程,其次TMG中迷你基因可能受限于翻译后的三维结构,难以实现均等的蛋白表达水平,而长肽引发的CD8+T细胞反应较弱,需经过多轮筛选才能确定反应性肿瘤抗原。2019年报道的T-scan系统将一个被颗粒酶B(granzyme B,GzB)酶切位点影响完整性的红外荧光蛋白转到APC中作为报告分子,共培养时,反应性T细胞会分泌GzB到APC中释放荧光信号,可通过流式细胞术分选出被识别的APC并测序确定抗原序列[34]。另一团队则利用被称为胞啃的膜转移现象作为信号,T细胞会将被N-氨基喹啉-生物素标记的膜蛋白转移到递呈配对抗原的APC上,之后可以通过流式细胞术分选出被识别的APC并测序确定抗原序列[35]。此外,还有系统在APC中构建信号和抗原递呈双功能受体(signaling and antigen-presenting bifunctional receptors,SABRs),该受体胞外段为MHC-抗原肽可递呈抗原,在与反应性TCR作用后,其胞内段可产生1个TCR样信号诱导NFAT启动子调控的荧光蛋白表达用于筛选[36]。类似的方法也在MHC-II的筛选中得以实现,研究人员将小鼠MHCII与TCRαβ的胞内段相融合得到pMHC(peptide and major histocompatibility complex)-TCR(MCR),并用此筛选出gp61的潜在抗原和反应性TCR序列[37]。
2.3 针对肿瘤抗原反应性T细胞受体的筛选策略
针对新抗原特异性TCR的筛选中,peptide-MHC四聚体(pMHC tetramers)最为广泛应用,四聚体上偶联的荧光素使得与之结合的T细胞可以通过流式细胞术进行筛选,目前这项技术已在多发性骨髓瘤和转移性黑色素瘤中得以应用[38-39]。研究人员进一步开发同位素标记四聚体,使用质谱流式实现对单个人类样本中多达109种pMHC特异性和20 ~ 30种额外的表面和胞内标记物的同时鉴定[40]。四聚体能同时识别多种抗原特异性T细胞,但其合成较复杂且MHC的型别有限,一些研究团队尝试利用紫外辐照使四聚体中HLA上的配体断裂以转载新的配体,以期实现四聚体的重复利用[41];同时,DNA条形码、多分子荧光被用来标记四聚体以增加一次筛选的抗原种类[42-43]。纳米磁性颗粒也被用于标记四聚体,以期能更敏感地从病人肿瘤或血液中分离罕见的肿瘤抗原反应性T细胞[42]。此外,基于MHC的酵母展示系统也已被开发用来扩展抗原表位的识别数目[44];类似地,有研究将pMHC复合物融合到杆状病毒蛋白gp64的跨膜和细胞质结构域,从而锚定在昆虫细胞Sf9细胞膜上进行展示[45],但这2个展示系统只能用于筛选可溶性的TCR。以上筛选策略的主要缺陷是不能确定T细胞是被抗原激活还是仅仅与抗原结合。
基于群体水平上检测细胞因子(如γ-干扰素)分泌和细胞毒性活性被广泛用于分析T细胞是否被激活,但它们更适合检测T细胞对肿瘤抗原的群体反应程度,缺乏单细胞维度的敏感性。细胞表面标记物能帮助识别激活的T细胞,目前4-1BB被认为是极具潜力的标记物,但结合使用2或3种表面标记物可能更能可靠地识别T细胞的激活[46]。一些专门设计的感受器也被用于检测TCR激活后下游信号通路的改变,如使用荧光共振能量转移探针检测蛋白质酪氨酸激酶ZAP-70活性的变化、钙离子探针检测胞内钙离子的改变和将NFAT-启动子调控的荧光信号与组蛋白H2B结合检测T细胞活化[47-49]。但这些筛选信号不仅仅受TCR信号的调控,筛选特异性值得商榷。近期,FucoID利用化学酶法使APC表面锚定上岩藻糖基转移酶,当APC与配对的TCR相互作用时可以将底物GDP-Fuc-Biotin上的生物素转移到T细胞上,实现对配对T细胞的标记[50]。此外,基于微流控的筛选系统也被建立,科研人员在携带NFAT/AP-1调控的eGFP的Jurkat 细胞中表达候选TCR,利用微流控系统将单个TCR-T与靶细胞包裹起来形成小区室,当TCR-T与表达配对抗原的靶细胞相互作用时可以通过显微镜观察荧光变化[51]。这些基于不同原理的策略为筛选肿瘤抗原反应性T细胞提供了富有创造性的新思路。
3 总结与展望
TCR-T治疗因其具有良好的特异性、显著的抗肿瘤活性和相对较轻的副作用而受到越来越多的关注,在早期的多项临床试验中已证明了回输抗原特异性TCR-T能带来显著的临床疗效,但其发展还处于起始阶段,仍有许多问题亟待解决。本文对近年TCR-T治疗的临床试验进行了综述,并对当前蓬勃发展的肿瘤抗原和配对TCR的筛选策略进行总结,但文中只初步触及TCR-T治疗的临床准备工作。目前的临床应用也反映出对于TCR-T毒性的临床前评估还缺乏有力的工具和策略,如MAGE家族是目前研究热点的靶向抗原,但在一项针对MAGE-A3的TCR-T临床试验中,9例患者中有2例在输注后因出现神经系统副作用而死亡,深入分析揭示该TCR同时靶向MAGE-A12,而后者在脑中存在表达,这是在之前未被认知的[52]。同时TCR-T在体内治疗的过程中如何克服肿瘤免疫抑制微环境及脱靶毒性的影响也是未来发展的难点。
T细胞抗原的识别与B细胞相比更为困难,发展较为缓慢,主要面临以下几个难点:1)抗原以短肽的形式与MHC非共价连接;2)TCR与抗原的亲和力相对较低;3)难以判断抗原结合是否激活T细胞信号[34]。早先识别肿瘤特异性抗原的方法依赖于珍稀的临床标本,直接对庞大的多肽库进行筛选,限制了肿瘤特异性抗原的发现。但令人欣喜的是,许多跨学科的筛选策略逐渐得到发展,涉及计算机算法设计、合成生物学及工程系统也被成功搭建,虽然目前还缺乏在临床水平的试验验证,但相信在未来这些筛选策略将有助于拓展TCR-T的应用范围。当前,肿瘤抗原的鉴定主要依靠基因组规模的方法,如全外显子组测序。而多元组学和深度学习的发展将助力更多潜在的肿瘤抗原的发掘,目前也看到了更多关于全球合作的倡议,如肿瘤新抗原选择联盟(Tumor Neoantigen Selection Alliance,TESLA)比较不同团队对新抗原的预测方法,发现单个预测管道的预测性能普遍欠佳,总结提出强结合亲和力、高肿瘤丰度、高结合稳定性和肽识别是与肽免疫原性相关的关键递呈相关参数,这些关键参数将有助于改善肿瘤抗原的预测准确性[53]。同时,还需要考虑下游临床应用对预测肿瘤抗原的假阴性和假阳性的耐受性,及无关的新抗原表位是否会干扰真正的肿瘤抗原靶点从而对临床疗效产生负面影响[54]。
在未来,肿瘤抗原反应性TCR的发展有着广阔的空间以待挖掘。肿瘤抗原的概念可以扩展到错误折叠的蛋白质、核酸、外泌体等形式,这为筛选提供了丰富的靶标。同时,近年来也有研究将TCR与CAR-T疗法相结合,将识别pMHC的TCR可变域(TCRv)与嵌合抗原受体(chimeric antigen receptors,CARs)的胞内域相连,使CAR-T的靶向抗原不仅局限于细胞表面蛋白,也使得TCR的靶向功能可以被用于其他免疫细胞[55]。因此,尽管TCR-T治疗的发展道路上还存在着许多障碍,但TCR-T疗法有望在未来成为治疗癌症的有力武器。
