木薯根域AMF群落结构特征及多样性研究
2021-11-12周时艺,韦云东,陈蕊蕊,郑华,李军,盘欢,罗燕春
周时艺,韦云东,陈蕊蕊,郑华,李军,盘欢,罗燕春

摘 要:土壤微生物是土壤—作物系統养分循环的重要驱动力,其中丛枝菌根真菌(Arbuscular mycorrhizal fungi,AMF)能够促进作物对养分的吸收。木薯是我国南方重要的经济作物,是多种行业的重要原材料。为揭示不同土壤质地木薯根域土壤AMF群落结构特征,解析土壤因子对AMF类群的影响。以木薯品种华南205(SC205)为材料,通过田间根袋培养,利用高通量测序平台进行真菌扩增子测序,分析不同处理木薯根域AMF类群组成和多样性差异。结果表明,木薯根域土壤AMF主要为球囊霉属(Glomus)、无梗囊霉属(Acaulospora)、盾巨孢囊霉属(Scutellospora)、类球囊霉属(Paraglomus)和双型囊霉属(Ambispora)。优势属为球囊霉属和无梗囊霉属。两种土质各处理AMF属水平上无显著差异,种水平分布受土壤质地及根袋的影响,粘土AMF多样性(Simpson指数)高于砂质壤土。两种土质中都发现独有种,土壤质地对木薯根域AMF群落分布有一定的影响。RDA分析表明Glomus与速效磷、速效氮、铵态氮正相关;Acaulospora与速效磷,速效氮弱负相关;Scutellospora与所有速效养分负相关;Paraglomus与所有速效养分表现出正相关;Ambispora与大部分速效养分表现出负相关。木薯根域AMF资源丰富,不同土壤质地条件下的AMF群落组成和丰度存在差异,土壤速效养分与AMF群落结构差异密切相关。该研究为进一步探索AMF在木薯上的应用提供理论参考。
关键词:木薯;丛枝菌根真菌;高通量测序;球囊霉属;多样性
中图分类号:S154.3,S533 文献标识码:A
Study on the Structural Characteristics and Diversity of AMF Community in Cassava Root Zone
ZHOU Shiyi,WEI Yundong,CHEN Ruirui,ZHENG Hua,LI Jun,
PAN Huan,LUO Yanchun
(Guangxi Subtropical Crops Research Institute,Nanning, Guangxi 530001,China)
Abstract: Soil microorganism is an important driving force of nutrient cycling in soil-crop system, and arbuscular mycorrhizal fungi (AMF) can increase the nutrient absorption of crops. Cassava is an important cash crop in the south of China, and it is an important raw material for many industries. In order to reveal the AMF community structure characteristics in cassava root zone with different soil textures and analyze the effects of soil factors on AMF groups, a root-bag experiment was set with cassava variety SC205 as material. We analyzed the composition and diversity of AMF groups in the cassava root zone under different treatments via high-throughput sequencing. The results showed that the main AMF of cassava root soil were Glomus,Acaulospora,Scutellospora,Paraglomus and Ambispora, and the dominant groups were Glomus and Acaulospora. There was no significant difference at AMF genera level between two soil treatments. The distribution of species level was affected by soil texture and root-bag, and Simpson index of clay was higher than sandy loam. Unique species were found in both soils, and soil texture had a certain influence on the distribution of AMF community in cassava root zone. RDA analysis showed that Glomus was positively correlated with available P, available N and ammonium N; Acaulospora was negatively correlated with available P and available N; Scutellospora was negatively correlated with all available nutrients; Paraglomus was positively correlated with all available nutrients. Ambispora was negatively correlated with most available nutrients. The cassava root zone soil is rich in AMF resources, the AMF community composition and abundance differed in different soil textures, and soil available nutrients and soil structure are closely related to AMF community. This study provides a theoretical reference for further exploration of AMF application in cassava production.
Key words: Cassava; arbuscular mycorrhizal fungi; high-throughput sequencing; Glomus; diversity
根际作为植物根系与土壤紧密接触且相互影响的微生态环境,是植物—土壤进行物质能量交换的重要场所,其丰富的微生物种群是反应土壤健康状态的重要指标[1],对调节土壤肥力有着重要的作用。植物类型[2-3]和土壤类型[4]是影响根际微生物群的重要因素。
丛枝菌根真菌(Arbuscular Mycorrhiza Fungi,AMF)是自然生态系统中广泛存在的一类真菌,它能定殖于绝大多数高等植物根系并与其根系形成互惠共生体,即AM菌根。AM菌根能促进寄主植物对水分和矿质营养元素的吸收,提高植物在干旱、缺磷等生物和非生物胁迫下的生存能力,促进植物生长。研究表明,丛枝菌根育苗可提高西瓜根际酸性磷酸酶活性而改善磷营养,提高植株抗病能力,降低枯萎病发病率和发病指数[5]。在磷养分缺乏的土壤中接种AMF能使玉米增产20%以上、菜豆增产30%以上,西瓜产量和品质明显提高[6]。卢李威等[7]发现施AM菌剂能促进甘蔗对土壤中镁和有机质的吸收,提高磷肥的利用率。接种摩西球囊霉(G. mosseae)可显著提高柑橘根际土壤有效磷含量[8]。植被类型、土壤质地类型、土壤养分、地理距离等环境变量对AMF的群落结构组成,多樣性都有显著影响[9-12]。
木薯是世界三大薯类作物之一,有着“地下粮仓”、“淀粉之王”的美誉,是我国南方红壤区重要经济作物,是食品、饲料、生物燃料等多种行业的重要原料。木薯是典型AMF依赖型作物[13],接种AMF可显著提高木薯鲜薯产量[14]。李冬萍等[15]发现,木薯“GR911”施用AM菌剂平均产量可达45.54 t/hm2,比对照增产19.8%。郑华等[16]发现,缓释肥配施AM菌剂可显著提高木薯产量。关于木薯根域土壤AMF群落结构特征及种群多样性少见报道。
本研究采用根袋法[17],设置两种不同质地土壤,及根袋内不同土壤重量,测定土壤速效养分和土壤AMF类群结构组成及多样性,分析不同处理条件下木薯根域土壤AMF群落结构特征差异,为深入认知木薯根际微生态,进而为AMF在木薯生长调节上的应用提供理论基础。
1 材料与方法
1.1 材料
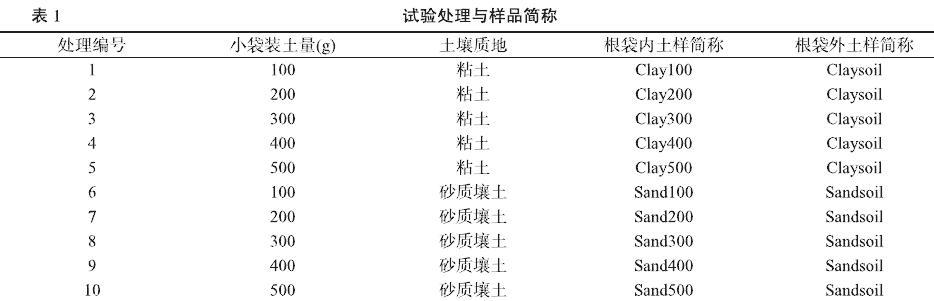
供试木薯品种为华南205(SC205),参试土壤质地分别为粘土和砂质壤土。根袋材质为300目尼龙网,分大袋和小袋。大袋为50 cm×30 cm×15 cm的长方体,上部中间有长13cm,高7 cm的一条开口,方便放入小袋。小袋为长30 cm,直径5 cm,正中间有高10 cm,直径5 cm的T型凸起,凸起上下均开口,用于种植木薯种茎。
1.2 方法
1.2.1 试验设计
试验采用大袋套小袋的根袋法[17],种植时先将参试土壤与肥料混匀,大袋装满(粘土22.5 kg,砂质壤土25.0 kg)并埋入田间地下10 cm,小袋按处理内置不同重量和质地参试土壤,置入大袋中。试验共10个处理(表1),每个处理4个重复。
1.2.2 采样与测试方法
种植120 d后采集土壤样品,挑选处理1、3、5、6、7、9处理根袋内土样24个及两种土质各4个根袋外土样,共32个土样进行土壤速效养分测试和AMF多样性高通量测序。土壤速效养分测定方法参照《土壤农化分析》[18]。AMF多样性高通量测序,包括DNA提取和PCR扩增、测序、数据处理等过程,与Li等[19]程序一致,由Illumina Hiseq 2500平台进行测序,18S_AMF区域引物为AMV4.5NF(5'-AAGCTCGTAGTTGAATTTCG-3')和AMDGR(5'-CCCAACTATCCCTATTAATCAT - 3')引物对的ITS1可变区进行PCR扩增。扩增程序为:95 ℃预变性5 min,35个循环(95 ℃变性30 s,56 ℃退火30 s,72 ℃延伸40 s),最后72 ℃延伸7 min。
1.2.3 数据统计分析
土壤速效养分数据采用Microsoft office/Excel 2010进行统计分析,方差分析采用RStudio version 1.1.463(基于R Version 3.5.2)中的ANOVA进行,多重比较采用SSR法;非参数秩和检验用boxplerk.R函数完成,采用bonferroni holm方法校正P值。
2 结果与分析
2.1 土壤AMF群落结构及多样性
AMF测序中,32个样品测序共获得 2,550,239对Reads,双端Reads拼接、过滤后共产生2,446,666条Clean tags,平均每个样品产生76,458条Clean tags。不同处理的AMF主要分布在球囊霉属(Glomus)、无梗囊霉属(Acaulospora)、盾巨孢囊霉属(Scutellospora)、类球囊霉属(Paraglomus)和双型囊霉属(Ambispora)。
粘土各处理可确定的AMF物种数量有14~17个。相比其它处理,粘土根袋外(Claysoil)发现4个独有种,分别为Glomus sp.Alguacil09b、Glomus sp.VTX00222、Glomus sp.VTX00319、Glomus sp.VTX00419,有效tags数在669~1243之间;根袋内独有种Glomus sp. VTX00227、Glomus sp. Kluber12、Glomus sp.VTX00310、Paraglomus sp.VTX00308。说明这些种对粘土具有高度专一性。砂质壤土各处理可确定的AMF物种数量在14~16个。砂质壤土独有种包括Glomus sp.Glo-E VTX00319、Glomus sp.VTX00085、Acaulospora sp.VTX00242、Acaulospora. sp.VTX00026、Paraglomus sp.VTX00375,有效tags数在118~8218之间。根袋外(Sandsoil)有两个特有种:Glomus.Glo-E VTX00319、Glomus sp.VTX00085,Glomus sp.VTX00099在Sand100中大量繁殖,其有效tags达到18489个;Glomus sp.VTX00120仅在Sand200中出现。
粘土处理根袋内外共有的可注释AMF有12种,包括:Acaulospora sp.VTX00024、S.LH-Sc01、Scutellospora sp.VTX00041、G.clarum、Glomus sp.VTX00090、Glomus sp.VTX00248、Glomus sp.VTX00270、Glomus sp.VTX00280、Glomus sp.VTX00362、Glomus sp.VTX00399、Glomus sp.VTX00403、Paraglomus sp.VTX00238。而砂质壤土中还发现Acaulospora sp.VTX00026。
由图1可见,粘土不同处理的AMF主要为球囊霉属(Glomus)、无梗囊霉属(Acaulospora)、盾巨孢囊霉属(Scutellospora)和类球囊霉属(Paraglomus)。其中球囊霉属的相对丰度范围为76.18%~82.75%,扣除无法注释的种(45.41%~57.70%),可注释的球囊霉属丰度范围为18.10%~31.97%;无梗囊霉属的相对丰度范围为2.78%~9.36%;盾巨孢囊霉属的范围为0.31%~10.14%;类球囊霉属相对丰度较小,范围在0.48%~0.71%。
砂质壤土各处理AMF主要分布在球囊霉属(Glomus)、无梗囊霉属(Acaulospora)、盾巨孢囊霉属(Scutellospora)、类球囊霉属(Paraglomus)和双型囊霉属(Ambispora)。其中球囊霉属的相对丰度范围为29.61%~49.72%,可注释的球囊霉属丰度范围为18.10%~31.97%;无梗囊霉属的相对丰度范围为14.18~28.82%;盾巨孢囊霉属范围为5.42%~17.20%;类球囊霉属和双型囊霉属相对丰度较小,范围分别在0.01%~0.58%和0.02%~0.19%之间。
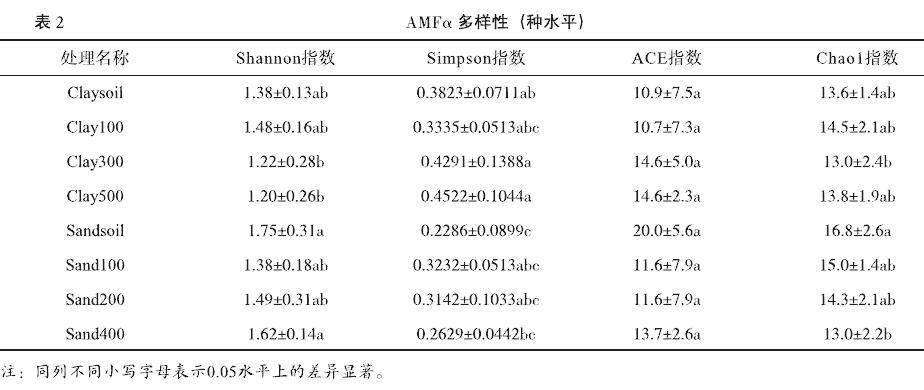
α多样性用于反映样品物种丰度及多样性,多样性指标包括Shannon指数、Simpson指数、均匀度指数ACE和丰富度指数Chao1。由表2可知,各处理均匀度指数ACE指数无显著差异。Shannon指数显示为同种土质内不同处理无显著差异,不同土质间表现为Sandsoil和Sand400显著高于Clay300和Clay500。Simpson指数也表现为同种土质无显著差异,但不同土质间表现为Clay300和Clay500显著高于Sandsoil和Sand400。丰富度指数Chao1表现为粘土各处理间无显著差异;Sandsoil显著大于Sand400,且显著大于Clay300。
由PERMANOVA检验(表3)可以看出,AMF的种间差异主要表现在两种土壤质地之间,包括Claysoil与Sandsoil、两种土壤的根袋内样品,Clay100与Claysoil、Clay100与Sand100之间差异显著,但Sand100与Sandsoil差异不显著。
2.2 土壤速效养分与AMF相关性分析
AMF属相对丰度与土壤速效养分之间的RDA分析结果表明,土壤速效养分各指标对土壤AMF的总方差的解释率为55.95%,其中第一典范轴(RDA1)和第二典范轴(RDA2)的解释率分别为52.60%和2.64%(图2)。对各典范轴进行置换检验,其整体F/sig为6.604/0.001,达到极显著水平。具体到单个典范轴,只有第一典范轴(RDA1)达到了显著水平(F/sig为31.045/0.001)。
Glomus,Scutellospora和Acaulospora的矢量长度比Ambispora和Paraglomus长,表明前三者对RDA1和RDA2的贡献率均较大。Glomus与Scutellospora和Acaulospora均为负相关,与Paraglomus正相关;Scutellospora与Acaulospora,Ambispora正相关。土壤速效养分的向量均位于第三象限,之间的夹角均为锐角,表明两两之间均为正相关,硝态氮与速效钾最明显,二者几乎在一条直线上。另经检验,速效钾(AK)与铵态氮(NH4)的Pearson相关系数高达0.739,达到极显著水平。Glomus与速效磷、速效氮、铵态氮正相关,与铵态氮和速效钾相关性不明显。Acaulospora与速效磷,速效氮的夹角为钝角,表现为较弱的负相关。而Scutellospora则与所有速效养分都表現出了较强烈负相关。Paraglomus与所有速效养分均表现出了正相关,而Ambispora与大部分速效养分均表现出了负相关。
粘土4个处理共16个样点,有11个分布在第三象限,5个分布在第二象限,对RDA1的贡献均为负值;砂质壤土则有3个样点对RDA1的贡献为正,其它13个点均在第一和第四象限。三序图上两种土壤的样点的分布也说明二者之间的AMF群落结构差异。
3 讨论与结论
AMF是土壤微生物区系中分布最为广泛的一类菌根真菌,能与地球上90%的维管植物形成丛枝菌根,从而促进作物对养分的吸收,适应逆境胁迫。本研究中AMF主要为球囊霉属(Glomus)、无梗囊霉属(Acaulospora)、盾巨孢囊霉属(Scutellospora)、类球囊霉属(Paraglomus)和双型囊霉属(Ambispora)。双型囊霉属仅在砂质壤土中检测到一个种。苏凤秀等[13]调查发现,广西木薯主产区土壤有19种AMF孢子,球囊霉属(Glomus)和无梗囊霉属(Acaulospora)为优势类群,本研究可确定的AMF属有5个,优势属同样为球囊霉属和无梗囊霉属,各处理物种数分别为14~17个,与其研究结果相似。
本研究中,两种土质各处理AMF在属和种水平的相对丰度最高的均为球囊霉属,而双型囊霉属仅在砂质壤土中分布,且相对丰度较低,仅为0.02%~0.19%。球囊霉属分布广泛,适应性强,是AMF中的优势菌属,比其他类群更容易适应环境变化[20],与植物根际氮磷利用率显著相关的关键微生物类群[21]。球囊霉属真菌除了具备促进作物氮磷利用的功能外,还可以通过分泌球囊霉素提高土壤有机质含量,改善土壤排水通气状况,进而提高作物对氮磷养分的利用[22]。本研究两种不同的土质中均检测到独有种。其中,粘土根袋外(Claysoil)检测到球囊霉属的4个独有种,分别为Glomus sp.Alguacil09b、Glomus sp.VTX00222、Glomus sp.VTX00319、Glomus sp.VTX00419;Glomus sp.VTX00227、Glomus sp.Kluber12、Glomus sp.VTX00310、Paraglomus sp.VTX00308为根袋内特有种。说明这些种对粘土具有高度专一性,生存环境的改变都会导致其消失或者休眠到无法检测。而根袋内发现特有种,说明其对根域土壤具有专一性,可能受木薯根系分泌物等因素影响。砂质壤土独有种包括Glomus sp.Glo-E VTX00319、Glomus sp.VTX00085、Acaulospora sp.VTX00242、Acaulospora sp.VTX00026、Paraglomus sp.VTX00375。根袋外有两个特有种:Glomus sp.Glo-E VTX00319、Glomus sp.VTX00085;而Glomus sp.VTX00099在根袋内土壤为100 g时大量繁殖,其有效tags达到18489个,说明其分布受根距影响较大。且作者在前期的研究中发现[17],根袋中100 g土可视为根际土壤,表明该种是砂质壤土条件下木薯根际特有种,受根际影响大。
不同土壤类型、质地、土壤肥力因子都会显著影响AMF的种属分布、孢子密度和AM的侵染状况[23-24]。本研究中两种土质各处理AMF在属水平上无显著差异,但种水平分布受土壤质地及根袋内土重的影响,粘土的AMF多样性(Simpson指数)高于砂质壤土。木薯是典型的AMF依赖型植物,AMF群落保持稳定性可能是由于其更多与植物进行交互作用,试验处理对其多样性影响较小。两种土壤质地里都发现独有种,说明土壤质地对AMF群落分布有一定的影响。RDA分析表明Glomus与速效磷、速效氮、铵态氮正相关。前人研究发现,Glomus与氮磷养分利用率显著相关[21];Acaulospora与速效磷,速效氮弱负相关;而Scutellospora则与所有速效养分都表现出了较强烈负相关;Paraglomus与所有速效养分均表现出了正相关;Ambispora与大部分速效养分均表现出了负相关。
综上所述,木薯根域AMF资源丰富,不同土壤质地条件下AMF群落组成和丰度存在差异,土壤速效养分与AMF群落结构差异密切相关。深入研究土壤因子与AMF多样性和丰度的关系,可为进一步探索AMF在木薯上的应用提供良好的基础,相关内容需进一步研究。
参考文献
[1] Philippot L,Raaijmakers JM,Lemanceau P,et al.Going back to the roots:the microbial ecology of the rhizosphere[J].Nature Reviews Microbiology,2013,11(11):789-799.
[2] 李侠,张丽,杜世杰,等.作物种类对根际土壤可培养微生物数量的影响[J].园艺与种苗,2018,38(08):57-60.
[3] Kowalchuk GA,Buma DS,de Boer W,et al.Effects of above-ground plant species composition and diversity on the diversity of soil-bornemicroorganisms [J].Antonie Van Leeuwenhoek International Journal of General and Molecular Microbiology,2002,81:509-520.
[4] Garbeva P,Van Elsas JD,Van Veen JA.Rhizosphere microbial community and its response to plant species and soil history [J].Plant and Soil,2008,302(1/2):19-32.
[5] 李淑君,王兵爽,王媛,等.叢枝菌根育苗缓解西瓜枯萎病的机制[J/OL].土壤学报,1-13[2020-09-15].http://kns.cnki.net/kcms/detail/32.1119.P.20200729.1335.002.html.
[6] 李晓林,姚青.VA菌根与植物的矿质营养[J].自然科学进展,2000(6):46-53.
[7] 卢李威,卢文祥,汪茜,等.AM菌剂对甘蔗新品系“柳城07-500”的大田生长效应分析[J].中国糖料,2016,38(2):5-7.
[8] 李艳,吴强盛.菌根真菌对不同基因型柑橘根际有效磷含量和磷酸酶活性的影响[J].江苏农业科学,2014,42(6):186-188.
[9] Tedersoo L,Bahram M,Toots M,et al.Towards global patterns in the diversity and community structure of ectomycorrhizal fungi[J].Molecular Ecology,2012,21(17):4160-4170.
[10] 高程,郭良栋.外生菌根真菌多样性的分布格局与维持机制研究进展[J]. 生物多样性,2013,21(4):488-498.
[11] 王宇涛,辛国荣,李韶山.丛枝菌根真菌最新分类系统与物种多样性研究概况[J].生态学报,2013,33(3):834-843.
[12] Oehl F,Laczko E,Bogenrieder A,et al.Soil type and land use intensity determine the composition of arbuscular mycorrhizal fungal communities[J].Soil Biology and Biochemistry,2010,42(5):724-738.
[13] 苏凤秀. 不同AM真菌对木薯的生长效应研究[D].长沙:中南林业科技大学,2012.
[14] Howeler RH,Cadavid LF,Burckhardt E.Response of cassava to VA mycorrhizal inoculation and phosphorus application in greenhouse and field experiments[J].Plant and Soil,1982,69(3):327-339.
[15] 李冬萍,汪茜,龙艳艳,等.丛枝菌根真菌促进大田木薯生长研究[A].中国菌物学会,中国菌物学会2015年学术年会论文摘要集[C].中国菌物学会:中国菌物学会,2015:1.
[16] 郑华,韦云东,李军,等.缓释氮肥和AM菌剂对木薯生长和土壤氮素特征的影响[J].热带作物学报,2018,39(10):1893-1900.
[17] 韦云东,罗燕春,郑华,等.根袋法获取木薯根际土壤及其细菌群落特征研究[J].热带作物学报,2020,41(9):1928-1938.
[18] 鲍士旦.土壤农化分析第3版[M].北京:中国农业出版社,2005.
[19] Li PF,Zhang XC,Hao MD,et al. Effects of vegetation restoration on soil bacterial communities, enzyme activities,and nutrients of reconstructed soil in a mining area on the loess plateau, China[J].Sustainability,2019,11(8):1-16.
[20] Lumini E,Orgiazzi A,Borriello R,et al.Disclosing arbuscular mycorrhizal fungal biodiversity in soil through a land-use gradient using a pyrosequencing approach[J].Environmental Microbiology,2010,12(8):2165-2179.
[21] 唐浩琪,張娜,孙波,等.典型农田土壤中丛枝菌根真菌-根际细菌互作及与氮磷利用的关系[J].微生物学报,2020,60(6):1117-1129.
[22] Behie S W,Bidochka MJ.Nutrient transfer in plant-fungal symbioses[J].Trends in Plant Science,2014,19(11):734-740.
[23] 曹敏,胡开治,刘燕琴,等.高通量测序分析重庆地区茅苍术根际丛枝菌根真菌多样性[J].微生物学通报,2020,47(9):2877-2886.
[24] 任爱天,鲁为华,杨洁晶,等.石河子绿洲区苜蓿地丛枝菌根真菌的多样性及与土壤因子的关系[J].草业科学,2014,31(9):1666-1672.
