3个澳洲坚果MYB蛋白靶基因的克隆与生物信息学分析
2021-11-12李冰,李季东,杨祥燕,蔡元保,李穆,曾黎明,黄思婕
李冰,李季东,杨祥燕,蔡元保,李穆,曾黎明,黄思婕


摘 要:【目的】为阐明澳洲坚果MYB(v-myb avian myeloblastosis viral oncogene homolog)蛋白靶基因的功能及分子作用机制提供了科学的理论依据。【方法】基于澳洲坚果转录组数据和RT-PCR方法克隆澳洲坚果MYB蛋白靶基因,并利用生物信息学分析这些基因编码蛋白质的同源性、系统进化、理化性质、亚细胞定位、跨膜域和信号肽。【结果】获得了3个新的澳洲坚果MYB蛋白靶基因MiTOM1、MiTOM2和MiTOM3,GenBank登录号分别为MT319120、MT319121和MT319122。MiTOM1、MiTOM2和MiTOM3都包含典型结构域VHS-ENTH-ANTH,与其它植物来源的TOM蛋白具有极高的序列相似度,与荷花TOM蛋白(XP_010260421.1、XP_010244847.1和XP_010260421.1)的序列相似度分别高达68.93%、75.76%和68.80%。MiTOM1、MiTOM2和MiTOM3蛋白均为亲水性蛋白。MiTOM1可能定位于细胞核,為非分泌蛋白和非跨膜蛋白;MiTOM2可能定位于细胞质,为跨膜分泌蛋白;MiTOM3可能定位于细胞核或微体,为非分泌蛋白和非跨膜蛋白。蛋白二级结构预测显示,MiTOM1、MiTOM2和MiTOM3二级结构主要含有无规则卷曲和α螺旋。【结论】MiTOM1、MiTOM2和MiTOM3包含TOM家族典型结构域VHS-ENTH-ANTH,可能在澳洲坚果体内物质运输及控制形态发育方面起重要作用。
关键词:澳洲坚果;TOM基因;基因克隆;生物信息学分析
中图分类号:S664.9 文献标志码:A
Cloning and Bioinformatics Analysis of Three MYB Protein Target Genes from Macadamia (Macadamia integrifolia)
LI Bing,LI Jidong,YANG Xiangyan,CAI Yuanbao*,
LI Mu,ZENG Liming,HUANG Sijie
(Guangxi Subtropical Crops Research Institute, Guangxi Academy of
Agricultural Sciences, Nanning, Guangxi 530001, China)
Abstract: 【Objective】This study provides a scientific theoretical basis for elucidating the function and molecular mechanism of macadamia MYB (v-myb avian myeloblastosis viral oncogene homolog) protein target genes.【Method】Based on the macadamia transcriptome data, 3 MYB protein target genes of macadamia were cloned by RT-PCR method, and the homology, phylogeny, physicochemical properties, subcellular localization, transmembrane domains, and signal peptides of these genes encoding proteins were analyzed by bioinformatics.【Result】Three new MYB target genes MiTOM1, MiTOM2 and MiTOM3 were cloned. The GenBank accession numbers are MT319120, MT319121 and MT319122 respectively. MiTOM1, MiTOM2 and MiTOM3 which contain the typical domain VHS-ENTH-ANTH, have high sequence similarity with other plant TOM proteins. The amino acid sequence similarity between MiTOM1 and the lotus TOM proteins (XP_010260421.1, XP_01024847.1, XP_010260421.1) reach 68.93%, 75.76%, and 68.80%, respectively. MiTOM1, MiTOM2 and MiTOM3 are hydrophilic proteins. MiTOM1 which might be located in the nucleus is non-secretory and non-transmembrane proteins; MiTOM2 which might be located in the cytoplasm is transmembrane secretory proteins; MiTOM3 which might be located in the nucleus or microbodies is non-secretory and non-transmembrane proteins. Protein secondary structure prediction shows that MiTOM1, MiTOM2 and MiTOM3 secondary structures mainly contained irregular crimp and α helix. 【Conclusion】MiTOM1, MiTOM2 and MiTOM3 which include TOM family typical domain VHS-ENTH-ANTH, may play an important role in material transportation and morphological development in macadamia.
Key words: Macadamia (Macadamia integrifolia); TOM genes; gene cloning; bioinformatics analysis
转录因子通过识别靶基因上游启动子区高度保守的特异碱基序列并与之结合,对靶基因的表达进行调控,进而调控植物生长发育、生理代谢以及各种逆境胁迫的应答机制。因此,通过MYB靶基因TOM家族基因的克隆及生物信息学研究,对于阐明澳洲坚果生长发育调控及抗逆分子机制具有重要意义。
植物中转录因子的类型多样,常见的有WAKY类、ERF类、MYB类等,其中MYB类转录因子是植物转录因子中数量较多的家族之一,按其保守结构域数目的差异可分为R1-MYB、R2R3-MYB、R1R2R3-MYB和R4-MYB四个家族[1]。MYB转录因子功能多样,在植物生物与非生物胁迫的调节以及植物的整个新陈代谢过程都起着无可代替的作用[2,3,4]。已有的澳洲坚果MYB研究结果表明,MYB家族转录因子成员在澳洲坚果生长发育和产量形成过程中起重要作用[5]。但是,有关MYB转录因子的靶基因及其调控机制在国内外鲜有报道。TOM1(TOM1-LIKE PROTEIN)是MYB的一个靶标蛋白,与包含VHS(VPS27,Hrs和STAM)结构域的GGA家族密切相关,是第一个被鉴定为具有VHS结构域的蛋白质超家族的成员[6, 7]。已有研究表明,TOM1是内皮素的效应子,并可能在植物体内运输中起重要作用[8]。Korbe等研究发现拟南芥中MYB靶标蛋白TOL(属于TOM1类蛋白)作为泛素结合蛋白通过调节生长素的动态分布及其相关生长反应,从而控制植株形态发育,并在降解PM蛋白中起作用[9]。Jeanette等研究结果表明,TOL蛋白在植物中作为多价泛素受体起作用,通过运输所需的保守内小体分选复合物(ESCRT)途径控制泛素化的货物输送到液泡[10]。整体而言,目前国内外对植物TOM基因的功能研究并不多,其作用的分子机制也不清楚。
澳洲坚果(Macadamia integrifolia)属山龙眼科澳洲坚果属植物,是一种原产于澳洲东南部热带雨林的常绿果树,素有“干果之王”的美誉。全球热带和亚热带约30个国家和地区种植澳洲坚果,我国云南、广西、贵州、广东等省区也广泛种植。澳洲坚果对生长环境条件要求比较高,干旱、冷害等逆境条件会影响澳洲坚果的正常生长发育。由于地形和环境影响,国外优良品种引入我国种植后,受到低温、干旱、病虫害等多种生物胁迫和非生物胁迫,澳洲坚果的产量和品质都有所下降[11-14]。通过对澳洲坚果TOM家族基因的克隆和生物信息学分析,阐明TOM基因在澳洲坚果生长发育中的作用,为澳洲坚果抗逆品种选育奠定基础。但是,目前MYB蛋白靶基因TOM基因在澳洲坚果的相关研究国内外尚未有报道。
本课题组根据澳洲坚果抗寒转录组数据,结合RT-PCR方法克隆获得3个MYB蛋白靶基因,利用生物信息学分析其编码蛋白的结构与功能,为深入研究澳洲坚果TOM基因在物质运输及形态发育中的作用提供科学依据。
1 材料与方法
1.1 试验材料
试验材料为广西亚热带作物研究所澳洲坚果种质资源圃提供的澳洲堅果光壳种(Macadamia integrifolia)品种Own Choice(O.C.)。对接穗为4个月苗龄的嫁接苗低温(4 ℃)处理3 h后,采集叶片液氮速冻处理后置于冰箱-80℃保存备用。实验所用RNA逆转录试剂盒、DNA凝胶回收试剂盒、DNA聚合酶、DNA Marker、pMD-18T载体等购自大连宝生物工程有限公司。
1.2 总RNA提取及cDNA合成
参照蔡元保等[15]的CTAB改良法提取澳洲坚果叶片总RNA,利用核酸蛋白检测仪分析所提取的总RNA纯度和浓度,用1.5 %琼脂糖凝胶电泳检测总RNA的完整性。将抽提好的RNA经DNAaseI进行DNA消化后,取1 ug 总RNA,用RNA逆转录试剂盒(TaKaRa,大连)进行反转录,合成cDNA第一链,将合成好的cDNA置于冰箱-20℃保存。
1.3 澳洲坚果MYB蛋白靶基因克隆
本课题组从澳洲坚果抗寒转录组中获得了3个MYB蛋白靶基因,利用NCBI在线引物设计网站(https://blast.ncbi.nlm.nih.gov/Blast.cgi)设计这3个基因的CDS克隆引物MiTOM1-F/MiTOM1-R,MiTOM2-F/MiTOM2-R和MiTOM3-F/MiTOM3-R(表1),所用引物全部由大连宝生物工程有限公司合成。
取1.0 μL澳洲坚果叶片的 cDNA 模板进行PCR扩增,PCR扩增总体系25μL,反应体系包括cDNA模板1.0 μL,2×Ex Taq PCR Master Mix 12.0 μL,正向和反向引物(20 mol/L)各1.0 μL,无菌dd H2O 10 μL。反应条件为94℃预变性5 min,94℃变性 45 s,50.2~53.6 ℃(具体见表1)退火 45 s,72℃延伸 1.5 min,扩增35个循环,最后72℃再延伸 7 min。PCR扩增产物经1.0 %琼脂糖凝胶电泳检测后,采用DNA凝胶回收试剂盒(TaKaRa,大连)进行回收与纯化,将其连接到T载体pMD18上,转化到大肠杆菌DH5α感受态细胞,用含氨苄青霉素抗性的LB固体培养基进行筛选并采用菌落PCR方法挑取阳性克隆,送至上海生工生物工程公司进行序列测序。
1.4 生物信息学分析
利用NCBI网站的BLAST程序进行澳洲坚果MYB蛋白靶基因编码蛋白质序列和功能结构域的同源检索,用PROSITE和SMART软件预测功能结构域,用ProtParam软件分析目标蛋白质的理化性质,用PSORT软件分析蛋白质的亚细胞定位,用SignalP 4.1软件预测蛋白信号肽,用TMpred软件预测蛋白质的跨膜域,用SOPMA软件进行蛋白二级结构预测。在NCBI网站GenBank中查找同源蛋白,并用MEGA 7.1软件邻接法(Neighbor-joining,NJ)构建同源蛋白的系统发育进化树。
2 结果与分析
2.1 3个澳洲坚果MYB蛋白靶基因隆与序列分析
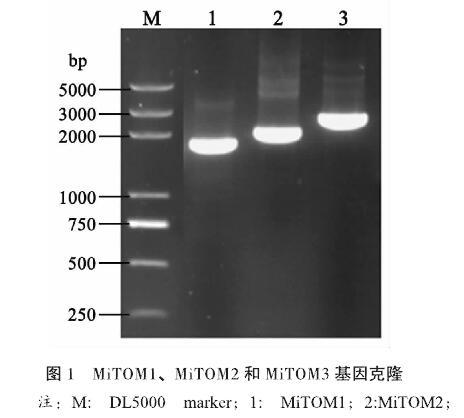
以澳洲坚果叶片cDNA为模板,利用特异性引物(表1)扩增3个TOM基因含有开放阅读框的cDNA片段,凝胶电泳后,分别扩增出了1841 bp、2127 bp和2473 bp的目的条带(图1),DNA片段回收后连接到T载体pMD18,经序列测序验证后,分别命名为MiTOM1、MiTOM2和MiTOM3。序列分析结果显示,MiTOM1基因开放阅读框长1542 bp,编码一个包含513个氨基酸序列的蛋白质,基因登录号MT319120;MiTOM2基因开放阅读框长972 bp,编码一个包含323个氨基酸序列的蛋白质,基因登录号MT319121;MiTOM3基因开放阅读框长1407 bp,编码一个包含426个氨基酸序列的蛋白质,基因登录号MT319122。
2.2 澳洲坚果MiTOM1、MiTOM2、MiTOM3蛋白理化性质分析
通过ProtParam软件分析蛋白理化性质表明,MiTOM1编码氨基酸数量513个,分子质量56.44 kD,理论等电点(PI)5.07,分子式为C2475H3903N685O794S15,带负电荷残基(Asp+Glu,天冬氨酸+谷氨酸)71个,带正电荷残基(Arg+Lys,精氨酸+赖氨酸)48个,脂肪指数79.61,亲水性总平均值(GRAVY,grand average of hydrophilicity)-0.552。
MiTOM2编码氨基酸数量323个,分子质量36.15 kD,理论等电点6.33,分子式C1600H2602N438O479S16,带负电荷残基42个,带正电荷残基39个,脂肪指数100.77,亲水性总平均值(GRAVY)-0.160。
MiTOM3编码氨基酸数量468个,分子质量50.96 kD,理论等电点5.12,分子式C2237H3507N613O724S12,带负电荷残基59个,带正电荷残基43个,脂肪指数73.31,亲水性总平均值(GRAVY)-0.547。
2.3 澳洲坚果MiTOM1、MiTOM2、MiTOM3氨基酸序列同源性分析
MYB蛋白靶基因编码蛋白的同源性检索分析表明(图1),澳洲坚果MiTOM1、MiTOM2、MiTOM3蛋白与TOM家族其他成员具有高度的同源性,都具有TOM家族典型的蛋白结构域VHS-ENTH-ANTH。其中,MiTOM1蛋白与荷花(Nelumbo nucifera,XP_010260421.1)、麻风树(Jatropha curcas,KDP32899.1)、可可(Theobroma cacao,XP_007019272.2)TOM蛋白的氨基酸序列相似度分别为68.93%、64.15%、64.79%;MiTOM2蛋白与荷花(Nelumbo nucifera,XP_010244847.1)、葡萄(Vitis riparia,XP_034690832.1)、酸枣(Ziziphus jujuba,XP_015879670.1)TOM蛋白的序列相似度分别为75.76%、73.38%、73.48%;MiTOM3蛋白与荷花(Nelumbo nucifera,XP_010260421.1)、荷花(Nelumbo nucifera,XP_010270344.1)、赤豆(Vigna angularis,XP_017421990.1)TOM蛋白的序列相似度分别为68.8%、67.17%、65.72%。
2.4 澳洲坚果MiTOM1、MiTOM2、MiTOM3系统进化树分析
利用MAGE 7.1软件构建植物TOM蛋白的系统发育进化树。结果显示(图3),20个TOM蛋白可明显分成2组,其中MiTOM1与MiTOM3处于同一组,与荷花TOM蛋白(XP_0120260421.1,XP_010270344.1)的亲缘关系最近;MiTOM2处于另一组,与荷花TOM蛋白(XP_010244847.1)和相思子TOM蛋白(XP_027340603.1)的亲缘关系最近。
2.5 澳洲坚果MiTOM1、MiTOM2、MiTOM3蛋白疏水性分析
通过ExPASy服务器中的ProtScale程序分析澳洲坚果MiTOM1、MiTOM2和MiTOM3蛋白的疏水性。结果显示,MiTOM1(图4A)、MiTOM2(图4B)和MiTOM3(图4C)的疏水性最大值与亲水性最小值之和都为负值,因此推断这3个蛋白均为亲水性蛋白。与上述的这3个蛋白理化性质分析结果一致,即这3个蛋白的亲水性总平均值(GRAVY)均为负值,推测为亲水性蛋白。
2.6 澳洲坚果MiTOM1、MiTOM2、MiTOM3蛋白功能预测
PSORT软件预测表明,MiTOM1蛋白可能定位于细胞核(概率为30%),MiTOM2蛋白可能定位于细胞质(概率为65%),MiTOM3蛋白可能定位于细胞核和微体(概率均为30%)。利用SignalP和TMpred软件分析蛋白的跨膜结构和信号肽。结果显示,MiTOM1蛋白不存在信号肽和跨膜结构,为非分泌蛋白;MiTOM2蛋白存在2个跨膜结构,为分泌蛋白;MiTOM3蛋白不存在信号肽和跨膜结构,为非分泌蛋白。
2.7 澳洲坚果MiTOM1、MiTOM2、MiTOM3蛋白的二级结构分析
SOPMA软件的二级结构分析结果显示,MiTOM1蛋白二級结构的主要元件是无规则卷曲(Random coil)(54.88%)、α-螺旋(Alpha helix)(36.26%)、折叠延伸链(Extended strand)(4.87%)和β转角(Beta turn)(4.29%)(图5A);MiTOM2蛋白二级结构的主要元件是无规则卷曲(35.29%)、α-螺旋(52.63%)、折叠延伸链(7.43%)和β转角(4.64%)(图5B);MiTOM3蛋白二级结构的主要元件是无规则卷曲(56.84%)、α-螺旋(36.32%)、折叠延伸链(4.49%)和β转角(2.35%)(图5C)。可见,这3个蛋白的VHS-ENTH-ANTH结构域主要由α-螺旋组成。
3 讨论
转录因子靶基因的预测与验证是功能基因组研究的一种重要方法。不但可为基因功能解析提供参考,也可了解基因的表达调节机理,并进一步构建基因表达的调控网络。MYB转录因子参与植物生长发育、生理代谢以及各种逆境胁迫的应答机制[2,3,4]。TOM是MYB蛋白的一个靶基因,其编码蛋白包含TOM家族典型结构域VHS-ENTH-ANTH[6, 7]。
澳洲坚果MiTOM1、MiTOM2和MiTOM3与其它TOM家族成员的氨基酸序列具有高度相似性,且都含有结构域VHS-ENTH-ANTH。可见,澳洲坚果MiTOM1、MiTOM2和MiTOM3属于TOM家族,即同样作为MYB靶标蛋白。系统发育进化树分析显示,这3个澳洲坚果TOM蛋白分别属于2个不同的进化分支。进化关系接近且处于同一进化分支的成员可能具有类似的空间结构和生物学功能[16,17],这为进一步研究3个澳洲坚果TOM蛋白的功能特征奠定基础。
澳洲坚果MiTOM1和MiTOM3可能定位于细胞核或微体,不存在信号肽和跨膜结构,推测这2个蛋白作为非分泌亲水蛋白行驶其生物学功能。澳洲坚果MiTOM2蛋白可能定位于细胞质,存在2个跨膜结构,作为分泌亲水蛋白在翻译后进行蛋白加工和剪切。这3个澳洲坚果TOM蛋白二级结构的主要元件是无规卷曲和α-螺旋,并夹杂着折叠延伸链,且这些结构相对保守。而且,这3个TOM蛋白VHS-ENTH-ANTH结构域的主要组成是α-螺旋。这说明在长期的进化过程中,澳洲坚果MiTOM1、MiTOM2和MiTOM3蛋白的空间结构相对保守,推测其有类似的生物学功能。
已有研究表明,作为MYB蛋白的靶基因TOM1和TOL能够调节植物体内运输,调节生长素的动态分布及其相关生长反应,从而控制植株形态发育[8-10]。同属于TOM家族的澳洲坚果MiTOM1、MiTOM2和MiTOM3,与这些MYB靶标蛋白具有高度的序列相似性和进化同源性。因此,推测澳洲坚果MYB转录因子通过识别这3个靶基因上游启动子区高度保守的特异碱基序列并与之结合,对这些靶基因的表达进行调控,进而在澳洲坚果体内物质运输及控制形态发育方面起重要作用。至于这3个澳洲坚果TOM基因在调控其生长发育及抗逆分子机制方面还有待于深入研究。
参考文献
[1] Rosinski JA, and Atchley WR. Molecular evolution of the Myb family of transcription Factors: evidence for polyphyletic origin[J]. Journal of Molecular Evolution, 1998,46(1): 74-83.
[2] Wang ZY, Song FB, Cai H, et al. Over-expressing GsGST14 from glycine soja enhances alkaline tolerance of transgenic Medicago sativa[J]. Biologia Plantarum, 2012,56(3): 516-520.
[3] An YM, Song LL, Liu YR, et al. De Novo Transcriptional Analysis of Alfalfa in Response to Saline-Alkaline Stress[J]. Frontiers in Plant Science, 2016,7(931): 1-14.
[4] Ji CL, Mao X, Hao JY, et al.Analysis of bZIP Transcription Factor Family and Their Expressions under Salt Stress in Chlamydomonas reinhardtii [J]. International Journal of Molecular Sciences,2018,19(9): 2800.
[5] 王文林,肖海艳,郑树芳,等. 澳洲坚果MiMYB2基因克隆及结构与功能分析[J]. 植物研究,2020,40(06): 913-922.
[6] Boman AL. GGA proteins: new players in the sorting game[J]. Journal of Cell Science, 2001,114(Pt 19): 3413-3418.
[7] Lohi O, Lehto VP. VHS domain marks a group of proteins involved in endocytosis and vesicular trafficking[J]. FEBS Letters,1998,440(3): 255-257.
[8] Seet LF, Liu N, Hanson BJ, et al.Endofin recruits TOM1 to endosomes[J]. Journal of Biological Chemistry,2004,279(6): 4670.
[9] Korbei B, Moulinieranzola J, Dearaujo L,et al. Arabidopsis TOL proteins act as gatekeepers for vacuolar sorting of PIN2 plasma membrane protein[J]. Current biology: CB, 2013,23(24): 2500-5.
[10] Moulinier-Anzola J , Schwihla M, De-Araujo l, et al. TOLs function as ubiquitin receptors in the early steps of the ESCRT pathway in higher plants[J]. Molecular Plant,2020,(5): 717-731.
[11] 王文林, 秦斌华, 彭素娜, 等. 澳洲坚果“桂热1号”叶片矿质养分周年动态变化研究[J].南方农业学报,2013,44(3): 463-466.
[12] 黄炳成, 李杨. 广西澳洲坚果几种主要虫害及病害防治措施研究[J]. 产业与科技论坛, 2017,16(13): 55-56.
[13] 宫丽丹, 倪书邦, 贺熙勇, 等. 干旱胁迫下保水剂对澳洲坚果生长及水分特征参数的影响[J]. 热带农业科技,2017,40(01): 17-19.
[14] 岳海, 李國华, 李国伟, 等. 澳洲坚果不同品种耐寒特性的研究[J]. 园艺学报,2010,37
(01): 31-38.
[15] 蔡元保, 杨祥燕, 孙光明, 等. 菠萝花发育相关基因AcMADS1的克隆与组织表达特性分析[J]. 植物学报, 2014,49(06): 692-703.
[16] 李穆, 蔡元保, 杨祥燕, 等. 菠萝MYB基因AcoMYB1的克隆与表达分析[J]. 热带作物学报,2021,42(3): 1-8.
[17] 李季东, 杨祥燕, 蔡元保, 等. 澳洲坚果蛋白磷酸酶基因MiSTPP1和MiSTPP4克隆与生物信息学分析[J]. 福建农业学报,2021,36
(2): 176-181.
