黄芪多糖对黄嘌呤氧化酶活性的抑制作用
2021-11-12姜丽丽李沐轩徐宋瑶扈瑞平薛慧婷
李 晶,姜丽丽*,李沐轩,邓 凤,徐宋瑶,薛 昕,扈瑞平,薛慧婷
(1.内蒙古医科大学 基础医学院,内蒙古 呼和浩特010110;2.内蒙古医科大学 附属医院,内蒙古 呼和浩特010110)
痛风是由持续的高尿酸血症引发的代谢类疾病,表现为炎性反应,近年来发病率呈迅速上升趋势,严重影响人类健康[1]。黄嘌呤氧化酶(xanthine oxidase,XOD)是尿酸生成的关键酶,普遍存在于各种生物体中,因其在体内发生氧化作用产生尿酸,时间长了还会引起各种并发症[2-3]。临床上常将黄嘌呤氧化酶抑制剂用作治疗高尿酸血症的药物。别嘌呤醇是典型的黄嘌呤氧化酶抑制剂,目前广泛应用于痛风的临床治疗,但是长期使用别嘌呤醇会有肝损害等各种不同程度的毒副作用产生,用药安全性一直困扰着人们,而安全无毒的中草药是目前开发和研究的方向[4]。
黄芪多糖(Astragalus polysaccharides,APS)是黄芪药材的主要成分之一,属于大分子有机化合物,由葡萄糖、鼠李糖、果糖、阿拉伯糖、半乳糖醛酸和葡萄糖醛酸等组成,是水溶性的淡黄色粉末,有抗氧化、抗病毒、调节免疫、抗肿瘤等作用[5-6]。目前多糖在降尿酸的作用方面逐渐被人们发现,文献报道的有甘草多糖、鼠尾藻多糖和海带多糖等,通过抑制黄嘌呤氧化酶活性阻碍尿酸合成,从而减少体内尿酸浓度[3,7]。茯苓多糖可能是通过上调高尿酸血症大鼠的肾脏尿酸相关有机阴离子转运体 1(rOAT1)的表达和下调尿酸转运体1(rURAT1)的表达,从而增加了尿酸的排泄[8]。黄芪多糖对黄嘌呤氧化酶的抑制作用及抗高尿酸血症的机理研究未见报道。鉴于当前天然产物及活性提取物在痛风病中的作用已逐渐成为研究热点,结合黄芪多糖的功效范围广、副作用低、多靶点作用等特点,通过考察黄芪多糖对黄嘌呤氧化酶的抑制作用机理,探讨其降尿酸作用的酶反应机制,为今后指导临床用药提供新的参考,同时为开发道地黄芪的生物学功能及产品的深加工提供依据。
1 材料与方法
1.1 材料与试剂
选取内蒙古道地药材蒙古黄芪的干燥根,粉碎过筛,60℃烘干至恒质量,密封保存备用。黄嘌呤氧化酶(XOD) ,黄嘌呤(xanthine):Sigma 公司产品;别嘌呤醇(纯度98%):罗恩试剂;磷酸二氢钾、磷酸氢二钾、EDTA-2Na、氢氧化钠:国药集团药品。
1.2 仪器与设备
RE212-B型旋转蒸发仪:郑州长城科工贸有限公司制造;Scientz-N型真空冷冻干燥机:宁波新芝生物科技有限公司制造;TU1810型紫外可见分光光度计:北京普析通用仪器有限公司制造;QE-1000型高速万能粉碎机:上海新诺仪器设备有限公司制造;DHG-9240A型电热鼓风干燥箱:上海一恒科学仪器有限公司制造;TD5M型多管架自动平衡离心机:上海卢湘仪离心机仪器有限公司制造;SHHW21.600AⅡ型三用恒温水箱:天津泰斯特仪器有限公司制造;PX224ZH型电子天平:奥豪斯仪器(常州)有限公司制造。
1.3 方法
1.3.1 黄芪多糖的制备 采用水提醇沉法提取黄芪多糖,参考文献[9-12]优化改进,蒙古黄芪干燥根用粉碎机粉碎,过60目筛子后于60℃烘干至恒质量,按相应液料体积比1∶11加纯水,80℃浸提2 h,旋蒸浓缩后,经8 g/dL三氯乙酸除蛋白质3次,再用无水乙醇醇沉过夜,4 000 r/min离心5 min,沉淀经无水乙醇清洗后真空冷冻干燥,得黄芪多糖,用硫酸-苯酚法测得黄芪多糖提取纯度大于70%,密封保存备用。
1.3.2 黄芪多糖对XOD抑制作用的测定 在酶促反应过程中,XOD通过催化底物黄嘌呤反应生成尿酸,尿酸在294 nm处具有特征吸收峰。将文献[13]的方法进行改进,分为4个处理组,按照表1进行加样。在反应体系中依次加入磷酸缓冲液(pH 7.5、0.2 mol/L)、底物黄嘌呤溶液(1 mmol/L)、不同质量浓度的黄芪多糖溶液,加样完毕后于25℃水浴10min,再加入25℃预温后的酶液(8 μg/mL),混合均匀,从加入酶液开始计时,反应时间1 min,紫外分光光度计测定吸光度值(A294)。
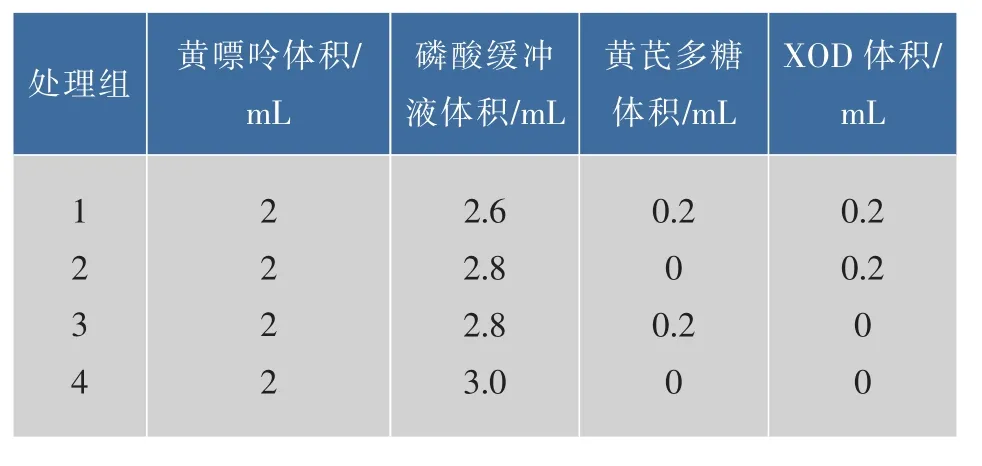
表1 酶活力测定体系的组成Table 1 Composition of enzyme reaction system
以公式 I(%)=[1-(A1-A2)/(A3-A4)]×100% 计算不同质量浓度黄芪多糖对XOD的抑制率(I)。其中:A1~A4为处理组1—4在 294 nm处测得的吸光度值。以多糖质量浓度对抑制率作图,线性拟合得拟合方程,计算抑制率为50%时对应的黄芪多糖质量浓度,即为半抑制浓度(IC50)。
1.3.3 黄芪多糖对XOD抑制动力学研究 酶活力测定体系中,设定底物黄嘌呤溶液浓度为1 mmol/L,加入不同质量浓度黄芪多糖溶液 (0.4、0.8、1.2 mg/mL),测定在不同质量浓度酶液(6、8、10、12 μg/mL)反应条件下多糖对酶活力的影响。以加入的酶质量浓度作为横坐标,酶促反应的速率为纵坐标作图,得到一组直线,若直线平行为不可逆抑制;若直线通过原点则为可逆抑制。
酶活力测定体系中,酶质量浓度(8 μg/mL)不变,加入不同质量浓度黄芪多糖溶液(0.4、0.8、1.2 mg/mL),测定在不同浓度底物黄嘌呤(0.6、0.8、1、1.2 mmol/L)条件下的反应速率,通过双倒数作图法,以底物浓度倒数对反应速率倒数作图,根据所得曲线的形状判断黄芪多糖对XOD的抑制类型。按照Dixon作图法,计算得到抑制常数Ki值。
1.3.4 黄芪多糖与别嘌呤醇对XOD的联合作用探究 采用等毒法评价黄芪多糖与别嘌呤醇对XOD的联合作用效果[14]。首先测定黄芪多糖和别嘌呤醇单独使用时对XOD抑制率达到25%时各自的质量浓度,按照该质量浓度配制黄芪多糖和别嘌呤醇,将二者1∶1混合加入反应体系,测定混合物对XOD的抑制率,并按如下公式计算得到共毒系数,对黄芪多糖与别嘌呤醇对XOD的联合作用效果进行评价。
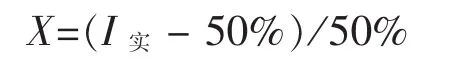
式中:X表示共毒系数;I实表示实测抑制率。
1.3.5 数据处理 实验中所有样品平行操作3次,数据以平均值±标准偏差表示,使用SPSS 19.0软件进行数据处理,Origin 8.0软件作图。
2 结果与分析
2.1 黄芪多糖对XOD的抑制作用
黄芪多糖对XOD表现出抑制作用,当黄芪多糖溶液质量浓度为0~0.4 mg/mL时,随着多糖质量浓度的增加,黄芪多糖对XOD的抑制率呈线性逐渐升高,表现出剂量依赖关系;在0.4~1.4 mg/mL时,抑制率随着多糖质量浓度的增大而增大,但增长趋势变缓;当多糖质量浓度大于1.4 mg/mL时抑制率趋于恒定。对图1曲线进行线性拟合,计算得黄芪多糖对XOD的半抑制质量浓度为1.37 mg/mL。

图1 不同质量浓度黄芪多糖对XOD活力的影响Fig.1 Effect of APS concentration on XOD activity
2.2 黄芪多糖对XOD抑制动力学分析
固定底物浓度不变,在酶活力测定体系中加入不同质量浓度的黄芪多糖,酶促反应的速率V随酶质量浓度的变化而变化,以酶质量浓度对反应速率作图,得到一组相交于原点的直线,并且直线斜率随着多糖溶液质量浓度的增大而减小,见图2。说明黄芪多糖对XOD属于可逆抑制,黄芪多糖分子是通过非共价键与XOD结合导致了酶活性的降低,这种抑制作用是可逆的,使用物理方法可以使酶恢复活性。
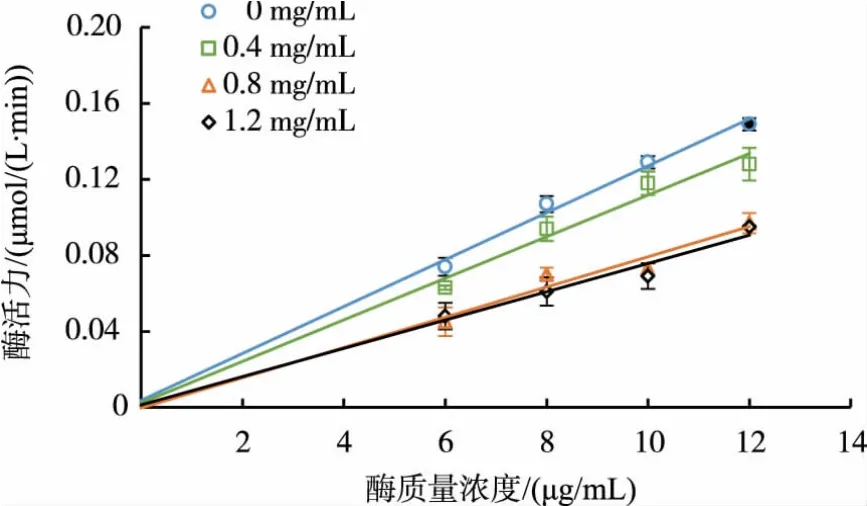
图2 黄芪多糖对XOD的抑制作用机理Fig.2 Inhibition mechanism of APS on XOD
在酶促反应过程中,体系中酶质量浓度固定不变,改变底物黄嘌呤溶液的质量浓度,测定不同质量浓度多糖溶液加入时对酶活力的影响。双倒数作图法得到一组直线,见图3。随着多糖质量浓度的增大,直线斜率逐渐减小,且纵轴上的截距基本不变,符合酶的竞争性抑制的特征,因此,黄芪多糖为XOD的一种竞争性可逆抑制剂。采用Dixon作图法,选取2个不同浓度的底物反应体系,以黄芪多糖质量浓度对酶反应速率倒数作图,得到2条直线,见图4。根据两直线的交点坐标计算求得抑制常数 Ki值为 0.59 mg/mL。
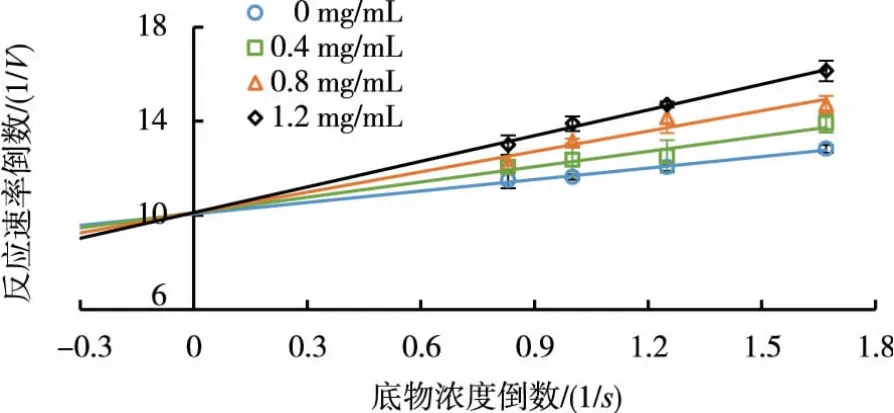
图3 黄芪多糖对XOD的抑制类型的测定Fig.3 Determination of inhibition types of APS on XOD

图4 黄芪多糖对XOD抑制常数的测定Fig.4 Determination of XOD inhibition constants of APS
2.3 黄芪多糖与别嘌呤醇对XOD的联合作用效果评价
将黄芪多糖与别嘌呤醇单独使用时对XOD抑制率达到25%的剂量混合,混合物对XOD的联合抑制作用结果见表2。混合物对XOD的联合抑制率为26.67%±1.15%,共毒系数为-46.66±2.65。根据共毒系数理论,黄芪多糖与别嘌呤醇的联合作用类型为拮抗作用,说明二者同时使用会降低各自对XOD的抑制效果。
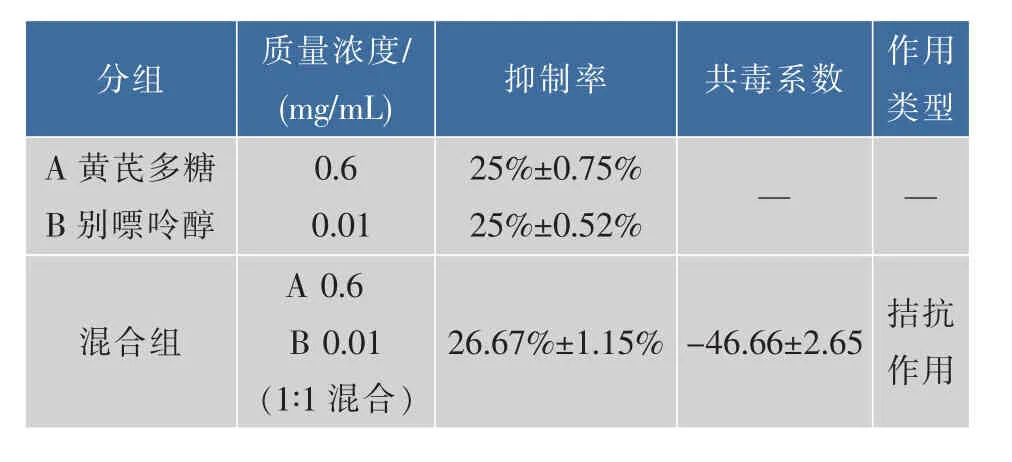
表2 混合物对XOD活性的联合作用效果Table 2 Combined effect of mixture on XOD activity
3 结 语
近年来,有关中药提取物对XOD抑制作用的研究已有相关报道,李英等研究了金银花水提物对XOD的抑制作用,经测定其IC50为1.95 mg/mL[15];王亚楠等发现紫苏叶提取物对XOD具有抑制作用,IC50为5.8 mg/mL[16]。申启荣研究了17种中药的水提物和醇提物对XOD的抑制作用,这些抑制剂的IC50基本处于0.5~5.5 mg/mL范围内[17]。综合这些研究结果发现,目前中药来源对XOD具有抑制作用的活性物质主要集中于水提物或醇提物,多糖对XOD的抑制作用研究较少。本研究的特色在于采用了三氯乙酸除蛋白质3次,有效降低了生物体中主要成分蛋白质对结果的干扰,更能真实体现多糖对XOD的抑制作用。
研究了黄芪多糖在体外对XOD活性的影响,发现黄芪多糖对XOD具有显著抑制作用,IC50为1.37 mg/mL。与其他中药提取物相比,黄芪多糖具有较高的XOD抑制活性。对黄芪多糖的动力学分析表明,黄芪多糖对XOD的抑制作用类型为竞争性可逆抑制,即黄芪多糖与底物黄嘌呤结构相似,二者共同竞争酶的结合部位,抑制剂与酶形成可逆复合物,但这类复合物不能分解形成产物尿酸,这种抑制作用可以通过增加底物黄嘌呤的质量浓度得到解除。此抑制类型与别嘌呤醇作用类型相同,但毒副作用却大大降低,具有开发前景。
作者还探究了黄芪多糖和别嘌呤醇的联合抑制作用,结果显示黄芪多糖和别嘌呤醇的联合抑制作用表现为拮抗作用,说明二者合用的效应小于它们分别作用的总和,但在临床治疗过程中有时也可将具有拮抗作用的药物有意识的配伍使用,以纠正主药的副作用和突出主药的主要作用。基于别嘌呤醇在临床治疗痛风的过程中产生的毒副作用较严重,未来有望将二者同时使用以减轻别嘌呤醇的毒副作用,具体用量与方法还有待进一步研究。
综上所述,虽然黄芪多糖作为一种XOD抑制剂与目前临床应用的化学合成类XOD抑制剂类药物相比抑制活性较低,但是黄芪作为一种本地大量栽培种植的道地中药材,其来源广泛,性温无毒副作用,可以考虑用于痛风患者的预防辅助治疗。在本研究的基础上,未来黄芪多糖在体内对XOD的抑制效果仍需进一步验证,同时多糖相对分子质量的大小及分布对黄嘌呤氧化酶的抑制率有无影响也有待于进一步研究。
