癌痛消方对缺氧肝癌细胞血管生成拟态的影响
2021-11-11黄覃凤张永琴梁丽英杨继峰韦艾凌
黄覃凤,张永琴,梁丽英,杨继峰,韦艾凌
(1.广西中医药大学第一附属医院,广西南宁530023;2.广西中医药大学,广西南宁530200)
肝癌是消化道常见的恶性肿瘤之一。据2020年美国癌症协会公布的癌症数据显示,肝癌患者病例数的增长最为迅速,在2006年至2017年期间每年以2%~3%的速度增加[1]。与此同时,肝癌也是导致癌症死亡的第三大原因[2]。近年研究发现肝癌细胞中存在血管生成拟态(vasculogenic mimicry,VM),具有VM形成的肝癌较容易发生血行转移,恶性程度高且预后较差。肝癌对人类的生命产生极大威胁,如何有效阻断肿瘤的生长转移是提高肝癌诊治水平的关键。本课题组长期致力于肝癌的中西医结合防治研究,在国内首次提出肝癌“瘀”“毒”“虚”新病机理论假说,并据此研制出癌痛消方应用于临床防治原发性肝癌,疗效显著[3]。
癌痛消方由白花蛇舌草、解毒草、煅牡蛎、延胡索、香附、三棱、党参、半枝莲、黄芪、莪术等组成,具有清热解毒、化瘀散结、健脾益气、行气止痛之功效。本实验采用二氯化钴(CoCl2)诱导体外培养肝癌细胞株HepG2缺氧模型,观察癌痛消方含药血清对肝癌细胞VM成管能力的影响,采用蛋白免疫印迹法(Western blot)检测VM形成相关因子的表达水平,探讨癌痛消方拮抗肝癌的作用机制。
1 实验材料
1.1 细胞株人肝癌细胞株HepG2(由中国科学院上海细胞生物学研究所细胞库提供)。
1.2 动物清洁级SD大鼠,雄性,体质量250~300 g,由长沙市天勤生物技术有限公司提供,动物生产/使用许可证号:SCXK(湘)2014-0011。动物均饲养于室内温度(20~25℃)、相对湿度为55%~70%的动物实验室。
1.3 药物癌痛消方由白花蛇舌草20 g、解毒草20 g、三棱10 g、半枝莲15 g、煅牡蛎30 g、香附10 g、党参10 g、黄芪20 g、绞股蓝12 g、莪术10 g、延胡索20 g、炙甘草10 g组成,制剂由广西中医药大学第一附属医院分子生物实验中心配制,为癌痛消方的饱和溶液,浓度为1 g/ml(用药剂量按人与动物体质量换算)。
1.4 试剂胎牛血清(美国Gibco公司,批号:25200-056);RPMI 1640培养液(美国Gibco公司,批号:SV30010);CoCl2(美国Sigma公司,批号:G7021);兔抗HIF-1α多克隆抗体(美国Proteintech公司,批号:20960-1-AP);兔抗VEGF多克隆抗体(美国Protein⁃tech公司,批号:19003-1-AP);兔抗EphA2单克隆抗体(美国Cell Signaling Technology公司,批号:6997S);兔VE-cadherin单克隆抗体(美国Cell Signaling Tech⁃nology公司,批号:2500S);鼠抗β-actin单克隆抗体(北京中杉金桥生物技术有限公司,批号:TA-09)。
1.5 仪器DMI6000B型倒置荧光显微镜(德国,Lei⁃ca公司);Forma 370二氧化碳培养箱(美国Thermo公司);Mini-PROTEAN蛋白垂直电泳系统(美国Bio-Rad公司);Amersham Imager 600多功能成像仪(美国GE公司)。
2 方法
2.1 含药血清的制备将SD大鼠随机分成4组,每组6只。癌痛消方高、中、低剂量组分别按临床剂量等效量的2倍、1倍、0.5倍(即10.8 g/kg、5.4 g/kg、2.7 g/kg)灌胃给药,正常组予蒸馏水灌胃,每日2次,连续灌胃7 d,末次给药后2 h,以相同的剂量重复给药1次,1 h后以戊巴比妥麻醉,75%酒精消毒,腹主动脉取血,常温中静置2 h后3 000 r/min离心20 min,合并所得同组动物血清,使用0.22 µm滤器过滤后即为癌痛消方含药血清,经56℃、30 min水浴的灭活操作后,置于-80℃冰箱,保存备用。
2.2 细胞培养将HepG2接种于含10%胎牛血清、100 g/L青霉素、100 g/L链霉素的RPMI-1640完全培养液中,置于37℃、5% CO2培养箱内培养;待细胞贴壁生长至单层后更换为含150µmol/L CoCl2的完全培养液,再培养24 h。
2.3 血管生成拟态结构观察将基质胶(Matrigel)按每孔200 µl加入24孔板备用。培养HepG2至70%~80%融合,胰酶消化。加入含10% FBS的DMEM培养基,调整HepG2细胞浓度为1×105cell/ml,每孔取0.8 ml。加入不同浓度的癌痛消方含药血清,置于37℃和5%CO2浓度的培养箱中培养24 h。倒置荧光显微镜下观察VM成管情况,拍照并获取图像。计算细胞血管生成拟态形成率,即一个视野里具有血管生成拟态功能细胞与所有细胞的百分比。
2.4 Western blot检测相关蛋白表达收集细胞,滴加RIPA裂解液,裂解细胞,提取细胞的总蛋白;BCA法检测总蛋白的浓度,滴加SDS-PAGE上样缓冲液,经10 min沸水浴后,按照50 µg的上样量置于PAGE凝胶电泳分离目的蛋白。电泳结束后使用半干法(25 V恒压45 min)将所得蛋白转印至PVDF膜,再使用脱脂乳在室温中封闭1 h。分别加入稀释后的HIF-1α、VEGF、EphA2、VE-cadherin抗体,4℃孵育过夜。TBST洗涤PVDF膜3次,每次5 min,随后滴加辣根过氧化物酶标记(HRP)的山羊抗兔IgG抗体,37℃中孵育1 h。TBST洗涤3次后再使用ECL发光液进行显影,拍照保存结果。使用Image J软件计算各目的条带和内参β-actin的灰度值,以所得两者的灰度值比值作为蛋白表达量。每个实验均重复3次,取平均值。
2.5 统计学方法采用GraphPad Prism 7.0软件进行统计分析及作图,计量资料以均数±标准差(±s)表示,多组间差异采用方差分析,P<0.05表示差异有统计学意义。
3 结果
3.1 癌痛消方对HepG2肝癌细胞血管生成拟态的影响见图1、图2、表1。与正常组比较,癌痛消方各剂量组HepG2细胞血管生成拟态形成率均明显下降,差异均有统计学意义(P<0.05或P<0.01),说明癌痛消方各剂量组均可抑制肝癌VM的形成。
表1 各组HepG2细胞血管生成拟态形成率比较(±s)

表1 各组HepG2细胞血管生成拟态形成率比较(±s)
注:与正常组比较,①P<0.05,②P<0.01

图1 各组肝癌细胞血管生成拟态显微结构(×40)
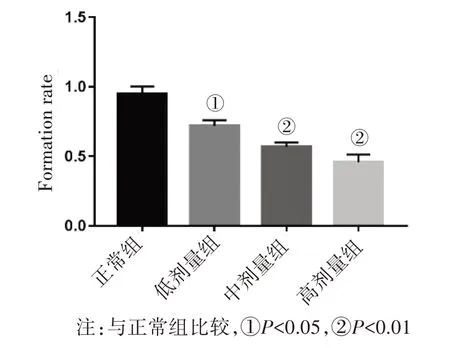
图2 各组HepG2细胞血管生成拟态形成率比较
3.2 癌痛消方对HepG2肝癌细胞中VM形成相关因子蛋白表达的影响见图3、图4、表2。与正常组比较,癌痛消方各剂量组HIF-1α、VEGF、VE-cadherin、EphA2蛋白表达水平明显下降,均具有统计学差异(P<0.05或P<0.01)。

图3 Western blot检测各组肝癌细胞HIF-1α、VEGF、EphA2、VE-cadherin蛋白的表达图
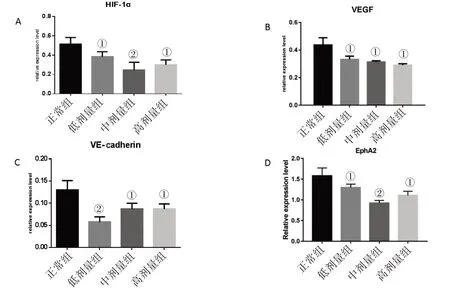
图4 各组肝癌细胞HIF-1α、VEGF、VE-cadherin、EphA2蛋白的表达水平
表2 各组肝癌细胞HIF-1α、VEGF、VE-cadherin、EphA2蛋白表达水平比较 (±s)

表2 各组肝癌细胞HIF-1α、VEGF、VE-cadherin、EphA2蛋白表达水平比较 (±s)
注:与正常组比较,①P<0.05,②P<0.01
4 讨论
肝癌为典型的富血管恶性肿瘤,高密度的血管形成不但是肝癌生长及转移复发的诱因,而且还是肝癌组织营养供给的主要途径。VM作为不依赖于内皮细胞的管道,肝癌的组织可经过这些血管和宿主的管道相连接,从而为肝癌的生长、转移及侵袭提供丰富的血供。肿瘤的快速增长及血供量不足会导致微环境中出现缺氧,然而缺氧并未能阻止肿瘤的恶性增长。缺氧状态的短暂或是持久都可增加恶性肿瘤预后不佳的风险,即通过调节相关肿瘤细胞通路、促进肿瘤细胞分化、诱导和维持肿瘤干细胞形成,从而促进肿瘤进展,同时还可以增加肿瘤细胞的耐药性,促进血管生成和VM[4]。刘文斌等[5]研究结果显示,无论是常氧或缺氧状态,肝癌细胞均能形成VM管道,但缺氧组的肝癌细胞所形成的管道长度明显比常氧组的长,这说明缺氧微环境有利于肝癌VM的形成;同时该研究还发现,在缺氧微环境下,伴随VM管道的生成,缺氧诱导因子(hypoxia-in-ducible factor,HIF-1α)可在缺氧条件下被明显上调。HIF-1α作为主要的转录调控因子,可以上调其下游血管内皮生长因子(vascularen⁃dothelial growth factor,VEGF)的转录[6],从而促进VM网络状结构的形成[7]。VEGF还可以通过提高肿瘤血管的通透性,促使外渗的血浆蛋白增多,从而为VM的形成及新生血管生成提供暂时性基质。此外,VEGF还能促进促红素人肝细胞受体酪氨酸激酶A2(Ephreceptor tyrosine kinase-type A2,EphA2)和血管内皮钙黏蛋白(vascular endothelial cadherin,VE-cadherin)的表达,从而促进VM的形成[8]。
肝癌归属于中医学“积聚”的范畴,中医药治疗肝癌有着悠久的历史,且疗效显著。大量临床及实验研究均证实,临床经验方在治疗肝癌方面可改善患者的生活质量,延长生存时间,减毒增效,增强患者免疫力,缓解射频消融术后常见的不良反应等[9-10]。本课题组提出的肝癌“瘀”“虚”“毒”新病机理论假说认为:癌毒是致病的始动因素,毒湿结聚、气血运行不通是肝癌的发病基础,湿、瘀、热为病理产物,虚既为病之因也为病之进。癌痛消方正是基于此病因病机,在《医林改错》的“膈下逐瘀汤”中加入临床经验用药而形成的方剂。前期研究表明,该方治疗肝癌及其术后复发者临床疗效确切,无明显毒副作用[11],且可抑制肝癌细胞的增殖并促使其凋亡[12],抗肿瘤血管新生[13]。
本次实验研究发现,癌痛消方可明显抑制肝癌细胞血管生成拟态的形成,能降低肝癌血管生成拟态相关因子HIF-1α、VEGF、EphA2、VE-cadherin的蛋白表达水平。本研究结果可为癌痛消方抗肝癌的临床应用提供新的科学依据。
