健脾益气方对D-氨基半乳糖致急性肝损伤大鼠的保护作用及机制研究
2021-11-11王超音金萍卓少元
王超,音金萍,卓少元
(广西中医药大学,广西南宁530200)
肝脏是人体最主要的药物代谢器官。在药物使用过程中,因药物本身或/及其代谢产物或由于特殊体质对药物的超敏感性或耐受性降低所导致的肝脏损伤称为药物性肝损伤(drug induced liver injury,DILI)。据临床病例统计分析结果显示[1-2],中草药是导致DILI的重要原因之一。健脾益气方是本课题组根据肝癌临床和相关文献研究归纳总结出的基本方,主要对应临床肝癌脾气虚弱的基本证型;前期研究发现该方不仅可以延长DEN(二乙基亚硝胺)肝癌大鼠生存率、降低肝细胞炎性坏死和肝癌组织癌基因表达的作用[3-4],而且能够通过调控肝癌炎症微环境抑制肝癌细胞增殖、侵袭,促进肝癌细胞凋亡[5-7]。但是健脾益气方在治疗肝癌过程中对正常肝脏是否有保护作用尚不明确。
网络药理学基于系统生物学的理论进行综合网络分析,已广泛应用于中药的机制研究[8-10]。因此本研究采用网络药理学以及分子对接技术分析健脾益气方通过抗炎和免疫调节防治急性肝损伤(ALI)的潜在靶标,并利用D-GalN所致的ALI模型,观察健脾益气方干预对ALI大鼠肝组织形态、损伤指数、Nod样受体热蛋白结构域相关蛋白3(NLRP3)炎性小体活化通路等的影响,探讨其保肝的可能性,以期为该方的临床应用提供基础实验支持。
1 材料
1.1 数据库及软件网络药理学以及分子对接涉及的主要数据库及软件有TCMSP(https://www.tcmsp-e.com/)、PubChem数据库(https://pubchem.ncbi.nlm.nih.gov/)、Swiss Target Prediction数据库(http://www.swis⁃stargetprediction.ch/)、Gene Cards数据库(https://www.genecards.org/)、OMIM数据库(https://www.ncbi.nlm.nih.gov/omim)、String数据库(https://www.string-db.org/)、PDB数据库(http://www.rcsb.org/)和Cytoscape3.8.2软件、Autodock 4.2软件、Pymol 2.5软件。
1.2 动物SPF级SD大鼠30只,雄性,8周龄,体质量(200±20)g,购于湖南斯莱克景达实验动物有限公司,合格证号:SCXK(湘)2016-0002,生产许可证号:SYXK(湘)2014-0012,质量合格证号:43004700040620,动物伦理审查证书编号:DW20210328-049。采取标准饲料喂养,自由摄食饮水。
1.3 药物及试剂健脾益气方由七味中药组成(黄芪30 g、白术10 g、薏苡仁15 g、白芍15 g、神曲10 g、茯苓15 g、法半夏10 g),购于广西中医药大学第一附属医院。健脾益气方按处方称量药材,加10倍量蒸馏水浸泡1 h,第一次煎煮1.5 h,再次加入8倍量蒸馏水煎煮1 h,合并两次滤液,浓缩配制成1 g/ml的药液,过滤除菌分装,4℃保存备用。D-GalN(纯度>99%,美国Sig⁃ma-Aldrich公司,批号#SLBT9951);ALT和AST测定试剂盒(长春汇力生物技术有限公司,批号分别为20181010、20181012);GGT测定试剂盒(南京建成生物工程研究所,批号20181013);大鼠IL-1β、IL-18和NF-κB酶联免疫吸附测定试剂盒(武汉伊莱瑞特生物科技股份有限公司,批号分别为T19018385、6S5915PQSP、QKZAQ7RBK1);大鼠Caspase-1活性测定试剂盒(北京索莱宝科技有限公司,批号20190314);ASC单克隆抗体(美国Santa Cruz Biotecnology公司,批号#J1518);β-Actin抗体(北京博奥森生物,批号A108282882);NLRP3抗体(英国Abcam公司,批号B-3);山羊抗兔的二抗和山羊抗鼠的二抗(北京中杉金桥生物技术有限公司,批号分别为00081002、00062578)。
1.4 仪器Epoch Biotek全波长酶标仪(美国Biotek公司);Chemray全自动生化分析仪(美国Rayto公司);倒置显微镜(德国Leica公司);ST 16R高速离心机(美国Thermo Fisher公司);摇床(上海天呈实验仪器制造有限公司);电泳仪和全能型成像分析系统(美国Bio-Rad公司)。
2 方法
2.1 健脾益气方治疗急性肝损伤潜在靶点网络模型构建通过TCMSP数据库以及文献检索,收集到健脾益气方中黄芪、白芍、白术、薏苡仁、半夏、茯苓的有效成分。TCMSP数据库未收录神曲的有效成分,故通过查阅文献获取[11-12]。利用口服利用度OB≥30%和药物相似性DL≥0.18为条件筛选以上7味中药的有效成分。将筛选到的有效成分在PubChem数据库中找到对应的SMILES编号,利用Swiss Target Prediction对有效成分的靶点进行预测,得到健脾益气方活性成分的靶点。通过在Gene Cards数据库和OMIM数据库中分别检索“acute liver injury,inflammation,immunoregula⁃tion”,将急性肝损伤、炎症和免疫调节三者的靶点取交集并用Uniprot ID进行标准化得到疾病靶点。将疾病靶点和健脾益气方活性成分靶点取交集去重得到健脾益气方通过抗炎和免疫调节防治ALI的潜在靶点。用Cytoscape 3.8.2软件构建健脾益气方-活性成分-疾病靶点相互作用网络。利用String数据库构建靶点蛋白质相互作用网络图,用Cytoscape 3.8.2进行可视化分析。
2.2 主要活性成分与靶点分子对接在TCMSP数据库中下载活性成分结构的mol2格式文件,在PDB数据库中检索靶点分子的PDB格式文件,用Pymol软件去除配体。用Autodock 4.2软件进行分子对接,将对接结果用Pymol软件可视化并输出。
2.3 动物分组、模型复制与给药将SD大鼠适应性喂养3 d后随机分为5组:正常组、模型组和健脾益气方低、中、高剂量组(JP-L组、JP-M组、JP-H组),每组6只。其中,模型组和JP-L组、JP-M组、JP-H组大鼠均按600 mg/kg一次性腹腔注射D-GalN复制ALI模型;正常组大鼠按600 mg/kg一次性腹腔注射生理盐水。造模后JP-L组、JP-M组、JP-H组分别按成人用药量的3、6、12倍立即给予健脾益气方灌胃,即5.25 g/kg、10.5 g/kg、21 g/kg(将成人每日口服生药量折算成大鼠等效剂量作为中剂量组用量:大鼠中剂量用药=成人每日口服生药量÷60 kg×6=10.5 g/kg[13]),每日2次,连续给药2 d。正常组和模型组大鼠以10.5 g/kg的生理盐水灌胃。各组大鼠均于末次给药后1 h内用3%戊巴比妥腹腔注射麻醉,腹主动脉取血分离血清,取完整肝脏组织。
2.4 肝脏组织形态学观察取肝脏组织,置于4%多聚甲醛溶液中固定,石蜡包埋切片,常规HE染色,光镜下观察各组肝脏组织病理学变化。
2.5 血清生化指标与炎症因子含量检测采用生化法检测大鼠血清中谷草转氨酶(AST)、谷丙转氨酶(ALT)和γ-谷氨酰转肽酶(GGT)的含量;采用ELISA检测血清中白细胞介素1β(IL-1β)、白细胞介素18(IL-18)和核因子κB(NF-κB)的含量。以上步骤均严格按照试剂盒说明书操作。
2.6 肝脏组织NLRP3和凋亡相关斑点样蛋白(ASC)的蛋白表达水平的检测用WB法检测肝脏组织中NLRP3和ASC蛋白表达水平。取肝脏组织20 mg,加入裂解液冰上裂解、提取蛋白,按BCA法测定蛋白含量。经SDS-PAGE电泳后冰浴转膜,TBST洗涤3次,封闭液封闭1.5 h,加入一抗4℃孵育过夜(稀释倍数β-Actin为1∶1 000,ASC为1∶400,NLRP3为1∶1 000),洗涤同上,加入二抗室温孵育1 h(稀释倍数为1∶3 000),采用ECL化学发光法显色,用全能型成像分析系统采集照片。
2.7 肝组织中半胱氨酸天冬氨酸特异性蛋白酶1(Caspase-1)活性检测取肝脏组织加裂解液冰上裂解提取总蛋白,用Bradford法测定蛋白浓度,调整蛋白浓度到1 mg/ml。按照Caspase-1活性测定试剂盒说明书进行操作。
2.8 数据统计分析采用SPSS 20.0统计软件分析,计量资料以均数±标准差(±s)表示,符合正态分布和方差齐性的数据采用单因素方差分析(one-way ANO⁃VA),非正态分布的数据则采用Mann-Whitney U秩和检验。P<0.05为差异有统计学意义。
3 结果
3.1 健脾益气方治疗ALI的潜在靶点分析通过网络药理学分析,筛选得到79个健脾益气方的活性成分,预测到834个活性成分的靶点。通过Gene Cards与OMIM数据库检索到与急性肝损伤、炎症以及免疫调节相关的基因靶点取交集去重后有107个,与健脾益气方活性成分预测的834个靶点取交集后得到39个健脾益气方治疗ALI的潜在靶点。将中药、活性成分、靶点构建可视化网络图,结果见图1。健脾益气方有68个活性成分直接参与到网络图中。将39个潜在靶点进行PPI网络拓扑分析(图2),涉及33个节点,151条边。节点表示基因,大小表示degree值;边表示基因间的作用关系,粗细表示Combine score大小。这些基因的分子功能主要有磷酸酶结合、细胞因子受体结合、转录因子活性等;涉及的KEGG代谢通路主要有乙肝病毒相关、Toll样受体信号通路、NOD样受体信号通路等。主要涉及MAPK、IL-6/STAT3、NLRP3/IL-1β等多条信号通路。结合前期研究结果本研究主要围绕NLRP3/IL-1β通路相关分子(如NLRP3、IL-1β、RELA/NF-κB p65)进行分子对接和动物实验验证,在图2中以黄色圆圈所示。

图1 健脾益气方治疗急性肝损伤的“药物-成分-潜在靶点”网络
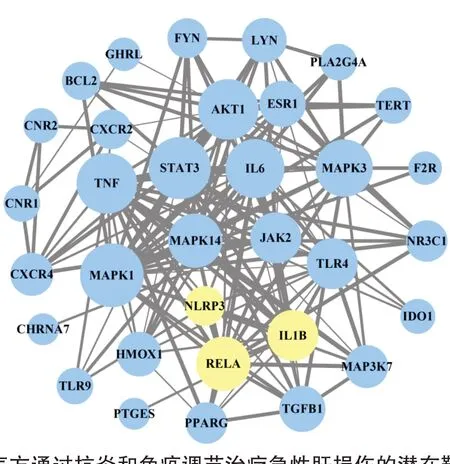
图2 健脾益气方通过抗炎和免疫调节治疗急性肝损伤的潜在靶点的PPI网络
3.2主要活性成分与靶点分子对接选择在“药物-成分-潜在靶点”网络中degree值较高的3个活性成分与NLRP3、IL-1β、RELA进行分子对接。对接的最低自由能越低,提示蛋白与配体之间结合活性越好。分子对接结果显示,选取的3个活性成分与NLRP3、IL-1β、RELA均能够有效结合,结合的最低自由能均小于-5(表1)。将每个蛋白与配体结合有最低结合能的对接结果进行可视化处理,见图3。

表1 主要活性成分与靶点分子对接结合能

图3 主要活性成分与靶点的对接模式图
3.3 健脾益气方对ALI大鼠肝组织形态学的影响肉眼观察及HE染色结果(见图4)可见:正常组大鼠肝脏颜色鲜红、边缘扁尖锐利、质地柔软、表面光滑无任何异常;肝小叶的结构规则,肝细胞排列成条索状,以中央静脉为中心向四周放射。模型组大鼠肝脏色泽晦暗伴有粘连,部分位置有出血,可见白色小点或白色坏死病灶,部分大鼠肝脏变大;肝小叶结构破坏明显,肝血窦充血,肝细胞多处成点状坏死,肝细胞核消失,坏死灶内有大量炎细胞浸润。健脾益气方治疗后,低剂量组大鼠除肝血窦充血减少外,其它与模型组相似;中剂量组大鼠肝脏形态基本正常,色泽较红,质地较柔软,无明显病变;高剂量组大鼠肝脏体积稍大,个别表面呈细小颗粒状,无出血现象。健脾益气方中、高剂量组大鼠肝细胞损伤及炎细胞浸润程度较轻。

图4 肝脏一般情况及组织病理学比较(HE×400)
3.4 健脾益气方对ALI大鼠血清生化指标含量的影响见表2。与正常组相比,模型组ALT、AST和GGT的含量均升高,其中ALT和AST的组间差异均具有统计学意义(P<0.01)。经健脾益气方治疗后,ALI大鼠血清中ALT、AST和GGT的含量均出现降低趋势,且随剂量的增加而含量逐渐降低。其中健脾益气方中、高剂量组的ALT、AST、GGT与模型组比较差异具有统计学意义(P<0.05或P<0.01);低剂量组的ALT与模型组比较差异具有统计学意义(P<0.05)。
表2 健脾益气方对ALI大鼠血清ALT、AST和GGT含量的影响 (±s)

表2 健脾益气方对ALI大鼠血清ALT、AST和GGT含量的影响 (±s)
注:与正常组比较,①P<0.01;与模型组比较,②P<0.05,③P<0.01
?
3.5 健脾益气方对ALI大鼠血清IL-1β、IL-18和NF-κB含量的影响见表3。与正常组比较,模型组大鼠血清IL-1β、IL-18和NF-κB含量均升高;其中,IL-1β和NF-κB差异显著(P<0.01)。经健脾益气方治疗后,ALI大鼠血清IL-1β、IL-18和NF-κB的含量均出现降低趋势,且随剂量的增加而含量逐渐降低;除低剂量组的IL-1β外,其它各治疗组血清IL-1β、IL-18和NF-κB含量均显著降低(P<0.05或P<0.01)。
表3 健脾益气方对ALI大鼠血清IL-1β、IL-18和NF-κB含量的影响 (±s)
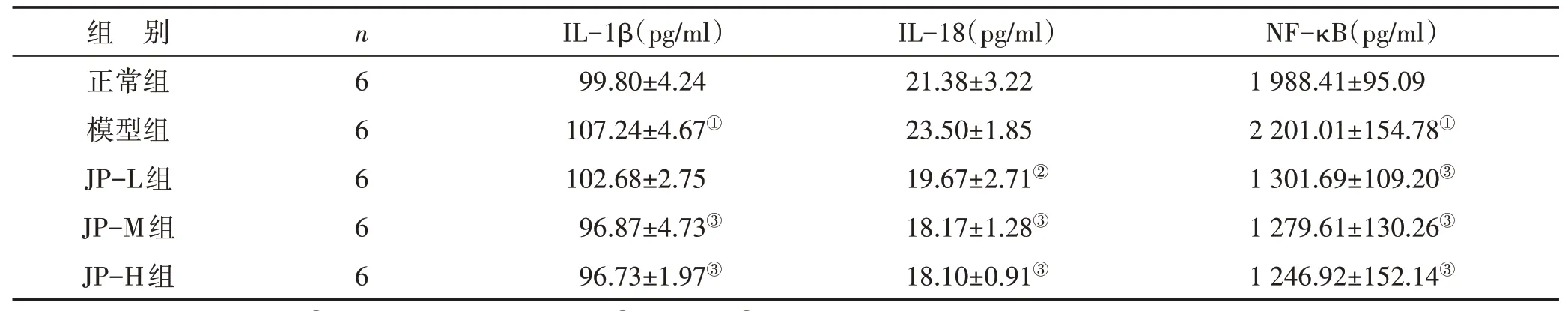
表3 健脾益气方对ALI大鼠血清IL-1β、IL-18和NF-κB含量的影响 (±s)
注:与正常组比较,①P<0.01;与模型组比较,②P<0.05,③P<0.01
?
3.6 健脾益气方对ALI大鼠肝组织NLRP3、ASC蛋白表达水平的影响WB法检测各组大鼠肝脏组织中NLRP3、ASC蛋白含量,结果见图5。与正常组比较,模型组大鼠肝组织NLRP3和ASC蛋白表达水平均显著升高(P<0.01)。与模型组比较,健脾益气方各治疗组大鼠肝组织NLRP3和ASC蛋白表达水平显著降低(P<0.01),其中以中、高剂量组的效果最明显。

图5 健脾益气方对ALI大鼠肝组织NLRP3和ASC蛋白表达的影响
3.7健脾益气方对ALI大鼠肝组织Caspase-1酶活性的影响见表4。模型组大鼠肝组织Caspase-1酶活性明显升高,是正常组的179.75倍。健脾益气方治疗后,低、中、高剂量组的Caspase-1酶活性均显著降低(P<0.05或P<0.01)。
表4 健脾益气方对ALI大鼠肝组织Caspase-1酶活性的影响(±s)
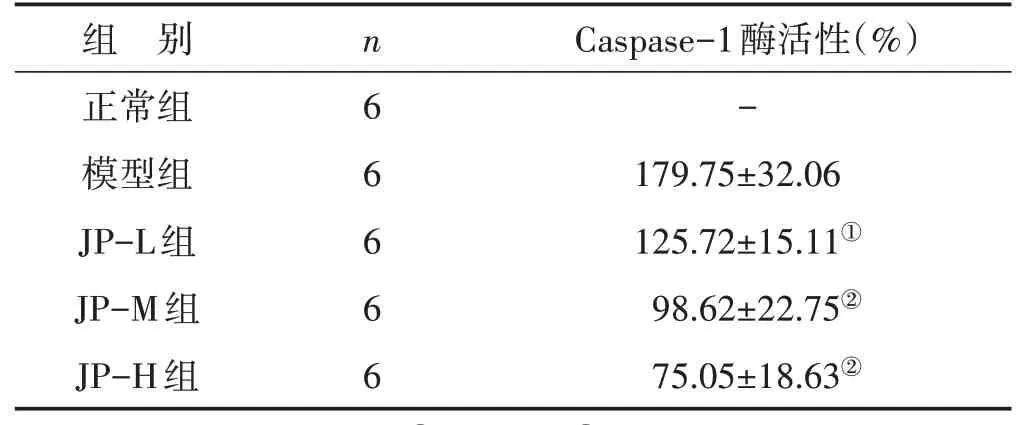
表4 健脾益气方对ALI大鼠肝组织Caspase-1酶活性的影响(±s)
注:与模型组比较,①P<0.05,②P<0.01
?
4 讨论
合适的肝损伤动物模型是筛选与评价保肝药物的关键。在众多的肝损伤模型中,D-GalN诱导的急性肝损伤被认为是保肝新药筛选与评价较理想的模型之一,但其合适的造模剂量存在一定的争议[14-16],根据以往研究结果,本研究选用600 mg/kg体重一次性腹腔注射D-GalN制备ALI模型。D-GalN与肝细胞内的UDP结合,耗竭UTP,使肝细胞内RNA、蛋白质合成受阻,糖和磷脂代谢发生障碍,从而导致肝细胞膜受损,引起肝细胞坏死,进而使ALT、AST、GGT等酶入血,因此,血清中ALT、AST、GGT可以反映肝损伤程度。本实验结果显示,模型组大鼠血清中ALT、AST、GGT含量均升高,并且ALT、AST差异显著,结果显示本研究成功复制了大鼠ALI模型。
健脾益气方由七味中药组成,以黄芪为君,白术、茯苓为臣,白芍、半夏、薏苡仁、神曲为佐,有补益正气、健脾祛湿、散结消痞之功效。本研究结果显示,健脾益气方中、高剂量治疗组均能改善急性肝损伤大鼠肝组织的病理变化,降低血清中ALT、AST、GGT含量(P<0.05或P<0.01),具有一定的保肝作用。
网络药理学基于系统生物学的方法被提出并迅速发展,从整体和网络角度描述药物、生物系统和疾病之间的关系,对现代中医药尤其是复方的研发提供了科学依据[8-10]。本研究通过网络药理学的方法筛选得到健脾益气方通过抗炎和免疫调节治疗急性肝损伤的活性成分68个,潜在靶标39个,这些潜在靶标涉及到多个生物学过程、多种分子功能和KEGG代谢通路,提示健脾益气方防治急性肝损伤是多途径、多靶点的干预机制。根据网络药理学的分析结果,本研究选取degree最高的前3个活性成分与得分较高的NLRP3炎性小体相关蛋白NLRP3、ILIB、RELA进行分子对接,结果显示这3个成分与3个靶标蛋白均有较高的结合活性,验证了网络药理学的结果。
NLRP3炎性小体(inflammasome)是由多种蛋白组成的复合物,主要由感受器蛋白NLRP3、衔接分子ASC(apoptosis-associated speck-like protein containing a CARD)及效应分子pro-caspase-1组成。多种刺激信号均可触发NLRP3的激活,NLRP3招募并裂解procaspase-1;激活的Caspase-1可将pro-IL-1β和pro-IL-18切割成成熟的IL-1β和IL-18,使之分泌到细胞外发挥各种炎症效应[17]。NF-κB在细胞的炎症反应、免疫应答等过程中起到关键性作用,能够诱导NLRP3炎性小体的活化[18],且活化后的IL-1β还能利用其受体IL-1R1激活NF-κB[19],从而形成“瀑布效应”加重细胞炎症反应。本研究结果表明,模型组大鼠血清IL-1β、NF-κB含量,肝组织NLRP3和ASC蛋白表达水平明显升高(P<0.01),Caspase-1酶活性也明显升高,进一步提示模型大鼠肝功能受损及NLRP3炎性小体的激活。本研究结果还显示中、高剂量的健脾益气方能够明显降低模型大鼠血清IL-1β、IL-18、NF-κB含量,肝组织NLRP3和ASC蛋白表达水平,及肝组织Caspase-1酶活性(P<0.01)。提示健脾益气方可能通过下调NLRP3炎性小体的活化从而抑制D-GalN致ALI大鼠中的炎症反应,从而起到保肝作用。动物实验结果与网络药理学以及分子对接分析的结果一致。
综上所述,健脾益气方对D-GalN致急性肝损伤大鼠具有明显的保护作用,其中以中、高剂量的健脾益气方防治的效果为佳。该方可明显降低血清GGT、ALT、AST含量,及肝脏组织损伤指数,其作用机制可能与下调NLRP3炎症小体的活化有关,但具体分子调控机制有待深入研究。
