超高效液相色谱-串联质谱法测定牛心浸粉中7种氨基酸的含量
2021-11-11候海玲李鹏飞纪紫薇郝美玲
周 刚,候海玲,李鹏飞,纪紫薇,郝美玲
(内蒙古自治区药品检验研究院,内蒙古自治区 呼和浩特 010020)
动物组织浸出粉(包括牛肉浸粉、牛心浸粉、肝浸粉等),是以动物的肌肉、心、肝等组织为原材料,以水作为溶剂,将其内部的水溶性物质浸出后,再经过系列分离、纯化、浓缩、干燥等加工手段精制而成。牛心浸粉是专供微生物培养、分离、鉴别、研究和保存用的营养品,含有丰富的促进细菌生长发育的物质,同时还具有能够中和蛋白胨和琼脂含有的某种阻碍细菌生长发育的物质。牛心浸粉配置的培养基在保持细菌毒力和毒性作用、荚膜的产生等方面均明显优于牛肉浸粉,同时牛心浸粉加工成本较牛肉浸粉要低出近三倍以上,因此牛心浸粉目前正在逐步替代传统的牛肉浸粉而予以推广使用[1]。
牛心浸粉含有大量氨基酸,目前,氨基酸的检测方法有分光光度法[2]、高效液相色谱法[3]、毛细管电泳法[4-5]、近红外光谱法[6]、离子色谱法[7]及气相色谱法[8]等,其中普遍采用样品衍生化进行前处理,高效液相色谱进行检测,但存在衍生化前处理会带来一定误差,处理方式复杂,延期时间较长等问题。
超高效液相色谱-串联质谱法结合了液相色谱的强大分离功能和质谱分析的高选择性、高特异性、高灵敏度、高稳定性,可以有效提取目标化合物,避免了基质的干扰,定性定量更为准确[9-10],该技术已经成为现代分析手段中必不可少的一部分,并作为强有力的分析技术,成为医药卫生、生命科学、食品安全等领域中不可或缺的工具之一[11-15]。
近年来,国内外科研人员应用液相色谱-质谱联用技术研究了不同种类样品中氨基酸含量[16-18]。但未见应用UPLC-MS/MS测定牛心浸粉中氨基酸组分的报道,所以,针对牛心浸粉中的氨基酸进行检测分析具有重要意义。本文通过对色谱、质谱和提取方法的优化,建立了超高效液相色谱-串联质谱法同时测定牛心浸粉中7种氨基酸的分析方法。
1 实验部分
1.1 主要仪器与试剂试药
超高效液相色谱:Ultimate 3000型,美国Thermo Fisher公司;三重四级杆质谱仪:TSQ Endura型,配电喷雾离子源(Electron Spray Ionization, ESI),美国Thermo Fisher公司;超声波振荡器:KQ-500DE型,昆山市超声仪器有限公司;万分之一电子天平:AL 204型,瑞士Mettler Toledo公司;超纯水机:Milli-Q型,美国Milliproe公司。
十七种氨基酸混合标准物质:浓度2.50μmol/mL,批号:APQ6881,FUJIFILM Wako Pure Chemical Corporation。
甲醇、乙腈:色谱纯,SIGMA-ALDRICH。
3批牛心浸粉:批号:NIFDC-205-1;NIFDC-205-2;NIFDC-205-3,锡林浩特市鼎安生物科技有限公司。
1.2 对照品溶液的制备
吸取17种氨基酸混合标准液300μL,用超纯水定容至10mL得到75.0μmol/L的混合标准中间液。根据需要再用超纯水配成适当浓度的系列混合标准工作溶液。
1.3 供试品溶液的制备
精密称取混合均匀样品0.05g(精确至0.0001g),置于100mL量瓶中,加适量超纯水溶解,超声20min,放至室温后定容至刻度,摇匀。再精密量取上述溶液2mL于10mL量瓶中,用水定容至刻度,摇匀,经0.22μm滤膜过滤后,待测。
1.4 仪器工作条件
1.4.1色谱条件
色谱柱:Thermo Accucore Hilic 色谱柱(150mm×2.1mm,2.6μm,美国Thermo Fisher公司);保护柱:AJO-4287 C18(4mm×3.0mm,美国Phenomenex公司);柱温:25℃;进样室温度:10℃;流速:0.2mL/min;进样量:2μL;流动相:0.1%甲酸水溶液-甲醇(95∶5)等度洗脱。
1.4.2质谱条件
离子源:电喷雾电离(electrospray ionization, ESI)源;扫描方式:正离子扫描;检测方式: 多反应监测(multiple reaction monitoring, MRM)模式;离子源温度:350℃;离子传输管温度:310℃;离子喷雾电压:4500V;鞘气流速:8.0L/min;辅助气流速:3.0L/min;碰撞气:氩气。
2 结果与讨论
2.1 色谱条件优化
使用C18色谱柱和Accucore Hilic色谱柱对混合标准品溶液进行检测时,C18色谱柱分离度不如Accucore Hilic色谱柱,拖尾现象明显,且基线噪音较高,鉴于大部分氨基酸在C18色谱柱上的保留较差,最终选择适用于大极性化合物分离的Hillic亲水色谱柱,达到了较好的分离效果。
2.2 质谱条件优化
根据化合物的性质,7种氨基酸均采用正离子模式,分别得到一个质子形成母离子[M+H]+,继续进行产物离子扫描,分别得到7种化合物的主要碎片离子,并优化各化合物的碰撞电压等相关参数,选择最优定性定量离子对。优化后7种氨基酸的MRM参数见表1。
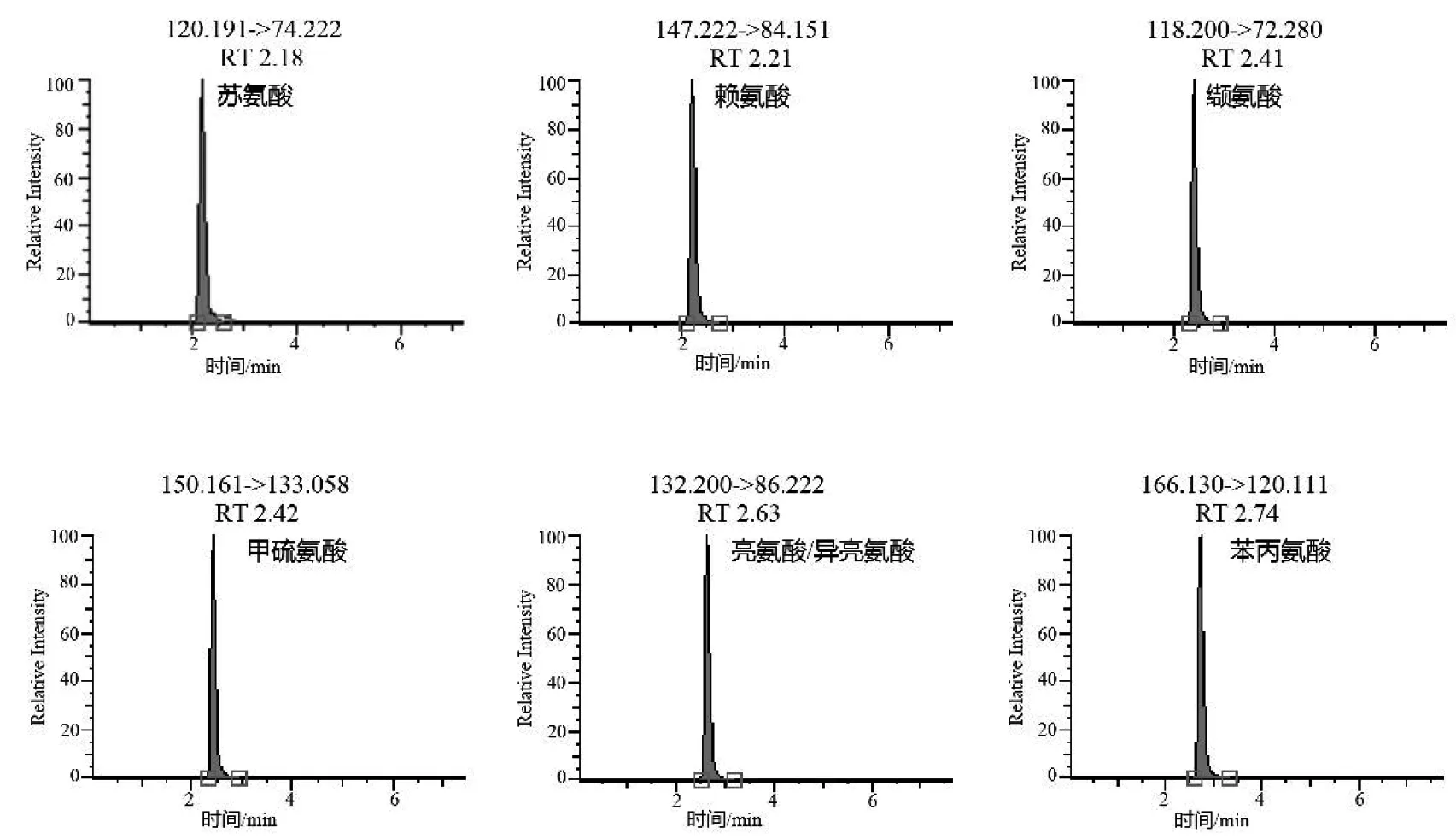
图1 7种氨基酸混合标准溶液的MRM色谱图
2.3 样品前处理条件优化
氨基酸类物质属于强极性化合物,大多易溶于水,对于极性较强的化合物一般采用甲醇、乙腈和水作为提取溶剂,因此在相关文献的基础上[19-20],本实验对比了不同比例的甲醇、乙腈、水和0.01mol/L盐酸(pH=2)等5种溶液作为提取溶剂的效果,综合提取效率、峰型等因素,最终选择水作为提取溶剂。
以水作为提取溶剂,进一步优化超声提取时间,对比了加标后的样品在提取10min、20min、30min后,氨基酸的含量,结果显示,提取时间从10min到20min,总含量显著增加,大于20min时总含量并无明显差异,因此选择提取时间为20min。
2.4 线性范围、检出限和定量限
将7种氨基酸标准溶液用水分别稀释成不同的浓度,测定其峰面积(Y),并分别对其浓度X(ng/mL)进行线性回归分析,绘制标准曲线,确定各氨基酸的线性范围和相关系数,结果表明,7种氨基酸在各自质量浓度范围内相关系数(r)均大于0.99,线性关系良好。当取样量为0.05g时,以信噪比(S/N)为3和10时的进样浓度为检出限和定量限,结果表明,检出限和定量限均可满足测定要求,方法灵敏度高。相关数据见表2。

表2 7种氨基酸的线性范围、回归方程、相关系数(r)、检出限和定量限
2.5 方法准确度和精密度
采用标准加入法,进行3水平6平行加标回收实验,分别称取0.05g样品,加入适量的氨基酸混合标准溶液,在优化的试验条件下测定7种氨基酸的含量,计算回收率。结果见表3,可知7种氨基酸的平均加标回收率在90.2%~105.5%之间,相对标准偏差在0.09%~0.79%之间,回收率及相对标准偏差均符合质谱测定要求,所建方法的精密度和准确度良好。

表3 7种氨基酸的精密度与加标回收试验结果
2.6 测定结果
按上述所建立的7种氨基酸的含量测定方法对3批牛心浸粉进行测定,结果发现3批牛心浸粉均检出7种氨基酸,其中甲硫氨酸的含量最低,在3.28~3.66g/kg之间;赖氨酸含量最高,在17.18~19.21g/kg之间;其他氨基酸含量均在7.77~13.00g/kg之间,结果见表4。

表4 3批牛心浸粉中7种氨基酸的测定结果
3 结论
本研究通过对样品的提取方法、色谱条件及质谱条件等参数进行了优化,建立了超高效液相色谱-串联质谱法同时测定牛心浸粉中7种氨基酸的方法,该方法与传统氨基酸测定方法相比,具有操作简便、快速、灵敏、准确、选择性专一的特点,同时此法补充了牛心浸粉中氨基酸测定的研究空白,为其他动物组织浸粉中氨基酸含量测定的研究提供参考。
