调强放疗联合苦参注射液同期TP化疗对中晚期NSCLC疗效及安全性影响
2021-11-11王丹李志刚
王丹,李志刚
(项城市中医院 肿瘤科,河南 周口 466200)
非小细胞肺癌(NSCLC)是临床高发恶性肿瘤,且随着空气污染加重发病率呈逐年升高趋势,占全部肺癌的80%左右,且早期症状隐匿,发现时已多为中晚期,错失最佳手术根治时间[1]。调强放疗(IMRT)、TP化疗均为中晚期NSCLC的重要治疗手段,但长期治疗毒副作用较多,安全性较差,会严重影响患者预后生活质量[2]。中药治疗应用于放化疗癌症患者中具有增效减毒作用,其中苦参注射液是具有清热解毒作用的中药制剂,辅助放化疗方案治疗NSCLC能明显提高T淋巴细胞功能,减轻毒副作用[3]。本研究选取项城市中医院中晚期NSCLC患者112例,旨在探讨调强放疗联合苦参注射液同期TP化疗的治疗效果。现报告如下。
1 资料和方法
1.1 一般资料
选取2019年3月至2020年4月本院中晚期NSCLC患者112例,按照随机数字表法分为对照组、观察组,各56例。其中对照组男30例,女26例;年龄47~79岁,平均(65.89±6.56)岁;临床分期:Ⅲa期21例,Ⅲb期18例,Ⅳ期17例。观察组男29例,女27例;年龄48~80岁,平均(66.10±6.61)岁;临床分期:Ⅲa期20例,Ⅲb期19例,Ⅳ期17例。两组一般资料比较,差异无统计学意义(P>0.05),均衡可比。
1.2 纳入及排除标准
纳入标准:均符合《中国原发性肺癌诊疗规范(2015年版)》中诊断标准[4];卡式评分(KPS)≥70分;预计生存期>6个月;均为初次放化疗;均签署知情同意书。
排除标准:早期NSCLC患者;合并其他部位恶性肿瘤;合并肝肾功能障碍;精神或意识障碍无法配合治疗检查;放化疗禁忌症;合并多发肿瘤、远处转移、广泛浸润者;重要功能脏器严重衰竭;合并严重过敏性疾病或对本研究药物过敏;凝血功能异常。
1.3 方法
两组均给予常规护肝、护胃、护心、止吐等预防性治疗。对照组采用IMRT联合TP化疗,(1)IMRT:采用仰卧位,用真空负压袋固定后,采用医科达直线加速器进行IMRT治疗,CT模拟定位扫描,以环状软骨至肋膈角下缘为扫描范围,获取三维肿瘤结构;将肿瘤体向四肢方向外扩约1 cm,向头脚方向扩约1.5 cm,放疗时各区域剂量为2Gy/次,1次/d,5次/周。(2)同期进行TP化疗,第1 d静脉注射紫杉醇(Hospira Australia Pty Ltd,批准文号:H20150350,规格:5 mL∶30 mg),175 mg/m2;第1~3 d静脉注射顺铂(齐鲁制药有限公司,国药准字H37021357,规格:20 mg/支),25 mg/m2;28 d/疗程,共2个疗程。观察组在对照组基础上在化疗同期采用苦参注射液(山西振东制药股份有限公司,国药准字Z14021231,规格:5 mL/支)治疗,20 mL苦参注射液+生理氯化钠溶液静脉滴注,1次/d,连续治疗14 d后,间隔14 d,28 d/疗程。
两组均持续治疗至疾病进展或药物不能耐受,治疗2个疗程后评估疗效。
1.4 观察指标
(1)治疗2个疗程后疗效[5],采用实体瘤治疗疗效评价标准评估,完全缓解(CR):肿瘤消失,4周内无复发、无新病灶产生;部分缓解(PR):肿瘤体积缩小>50%,4周内未产生新病灶;稳定(SD):肿瘤体积缩小≤50%;进展(PD):肿瘤体积增加>25%或出现新病灶。CR、PR、SD计入疾病控制率。(2)治疗前、治疗2个疗程后KPS评分[6],总分0~100分,分数越高机体状况越好;T淋巴细胞亚群(CD4+/CD8+),采集外周静脉血3 mL,采用深圳迈瑞生物医疗电子股份有限公司提供的流式细胞仪测定。(3)治疗期间安全性,统计毒副反应发生率,包括胃肠道反应、肝肾功能障碍、血小板减少、白细胞减少、骨髓抑制。
1.5 统计学方法
采用SPSS 22.0对数据进行分析,计数资料以n(%)表示,行χ2检验,计量资料以±s表示,行t检验,P<0.05表示差异有统计学意义。
2 结 果
2.1 两组疗效比较
观察组疾病控制率75.00%高于对照组55.36%,差异有统计学意义(P<0.05)。见表1。
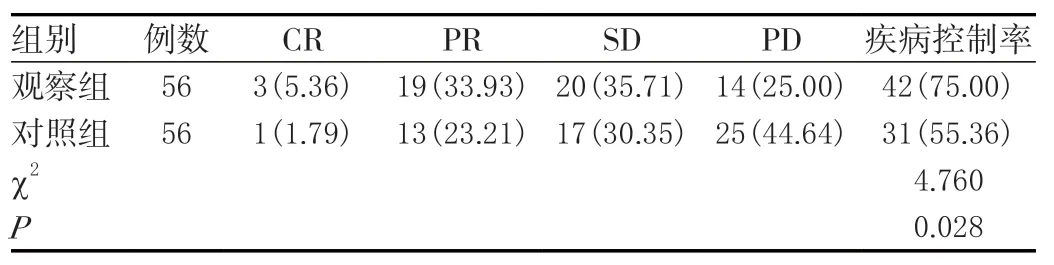
表1 两组疗效对比[n(%)]
2.2 两组KPS评分、T淋巴细胞亚群比较
治疗前两组KPS评分、T淋巴细胞亚群比较,差异无统计学意义(P>0.05);治疗2个疗程后观察组KPS评分、CD4+/CD8+水平高于对照组,差异有统计学意义(P<0.05)。见表2。
表2 两组KPS评分、T淋巴细胞亚群比较(±s )

表2 两组KPS评分、T淋巴细胞亚群比较(±s )
注:与治疗前同组比较,①P<0.05。
组别 例数 KPS评分/分 CD4+/CD8+治疗前 治疗2个疗程后 治疗前 治疗2个疗程后观察组 56 73.75±3.10 84.26±3.56① 1.32±0.21 1.59±0.23①对照组 56 73.98±3.08 78.12±3.62① 1.37±0.18 0.94±0.15①t 0.394 9.050 1.353 17.714 P 0.694 <0.001 0.179 <0.001
2.3 两组安全性比较
观察组胃肠道反应、肝肾功能障碍、血小板减少、白细胞减少、骨髓抑制等毒副反应发生率低于对照组,差异有统计学意义(P<0.05)。见表3。

表3 两组安全性对比[n(%)]
3 讨 论
放化疗是中晚期NSCLC的重要治疗手段,其中TP化疗能促进肿瘤细胞微管聚合,使癌细胞分裂停滞于有丝分裂期,抑制肿瘤增殖;IMRT能有效减少正常组织毒性反应并提高肿瘤剂量,从而提升治疗效果。
目前放化疗引起的毒副反应是临床亟待解决的问题,且免疫功能的降低会严重影响患者生活质量,积极采取措施进一步提高安全性、改善免疫功能是目前研究热点内容。苦参注射液是利用现代科学技术将中草药有效成分提取加工制成的中药制剂,主要包括苦参、首乌、土茯苓、山慈菇、灵芝等,具有散结止痛、清热利湿、凉血解毒的功效。基于此,本研究采用苦参注射液联合放化疗,结果显示观察组疾病控制率75.00%高于对照组55.36%(P<0.05)。分析其原因为,苦参注射液中主要成分为氧化苦参碱及苦参碱,能改变肿瘤细胞数目在细胞周期内的各期比例,促进细胞更快进入S期,抑制其进一步分裂分化生长;并改变肿瘤细胞细胞核的DNA分子构象,直接杀伤肿瘤细胞,从而避免肿瘤组织进一步发展及新肿瘤的产生,从而发挥显著治疗效果[7]。同时,癌症患者机体状况与免疫力普遍低下,KPS评分可评估生活质量,CD4+/CD8+能反映免疫功能,其水平可作为衡量病情严重程度及预后的重要指标,本研究结果显示治疗2个疗程后观察组KPS评分、CD4+/CD8+水平高于对照组(P<0.05)。苦参注射液能显著提高机体抗氧化能力,升高白细胞活性,增加T淋巴细胞数量,稳定CD4+/CD8+水平,从而提高机体免疫力,改善机体功能[8-9]。 另外,本研究从安全角度进一步分析,结果显示观察组胃肠道反应、肝肾功能障碍、血小板减少、白细胞减少、骨髓抑制等毒副反应发生率低于对照组(P<0.05),表示苦参注射液能提高放化疗的安全性,是由于苦参注射液能改善放化疗引起的免疫力低下状态,减轻渗出性炎症反应,发挥肝、肾等多脏器保护作用,促进骨髓造血,减少毒副反应的发生,提高治疗安全性。
综上所述,IMRT联合苦参注射液同期TP化疗治疗中晚期NSCLC疗效显著,能改善机体状况及免疫功能,提高安全性。
