潜伏表达癌调蛋白的HSV-1减毒载体能有效治疗大鼠机械性视神经损伤
2021-11-10高瀛政黄新伟
杨 明,高瀛政,李 萌,曹 霞,黄新伟
1昆明医科大学第一附属医院眼科,云南 昆明 650032;2昆明医科大学第二附属医院,云南 昆明650033
视神经损伤后视网膜神经节细胞(RGCs)无法形成新的突触,逐渐凋亡或坏死,是视力丧失的主要原因[1]。因此,减缓或抑制RGCs的死亡及促进其轴突再生是有效治疗视神经损伤和促进视功能恢复的重要基础。
近年来研究发现,眼内炎症诱导的中性粒细胞和巨噬细胞分泌的小分子癌调蛋白(OCM)具有显著的促神经修复作用[2-4]。与睫状神经细胞营养因子(CNTF)、脑源性神经营养因子(BDGF)和胶质细胞源性神经营养因子(GDNF)相比,OCM是目前最为有效的促进RGC轴突生成的营养因子[5]。在视神经受损的大鼠眼内注入含重组OCM及其增敏剂cAMP类似物的缓释微粒后,可使RGCs的轴突再生长度增加5~7倍[3]。因此,OCM是转基因治疗视神经损伤的理想靶标。
单纯疱疹病毒(HSV)是一种常见的人类病原微生物,在基因治疗方面有着很广泛的研究[6,7]。新型减毒HSV-1载体具备安全型载体的一系列特点:较低的毒力和体内复制能力。减毒型HSV-1 1716 strain由于删除神经毒力相关基因γ34.5,其体内复制能力大大减弱;安全的中枢神经系统基因转导。研究表明,1716 strain感染中枢神经系统后,不引起显著的神经元功能病变,病毒直接进入潜伏感染阶段,不表达任何病毒相关抗原,从而具备较低免疫原性[8];潜伏相关启动子(LAP)介导长期稳定的外源基因表达。且区别于目前常用的病毒载体,HSV-1基因组非整合特性使得基因治疗更为安全。研究显示,1716-GUSB 重组病毒能介导模型鼠脑部长期表达GUSB,从而显著缓解葡萄糖贮积症[9,10]。尽管对于HSV-1疱症性角膜炎的研究表明病毒可感染进入视网膜,目前尚未有实验证据表明减毒型HSV-1载体能够介导视网膜基因转导。
本研究通过构建可长期潜伏表达外源基因OCM的HSV-1基因治疗载体1716-OCM,介导视网膜神经再生调控蛋白OCM表达,并于大鼠视神经机械性损伤模型中评价其对神经节细胞存活及视觉电生理功能的有效性。
1 材料和方法
1.1 实验材料
本研究采用的HSV-1 1716减毒株由宾夕法尼亚大学Dr.Nigel惠赠,基于1716毒株遗传背景的潜伏表达OCM毒株(1716-OCM)由本实验室前期构建。
1.2 病毒株扩增、纯化及感染性滴度测定
所有毒株接种于DMEM完全培养基中的Vero细胞,感染吸附3~4 h后跟换维持培养液(含2% FBS的DMEM培养液),继续培养3~4 d,待细胞病变圆起后收集细胞上清,4000 r/min 离心15 min以去除细胞碎片。病毒液覆盖于20%蔗糖溶液后进行密度梯度离心。26 000 r/min离心3 h后,用PBS重悬病毒沉淀,分装后于-80 ℃冻存。采用甲基纤维素噬斑法(1.5%甲基纤维素DMEM 培养液),测定上述浓缩病毒的感染性滴度,使用无血清DMEM培养液连续十倍稀释病毒液至10-8,以每孔100 μL接种于六孔板Vero细胞,感染吸附3 h后跟换甲基纤维素噬斑培养液,继续培养4~5 d。1%结晶紫染色后噬斑计数,病毒感染滴度(PFU/mL)记为:10×稀释度×蚀斑数。
1.3 1716-OCM重组病毒株体外增殖动力及外源基因表达检测
重组病毒株1716-ocm与亲本株1716,以及野生型HSV-1(Strain 17+和McKrea)以感染复数MOI=0.01接种于六孔Vero细胞中,病毒吸附3 h后,去除培养液,PBS洗涤细胞2~3次,跟换新鲜维持液,继续培养5 d,每24 h收集上清进行噬斑滴定(方法如上)及细胞形态观察。为检测病毒即早期基因和晚期基因表达差异,如上方法接种病毒至Vero细胞,于感染后6、12、24、48、72 h收集细胞,trizol 法提取细胞总RNA 后,一步法qRTPCT 检测ICP0(F:ACCACCATGACGACGACTC;R:AGCCCCGTCTCGAACAGT),ICP4(F:ATGGGGTG GCTCCAGAAC;R:CTGCCGGTGATGAAGGAG)及LAT(F:CCAACACAAAAGACCCGCTG;R:CTACA CCAGCCAATCCGTGT)与OCM(F:GGAAGATTG GGGCGGATGAA;R:CTTCGGGGGACTCGGTAA AG);GAPDH 作为内参(F:TCGACAGTCAGCCGC ATCT;R:CCGTTGACTCCGACCTTCA)。为验证重组病毒株1716-ocm外源基因蛋白水平表达,病毒接种Vero细胞后进行免疫荧光及Western blot检测。
1.4 1716-OCM重组病毒株在大鼠眼部基因转导及安全性检测
取12周龄大鼠按随机数表法分为3组(对照组、1716-OCM注射组和野生型病毒角膜感染组)每时间点3只/组。异氟烷气体麻醉状态下,玻璃体注射重组病毒1716-OCM 105PFU/μL 或对照PBS(1 μL)。野生型HSV-1(Strain 17+和Strain McKrea)感染组采用角膜接种方式,5 μL病毒液(102PFU/μL)接种于大鼠眼球表面。病毒接种后(7、14、30 和60 d)分别取眼球,视神经,脑组织;冰冻切片后免疫荧光检测OCM表达分布。本研究获得昆明医科大学动物伦理委员会批准,批准文号KMMU2021723。
1.5 大鼠视神经损伤模型中验证1716-OCM治疗效果
取12周龄SD大鼠,进行视网膜钳夹模型,每治疗组设5只大鼠作为平行重复。实验动物入组标准为:体质量250~300 g、双眼屈光间质清晰、眼底无病变。异氟烷持续麻醉状态下,进行视神经夹持损伤模型。选择伤后无前房出血、玻璃体出血、视网膜脱落等并发症;散瞳检查眼底无持续性缺血(伤后5~10 min血流恢复)的模型鼠入组。造模大鼠独立编号后,采用随机数表方法分入各组进行后续治疗。视神经夹持后3 d进行玻璃体腔注射重组病毒1716-OCM,2 μL(105PFU/μL)或对照PBS。其中1716-OCM-cAMP组需在视神经损伤后3、21、42 d于玻璃体腔注射cAMP以增强OCM活性。
功能性评价:于治疗45 d后进行视觉诱发电位检测(FVEP),从而评价视觉信号从视网膜神经节细胞大脑枕叶皮层的传导功能。FVEP检测方法参照本实验室前期研究方法[11]。
结构性评价:各模型组于治疗45 d后;灌注取眼球,制备冰冻切片,采用NeuN抗体标记视网膜神经节细胞,采用Immage J软件定量统计。取视神经全段,制备冰冻切片,采用MBP 抗体标记神经髓鞘结构,采用Immage J软件定量统计。
1.6 统计学分析
本研究中数据统计均采用SPSS 19.0 软件进行。数据定量结果采用均数±标准差表示。完全随机设计的多样本均数比较采用单因素方差分析方法,多组样本间两两比较时采用Tukey's multiple comparisons test。P<0.05为差异具有统计学意义。
2 结果
2.1 重组病毒1716-OCM体外增殖动力及外源基因表达
相比于野生型毒株(17+strain,McKrea),疫苗株1716 strain具有较高的减毒特性(图1A)。体外细胞增殖培养时,病毒滴度仅为野生型的千分之一;所感染细胞在更晚时间点出现CPE病变效应(图1B)。病毒即早期(ICP0,ICP4)和晚期(LAT)基因转录分析显示,感染中后期病毒开始转录潜伏相关转录本(LAT),从而介导构建至LAT启动子下的外源治疗基因OCM(图1C、D)。重组疫苗病毒感染Vero细胞后免疫荧光及Western blot检测显示,其能够介导OCM与Vero细胞中适量表达(图1E、F)。

图1 1716-ocm重组病毒增殖动力及外源基因表达验证Fig.1 Proliferation kinetics of the recombinant virus and validation of exogenous gene expression.A:Titration of progeny virus after infection of Vero cells.B:Cytopathic effect of Vero cells infected with different viruses(Original magnification:×200).C,D:ICP0,ICP4 and LAT (OCM) transcription in Vero cells infected with HSV-1 17+strain (C) or the recombinant 1716-OCM (D).E:Immunofluorescence staining of OCM in Vero cells infected with 1716-OCM (scale bar:100 μm).F:Western blotting of OCM expression in Vero cells infected with 1716-OCM.
2.2 1716-OCM重组病毒株在大鼠眼部基因转导
外源基因OCM免疫荧光染色显示,HSV重组病毒1716-OCM能够介导外源基因与大鼠视网膜多层细胞结构中表达,包括神经节细胞层,视网膜色素上皮层,脉络膜层及巩膜;但不能转导内核层(图2)。相比于AAV2,AAV5等常见眼部基因转导载体,1716-OCM玻璃体注射能够更高效的介导RGC 层细胞的转导,且HSV LAT介导的基因转导不仅在感染早期(7 dpi),而且在感染后期(30 dpi)均稳定高效表达外源基因。值得注意的是,病毒接种60 d后,RGC层OCM基因表达水平明显下降,但在视网膜外的脉络膜及巩膜区域表达仍较为显著。

图2 1716-OCM介导大鼠眼部基因转导Fig.2 OCM expressions in the eyes of rata after intravitreal injection of 1716-OCM detected with immunofluorescence staining(Red)(scale bar:200 μm).
2.3 1716-OCM重组病毒株眼部注射的安全性检测
由于HSV-1天然具备神经嗜性与神经毒力,本研究采用疫苗型HSV-1 1716 strain 和野生型KOS,McKrea strain 对照比较玻璃体接种后的眼部病理变化。野生型HSV-1接种后,可导致大鼠出现白内障状病变,晶体混浊(图3A、B)。抗HSV包膜蛋白gB免疫荧光显示,角膜接种的野生型病毒在眼内多层细胞结构中大量复制,典型视网膜结构受到破坏(图3C、D)。而减毒型疫苗株1716感染后,并未检测到病毒结构蛋白基因的表达;且视网膜结构并未受到明显损伤,晶状体清晰。
考到到HSV-1能够沿神经轴突顺行/逆行传播且可能导致脑炎,研究中采用免疫荧光(anti-HSV gB)检测视上丘等脑部结构的病毒复制。野生型HSV-1眼部接种后,病毒可逆行传播至上丘脑,并产生病理特征(图3E)。相比之下,减毒型1716-OCM玻璃体腔注射后,脑各区域均未检测病毒复制及病理现象。

图3 1716-OCM重组病毒株眼部注射的安全性检测Fig.3 Safety test of ocular injection of the recombinant virus1716-OCM.A,B:Representative photographs of rat eyes infected with 1716-OCM (A) or wide-type HSV-1 strain (B).C,D:Immunofluorescence staining of viral gB in the eyes infected with the wide-type HSV-1 strain McKrea (C) and 17+(D).E:Immunofluorescence staining of viral gB expression in the epithalamus of the rats infected with 1716-OCM or the wide-type strain.The neurons were stained in green and gB was stained in red(×200,scale bar:200 μm).
2.4 1716-OCM重组病毒株基因治疗在大鼠视神经损伤模型中的效果评价
视神经损伤后视网膜神经节细胞显著减少,这也是目前所认为的创伤性视神经损伤导致视力受损的主要因素之一(图4)。在此模型基础上,进行疫苗型HSV 1716-OCM载体治疗,以及联合眼内cAMP注射治疗。NeuN阳性RGC细胞免疫荧光染色及统计分析显示,疫苗载体介导的OCM基因转导能够一定程度促进视网膜神经节细胞存活(图4B、C)。
由于机械性视神经损伤可导致视神经局部少突胶质细胞等坏死(即脱髓鞘);且夹持部位视神经轴突破碎坏死,并沿神经胞体方向退行。本研究采用髓鞘碱性蛋白(MBP)标记视神经轴突结构,对比分析HSV-OCM基因治疗对轴突完整性的影响。相比于正常生理状态,夹持后受损部位MBP表达显著减少(图5)。免疫荧光定量分析显示HSV 1716-OCM基因治疗联合cAMP 眼内注射能够显著促进轴突再生或免于二次退行损伤(图4B、C)。
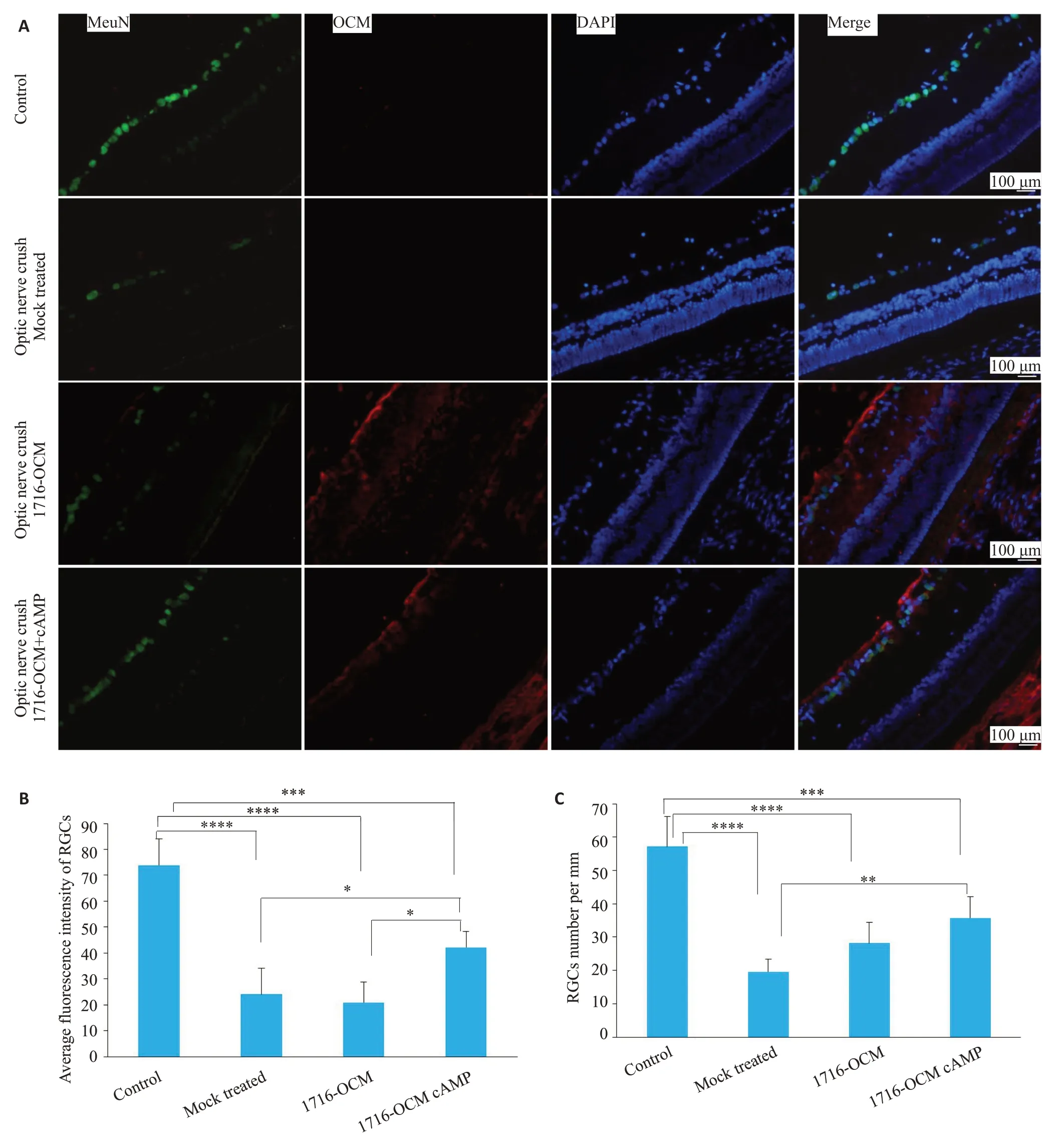
图4 1716-OCM基因治疗促进视神经夹持后RGC存活Fig.4 Gene therapy with 1716-OCM promotes retinal ganglion cell (RGC) survival in rat models of optic nerve injury.A:Immunofluorescence staining of RGCs and viral gB expression in the rat eyes at 45 days posttreatment.B,C:Quantitative analysis of the average fluorescence intensity and number of RGCs using Image J Software.*P<0.05,**P<0.01,***P<0.001,****P<0.0001.

图5 1716-OCM基因治疗抑制视神经脱髓鞘Fig.5 Gene therapy with 1716-OCM inhibits demyelination of the optic nerve.A:Immunofluorescence staining of MBP in rat optic nerve 45 days posttreatment.B,C:Quantitative analysis of average fluorescence intensity (B) and integrated fluorescence intensity(C)of MBP staining using Image J Software.*P<0.05,***P<0.001,****P<0.0001.
视神经夹持后大鼠的闪光视觉诱发电位(FVEP)模式图显著却别与正常小鼠,其ΔN1-P1峰振幅显著下降且无法识别出典型的P2及P3峰,表现出视觉电信号传导障碍(图6)。统计分析显示,HSV 1716-OCM基因治疗联合cAMP激活能够显著促进大鼠ΔN1-P1峰振幅恢复及P1波延迟缩短,这提示模型鼠视觉通路修复(图6B~D)。
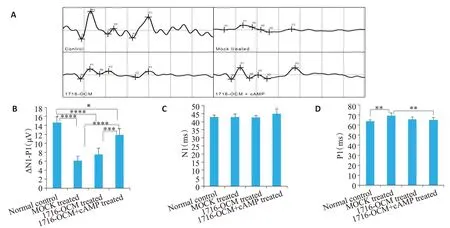
图6 FVEP检测1716-OCM基因治疗后大鼠电生理特征Fig.6 Detection of electrophysiological characteristics of rats after 1716-OCM gene therapy by FVEP.A:Representative images of rat FEVP detection.B-D:Quantitative analysis of ΔN1-P1 amplitude (B) and the incubation periods of N1(C)and P1(D)wave.*P<0.05,**P<0.01,***P<0.001,****P<0.0001.
3 讨论
本研究表明基于减毒型HSV-1 1716株的新型载体在大鼠眼部基因治疗应用中具有较高安全性及有效性。早期研究显示,核糖核苷酸还原酶缺陷的减毒型HSV-1(hrR3 strain)载体能够有效介导啮齿类及灵长目动物眼部基因转导[12,13]。然而,该减毒株在介导眼部基因转导时呈现出较高的复制能力,病毒可由角膜感染至眼内神经节细胞层,虹膜及视网膜色素上皮层[12,13]。这提示hrR3株仍可能表达关键的神经毒力基因γ34.5并扩散感染至其他非靶向组织,安全性较低。相较而言,本研究使用的减毒型1716株由于γ34.5-/-突变,在非癌细胞中缺乏复制能力,而初次感染中枢神经系统即进入潜伏状态。此外,减毒型HSV-1 1716-OCM介导的眼部基因治疗相比于重组OCM眼内注射方式具有理论优势,其可显著减少治疗所需注射次数。大鼠模型显示,单次接种即可维持外源基因表达持续至少60 d;相比之下,重组神经营养因子OCM半衰期极短,很难在实际治疗中实现多次的创伤性眼内注射。
对HSV-1 LAT 突变株的研究表明,敲除野生型HSV-1 LAT能够显著抑制病毒重激活能力[14,15]。本研究中我们将治疗基因构建至病毒潜伏相关LAP启动子下游,既确保了外源基因在潜伏状态下的持续表达,同时也阻断了病毒LAT转录本下游区域的转录,这进一步抑制了病毒重激活的能力。因此,本研究中改造1716-OCM重组病毒比其亲本株1716具备更高安全性。我们近期的研究也表明,外源表达框插入至1716株LAP启动子下游时,能够介导外源基因在小鼠海马区的长期安全高效表达[16]。总之,选择1716 strain减毒载体构建具有长期表达外源基因的新型治疗载体具有较为广阔的应用前景。
近年来,HSV-1基因治疗载体相关研究多聚焦于完全复制缺陷型载体。例如,复制缺陷性HSV-1可以高效地将外源基因转染至脊髓背根神经节(DRG)或脑内并获得表达,因此被应用于癫痫、慢性疼痛、多发性硬化症和缺血性脑损伤等[17-20]。其中复制缺陷型HSV-1表达脑啡肽以减轻癌性疼痛的研究已进入临床I期研究[21]。尽管敲除病毒所有即早期基因(ICP0,ICP4,ICP22,ICP27和ICP47)能够使其完全失去复制能力,并且不表达任何病毒相关基因;但这也导致病毒失去其天然嗜神经特性,表现出“泛嗜性”[22-25]。同时,完全复制缺陷型载体的构建也较为复杂低效,其仅能够在相应的互补细胞系中复制。由于病毒基因具有细胞毒性(如ICP0),稳定表达这些即早期基因的细胞系较难构建[26]。
然而,本研究尚未明确减毒型1716-OCM载体玻璃体注射后病毒基因组潜伏区域。对疱症性角膜炎潜伏感染的机制研究显示,野生型HSV-1角膜感染后可沿视神经轴突逆行传播至面部三叉神经节部位[27,28]。病毒虽感染裂殖部分神经节细胞,但随后进入潜伏感染阶段[29,30]。本研究中使用HSV-1 1716-OCM疫苗载体进行玻璃体腔接种,虽在视网膜RGC,RPE层检测到目的基因的长期表达,但尚不能确认OCM基因产物是三叉神经节潜伏表达并顺行传导至视网膜区域,还是视网膜部位的潜伏表达。后续研究中,我们将进一步明确疫苗型1716-OCM基因载体眼部接种后的病毒感染分子机制,确认其潜伏部位,潜伏时间,表达产物顺行/逆行轴浆转运现象等。
