黄皮白肉火龙果‘燕窝果’离体快繁技术研究
2021-11-10罗一然韩国伟毛春霞
罗一然,韩国伟,毛春霞*
(1.大理农林职业技术学院,云南大理 671003;2.红河州林业和草原局,云南蒙自 661100)
‘燕窝果’(Hylocereus megalanthus)又名麒麟果,是一种黄皮白肉的火龙果,属仙人掌科,为蛇鞭柱属和量天尺属自然杂交产生的四倍体植株,兼具两属的部分特征,大多数专家更倾向其为量天尺属[1],原产地为哥伦比亚与厄瓜多尔。燕窝果成熟时间较长,但其单果重量可达500 g,种子大而少,果肉半透明、细腻,籽外包裹着一层胶质,口感细腻丝滑,果实甜度在17~22 度,富含维C 和膳食纤维及铁元素,少量植物性蛋白及花青素,可食部分占总量的70%左右[2-5]。作为潜力巨大的新兴水果,燕窝果具有丰富的营养和极高的经济价值,单果售价可达一般红皮红肉火龙果的数十倍,其引入我国栽培的时间尚短,仅在我国海南、广西、云南等地区少量种植,加快燕窝果的种植,将有效助力乡村振兴[6-7]。目前有关燕窝果的研究报告尚少,种苗稀缺,本地果的产量和质量与进口果相比尚有较大差距,一定程度上阻碍了其推广。加快燕窝果良种繁育研究步伐,创新种苗繁育方法,是推动燕窝果产业高效发展的关键。
燕窝果的传统繁殖方法采用扦插和嫁接育苗[8],由于扦插苗根系较弱[9],生产上以嫁接繁殖为主。但嫁接育苗存在接穗的位置效应和效率低等问题,限制了燕窝果规模化生产。利用组织培养技术繁殖系数高的特点,采集外植体进行高效扩繁,可以克服当前燕窝果种苗少、成本高的难题,助力燕窝果的推广。近年来对火龙果开展组织培养研究的报道逐渐增多,市场上主流的红皮火龙果的组培快繁体系已不断得到完善[10-14],但有关黄皮火龙果的研究报道还较少,李羽佳等[15]通过种子无菌萌发的方式获得黄皮火龙果嫩芽,再以萌芽为外植体进行增殖扩繁,获得了长势良好的生根苗,增殖系数达4.6,建立了较为高效的组培繁殖体系。程志号等[16]以‘麒麟果’实生苗萌发的茎段为外植体,研究了外植体不同的切割方法和接种方法对刺座芽萌发的影响,筛选了刺座芽诱导及生根培养基,结果表明:最适合的外植体切割方法为纵切,最适合诱导刺座芽的培养基为MS+3 mg/L 6-BA+0.2 mg/L IBA,生根率最高的配方为1/2MS+0.1 mg/L NAA,生根率90%以上。以上研究均以黄皮火龙果的实生苗为外植体,无法完全保持原有品种的优良性状。因此,本项研究以优良燕窝果嫩茎为外植体,建立燕窝果组织培养繁殖方法,可为快速繁育良种燕窝果种苗奠定基础。
1 材料和方法
1.1 试验材料
本试验所用的材料为燕窝果嫁接苗,采自云南省红河州火龙果种质资源圃,栽植于温室大棚内。每年4 月和8 月左右抽生出嫩茎,待嫩茎抽生至10 cm 左右时,切取作为外植体材料。
1.2 试验方法
1.2.1 无菌外植体材料获得
(1)将从温室大棚采集的幼嫩茎段带回实验室,用洗洁精仔细清洗,毛刷刷洗易贮藏细菌的刺座部分,然后将外植体放置于烧杯中,流水冲洗1 h 后,再用滤纸吸干水分。(2)在超净工作台上以75%酒精、5%双氧水和0.1%升汞组合消毒,设计L9(34)的正交试验,每种消毒剂消毒时间设置3 个水平,分别为:75%酒精5 s、10 s、20 s;5%双氧水1 min、2 min、3 min;0.1%升汞3 min、4.5 min、6 min。(3)消毒完后用无菌水冲洗3 次,接种在MS 空白培养基中,每个处理接种5 瓶,每瓶2个外植体,重复3 次。置于培养室中,10 d 后观察并统计污染率和褐化率。
1.2.2 增殖培养
将获得的无菌外植体茎段切为2 cm 高的三棱柱状,确保每个外植体有刺座,接种到添加有NAA 和TDZ 的MS 培养基中,激素浓度设计两因素三水平,其中NAA 的3 个水平分别是0.5、1.0、1.5 mg/L;TDZ 的3 个水平分别是0.5、1.0、1.5 mg/L。共9 个处理,每个处理接种5 瓶,每瓶接种2 个外植体,重复3 次。接种30 d 后观察并记录增殖芽生长状况,统计增殖率。待刺座芽长出1~2 cm 后,再将刺座芽切下转接到相同培养基中进行增殖。
1.2.3 壮苗和生根培养
待增殖芽长至3~4 cm 后,将长势良好的增殖芽从基部切下,接种于添加0.1 g/L 碳粉和不同浓度IBA(0.1、0.5 mg/L)、IAA(0.1、0.2 mg/L)、NAA(0.1、0.2 mg/L)的1/2MS 培养基,共6 种不同组合的试验,培养30 d 后观察记录不定芽和根的生长情况。每个处理接种5 瓶,每瓶接种2 颗组培苗,重复3 次。接种后每周观察1 次,30 d 后根据生根数、不定芽与不定根长势筛选出最适培养基。
1.2.4 炼苗移栽
当小苗根长3.0 cm 以上,且苗高2~3 cm 时,即可进行炼苗移栽。从培养室移至温室大棚中放置5 d,打开瓶盖再放置5 d,洗净根部培养基,移栽至河沙∶园土∶珍珠岩体积比为1∶1∶1 混均基质的穴盘中,基质内混合少量复合肥,浇透水。栽培30 d 后统计成活率,观测生长情况。
1.3 培养条件
培养条件为:温度(25±3)℃、光照1 500~2 600 lx、光照周期14 h/d、相对湿度55%~65%。
1.4 数据分析
采用Microsoft Excel 与SPSS 软件对试验数据进行统计分析。
2 结果与分析
2.1 不同消毒方案对茎段消毒效果的影响
不同处理组合的消毒效果如表1 所示,酒精的消毒时间需要特别注意,75%酒精浸泡外植体5 s 不能达到较理想的灭菌效果,但消毒20 s 又易伤害幼嫩茎段,造成褐化死亡,只有3 种消毒剂的合理搭配才能达到理想的灭菌效果。不同处理组合的消毒方式对外植体污染率和存活率的影响均达到极显著水平(P<0.01)。在污染率方面,处理A6、A8、A9 污染率显著低于其他处理,分别为5%、8.3%、4.3%,三者之间差异不显著,灭菌效果较差的是处理A1、A2 和A7,污染率达70%、66.7%和65.7%;外植体存活率方面,处理A4 和A6成活率显著高于其他处理,存活率为88.7%、94.7%,存活率最低的是处理A3,仅为22.7%。试验中A4 存活率虽然较高,但污染率也偏高,达51%。A9 的污染率虽然最低,但由于消毒时间较长,外植体的存活率也随之下降,为58.3%,表现为嫩茎切口处褪绿,慢慢褐化死亡。综合考虑,选择存活率最高且污染率较低的处理A6 作为燕窝果茎段消毒的最优方案,即:75%酒精消毒10 s,5%双氧水3 min,0.1%升汞3 min。
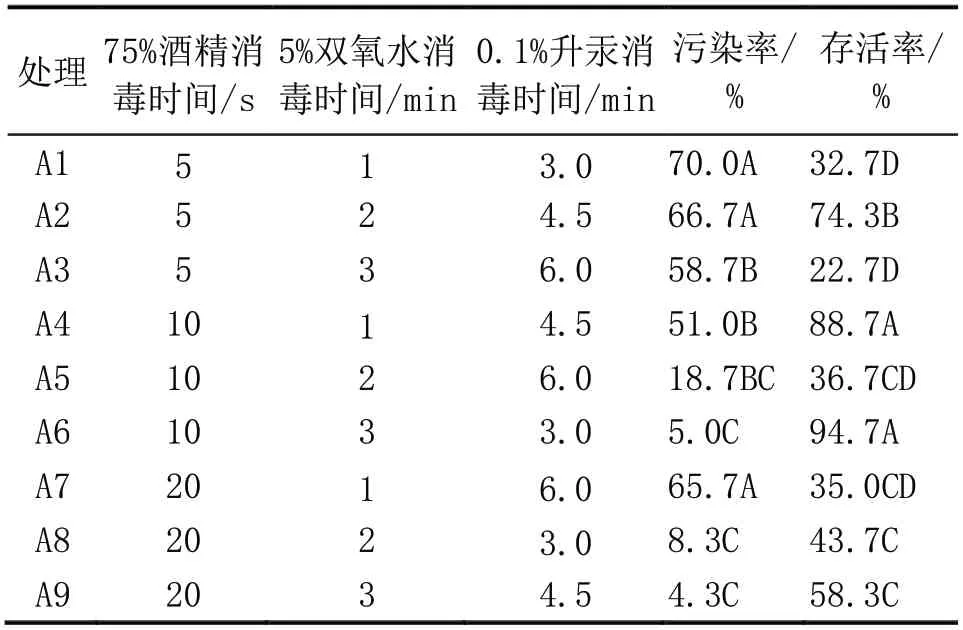
表1 不同灭菌方法对外植体污染率和存活率的影响
2.2 不同激素配比对刺座芽增殖的影响
试验发现只有NAA 与TDZ 的浓度皆低于1.5 mg/L 的培养基可诱导出生长正常的刺座芽,激素浓度等于或高于1.5 mg/L 则会导致出芽玻璃化。再将刺座芽接种到添加适宜浓度的NAA 与TDZ的培养基中也可以获得较好的增殖效果。不同处理组合对刺座芽诱导的影响如表2 所示,添加不同浓度的NAA 和TDZ 处理,其平均增殖系数和芽高存在显著差异(P<0.05)。处理B2 的增殖系数显著高于其他处理,增殖系数最高,为4.53,且平均芽高为3.23 cm,幼苗长势良好。处理B8 和B9 为添加较高浓度的处理,两个处理之间的增殖系数和芽高差异均不显著,随着NAA 与TDZ 的浓度升高,苗易出现玻璃化、长势不良的现象,抑制不定芽增殖。试验结果表明:处理B2 为燕窝果刺座芽增殖的最优培养基,即:MS+0.5 mg/L NAA+1.0 mg/L TDZ。
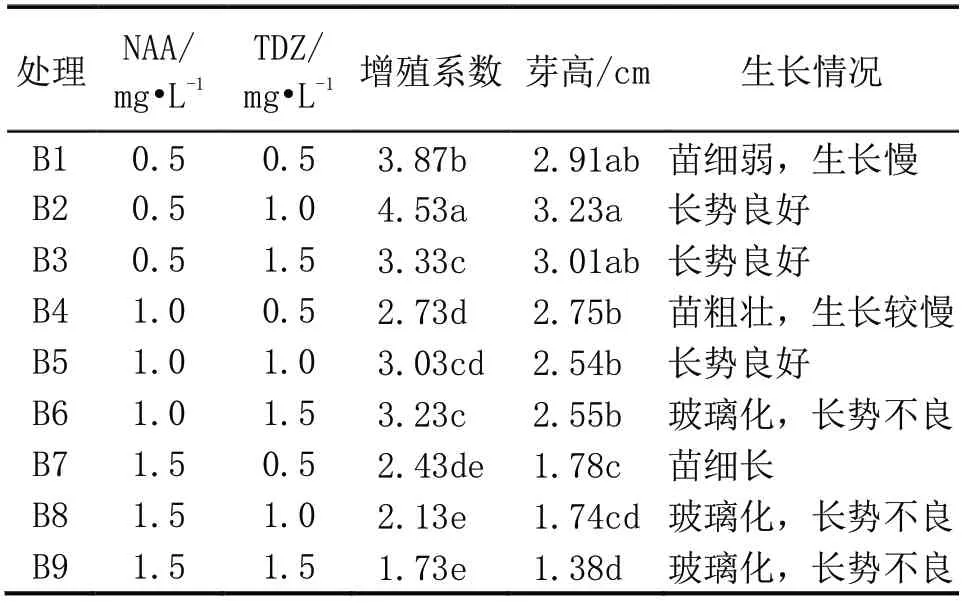
表2 不同浓度NAA和TDZ配比对刺座芽增殖的影响
2.3 不同激素配比对不定芽壮苗和生根的影响
不同处理组合对燕窝果不定芽壮苗和生根的影响如表3 所示,燕窝果不定芽接种到所有组合中都能生根,不同浓度激素配比对不定芽生根数有影响。平均生根数较高的处理是C4、C5、C6,分别为6.18、6.33、5.18,三者之间差异不显著;平均生根数最低的是处理C1 和C2,分别为2.77、2.43,两者之间差异不显著,不定芽生长慢且根较弱小。处理C2、C3、C4、C6 的壮苗效果都较好,不定芽嫩绿、生长健壮,处理C2 的根系细弱,其余组合根系生长状况良好,其中处理C4 的平均生根数较高,为6.18。处理5 的平均生根数最高,为6.33,但部分不定芽出现玻璃化现象。综合考虑,选择处理4 为最佳壮苗和生根培养基,即1/2 MS+0.5 mg/L IBA+1.0 mg/L NAA+0.1 g/L 碳粉。

表3 不同生长调节剂配比对不定芽生根情况的影响
2.4 炼苗移栽
组培苗移栽到基质20 d 后,木质化程度逐渐增强,小苗长势明显,移栽成活率可达90%以上。
3 讨论
无菌材料获得是燕窝果组织培养试验的难点,微生物易在刺座处驻藏,难以彻底灭菌。本研究采用何小帆[14]等对火龙果外植体进行预处理的方法,拔除刺座处的小刺,对刺座进行洗刷,但全年不同时期采集的外植体污染率仍出现很大差异,从9 月开始至来年2 月,外植体污染非常严重,因7 月、8 月正是病虫害发生的季节[17],且大理地区正值雨季,湿热的环境加剧了微生物的繁殖。虽然燕窝果在4 月和8 月左右都会抽生嫩茎,但为了避免出现过高污染率,影响无菌外植体获得,获取无菌外植体的时间控制在3 月到7月底之间,主要采集4 月抽生的嫩茎作为外植体。为了杀死刺座处的微生物,本试验除了使用酒精、升汞两种常规消毒剂,还增加了双氧水辅助消毒,其消毒能力较强,对幼嫩茎段伤害小,且易冲洗去除,组合使用3 种灭菌剂获得较好的灭菌效果。
本试验对比了6-BA 与TDZ 两种细胞分裂素诱导燕窝果刺座芽的效果。结果显示,低浓度的6-BA 不能诱导刺座芽,浓度需提升至6 mg/L,外植体才能诱导出刺座芽,但芽出现玻璃化,且只有少数刺座能诱导出芽,诱导效果较差。采用TDZ 诱导要优于6-BA。这可能是由于TDZ 的活性要比6-BA 高得多,可以在较短的时间内对植物组织生长进行有效刺激,有效促进植物细胞再生[18]。试验中,培养基中添加1.0 mg/L TDZ 与适宜浓度NAA 即可达到很好的刺座芽诱导效果,而且将刺座芽切下接种至该培养基中也能获得较好的增殖效果,一种培养基可以满足两个关键组培步骤所需,提高了繁育效率,节约了成本。为了获得更高增殖系数的配方,本试验尝试提高TDZ 的浓度进行增殖,但多数不定芽出现细弱、玻璃化等现象。TDZ 是一种具有高效促细胞分裂能力的植物生长调节剂,同时也具备生长素的作用,与较高浓度NAA 协同作用反而抑制了不定芽生长。因此,在进一步研究中要注意适当降低TDZ 的浓度,同时尝试与其他生长素配合,多设置试验梯度,以找到最适增殖培养基。
试验中获得了生根效果较好的组培苗,但要注意组培苗移栽后的栽培管理,燕窝果苗对栽培的土质要求不严,但必须疏松透气,排水良好,水分积滞会造成烂根。采用河沙∶园土∶珍珠岩体积比为1∶1∶1 的配比作为燕窝果的移栽基质,配合少量复合肥,可获得较高的移栽成活率。
