吸水和干燥条件下发菜核糖体代谢差异表达基因分析
2021-11-09胡进红马晓蓉梁旺利梁文裕王玲霞
胡进红,马晓蓉,宋 繁,梁旺利,梁文裕,王玲霞
(宁夏大学 生命科学学院, 银川 750021)
发菜(Nostocflagelliforme)是一种耐旱性极强的陆生固氮蓝藻,分布在中国西北部干旱和半干旱的荒漠草原和荒滩戈壁等地区,生命周期中经历交替的脱水和复水过程,具有生物固氮和拓荒固沙的重要经济和生态价值[1]。由于人们的乱采滥挖,导致发菜资源逐年减少,发菜已被列为国家一级野生保护植物。目前,有关发菜在吸水和干燥条件下的结构变化、生理生态、基因和蛋白表达及蛋白修饰已有一些报道[2-3],但有关发菜适应“干-湿”水分节律的分子机制尚有许多未解之谜。
核糖体蛋白可直接或辅助调节多肽链的合成以及执行核糖体外功能[4]。研究发现白三叶中多胺物质(PAs)下降从而影响核糖体蛋白表达下调是干旱胁迫适应性减弱的部分原因[5]。低温和干旱胁迫下,水稻根和茎中核糖体蛋白RPL14基因的表达量均相应增加[6],维持较高的核糖体蛋白积累与植物抗旱性的提高密切相关[7]。拟南芥根系中的同源基因会编码不同的核糖体蛋白[8],核糖体蛋白的磷酸化等修饰作用会改变核糖体的蛋白合成活性,从而适应环境胁迫[9]。
前人报道指出:斧形沙芥在重度干旱胁迫下,核糖体通路是差异基因富集的主要通路之一[10]。耐旱蚕豆中,50S核糖体蛋白在干旱胁迫下表达上调,推测其通过重建正常的蛋白质构象来保护植物免受干旱胁迫[11]。甘蔗核糖体蛋白基因也可在干旱胁迫下被诱导表达[12]。从茶树抗旱性蛋白的鉴定中发现参与蛋白质加工(核糖体蛋白)、清除活性氧和防御蛋白质(超氧化物歧化酶、过氧化物酶和硫氧还蛋白)上调可能会增强植物对干旱胁迫的适应性[13]。核糖体蛋白是蛋白质合成的关键,在植物发育以及感知干旱胁迫等方面起着重要调节作用[14]。因此,植物核糖体代谢与干旱胁迫适应具有明显的相关性,但目前干旱胁迫下核糖体蛋白基因的表达及相应调控机制研究较少,需深入研究和探讨。
本研究采用高通量Illumina Hi Seq PE150测序平台及生物信息学方法对发菜适应“干-湿”水分节律的差异表达基因进行筛选,解析发菜吸水和干燥条件下的核糖体代谢差异表达基因变化规律,为发菜适应“干-湿”水分节律的调控机制研究提供参考。
1 材料与方法
1.1 材 料
发菜(N.flagelliforme)样品采自宁夏贺兰山自然生长地。将所采的发菜种植于模拟自然条件的培养床上,持续培养10 d后进行样品处理(温度23~25 ℃、湿度30%、光周期12 h/12 h、光照强度400 μmol·m-2·s-1)。充分吸水4 h的发菜为对照组A,自然失水48 h的发菜为处理组B(图1)。每种处理组设置3次生物学重复。

A.充分吸水4 h;B. 极度干燥48 h; 下同图1 吸水和干燥条件下发菜的形态变化A. Hydration for 4 hours; B. Dehydration for 48 hours. The same as belowFig.1 Morphological changes of N. flagelliforme subjected to hydration and dehydration
1.2 方 法
1.2.1 RNA提取及测序文库构建发菜RNA的提取采用杨佳[15]优化后的天根试剂盒法,得到样品RNA后构建cDNA测序文库。使用Qubit 2.0初步定量文库,稀释至1 ng/μL的文库的插入片段采用安捷伦2100进行检测。使用定量聚合酶链式反应(Q-PCR)方法准确定量插入片段符合预期的文库的有效浓度(文库有效浓度>2 nmol/L),以确保其质量达到送样要求。
1.2.2 Illumina HiSeq测序及数据质量控制原始数据(raw reads)是通过高通量Illumina HiSeq PE150测序平台对已构建好的文库进行测序所获得。将原始数据中带接头(adapter)的读段(reads)、无法确定碱基信息比例大于10%的读段(reads)和低质量读段(reads)进行过滤处理,获得干净读段(clean reads)。然后以已公布的发菜基因组(http://genome. kazusa.or.jp/cyanobase/NostocflagelliformeCCNUN1)作为参考基因组进行比对分析。
1.2.3 差异基因筛选在基因列表中,以CorrectedP-value ≤ 0.05且|log2(FoldChange)|>0为差异基因筛选标准进行差异表达基因筛选。
1.2.4 差异基因GO功能富集分析将筛选出的差异表达基因通过GO(Gene Ontology)进行功能富集分析,确定差异表达基因参与的生物学功能。
1.2.5 差异基因KEGG pathway分析将筛选出的差异表达基因通过KEGG(Kyoto Encyclopedia of Genes and Genomes)进行Pathway显著性富集分析来确定其参与的最主要的生化代谢和信号转导途径。
1.2.6 差异表达基因的qRT-PCR分析为了验证转录组测序的数据,随机选择6个核糖体代谢差异表达基因进行实时荧光定量(qRT-PCR)分析,利用Primer5.0软件设计引物(表1)。选择16S-rRNA为内参基因,利用相对定量法进行表达量估算。
1.3 数据处理
采用Excel 2013对实验数据进行整理和作图,数据方差分析和多重比较使用SPSS 17.0软件。
2 结果与分析
2.1 吸水和干燥条件下发菜转录组测序
利用琼脂糖凝胶电泳检测提取的总RNA质量。结果表明,发菜总RNA样品电泳显示出明显的23S和16S条带(图2)。使用Agilent 2100检测文库的插入片段和核酸浓度测定仪测定结果表明,发菜提取的总RNA符合转录组测序送样要求。
对样品测序数据质量进行评估,每个样本测序数据中,错误率≤0.03%,碱基G和C的含量占总碱基的45%左右,Q20和Q30均高于94%。测序数据质量具有较高的可靠性。

表1 qRT-PCR引物序列
以已公布的发菜基因组(http://genome. kazusa.or.jp/cyanobase/NostocflagelliformeCCNUN1)为参考基因组,对过滤后的测序序列通过Bowtie2进行基因组定位分析。所有样本测序序列(Total Mapped Reads or Fragments)定位的百分比高于78.23%,其中具有多个定位的测序序列(Multiple Mapped Reads or Fragments)占总体测序序列的值低于17.11%。为了确保测序数据对基因表达的准确反映,需要对数据重复间的相关性进行分析。对发菜两个不同样本进行相关性检测结果显示,样本间的相关系数均大于0.88(图3),表明测序数据可靠、样本间重复性良好且变异不大。

M. DNA marker;1-3. 发菜A;4-6. 发菜B图2 发菜总RNA电泳结果M. DNA marker; 1-3. A of N. flagelliforme; 4-6. B of N. flagelliformeFig.2 Electrophoresis image of total RNA of N. flagelliforme

A1-A3. 充分吸水4 h;B1-B3. 极度干燥48 h图3 样品相关性检测结果A1-A3. Hydration for 4 hours; B1-B3. Dehydration for 48 hoursFig.3 Sample correlation test results
2.2 吸水和干燥条件下发菜基因的差异表达
根据差异基因筛选标准,对2个样品进行两两差异基因统计分析,共筛选到差异表达基因3 383个。其中,与对照组相比,上调基因为1 767个,占总差异基因的52.2%;下调基因为1 616个,占总差异基因的47.8%(图4)。
2.3 吸水和干燥条件下发菜差异表达基因的GO功能富集分析
对处理组中所有差异表达基因进行GO功能注释富集分析(P≤0.05),结果发现(图5),涉及生物过程中的12个显著富集的GO条目中,差异表达基因主要富集于有机氮化合物代谢、蛋白质代谢、有机氮化合物生物合成、细胞蛋白质代谢、酰胺生物合成、肽代谢、肽生物合成和翻译等过程;细胞组分类别中的10个显著富集的GO条目中,差异表达基因主要富集在细胞组分、膜组分、细胞质、胞质组分、核糖核蛋白复合体和核糖体等功能;参与分子功能的6个显著富集的GO条目中,差异表达基因主要富集在核糖体的结构组分、核苷酸转移酶活性和作用于tRNA的催化活性等功能。结果表明,在干燥条件下发菜基因主要富集在蛋白质合成和代谢等相关代谢途径中。
2.4 吸水和干燥条件下发菜核糖体代谢差异表达基因的KEGG Pathway富集分析
对处理组中所有差异表达基因通过KEGG pathway显著性富集进行分析,选取显著富集到核糖体代谢途径的代谢通路(P≤0.05),发现均为上调表达的46个差异表达基因(表2)。
2.5 qRT-PCR验证核糖体代谢差异基因表达量
利用qRT-PCR技术对核糖体基因rplD、rplV、rplC、rplU、rpsB、rpsC在转录水平上的表达模式进行分析。结果表明,在干燥条件下,基因相对表达量较对照组均显著增加(P≤0.05),与转录组测序数据结果一致(图6)。
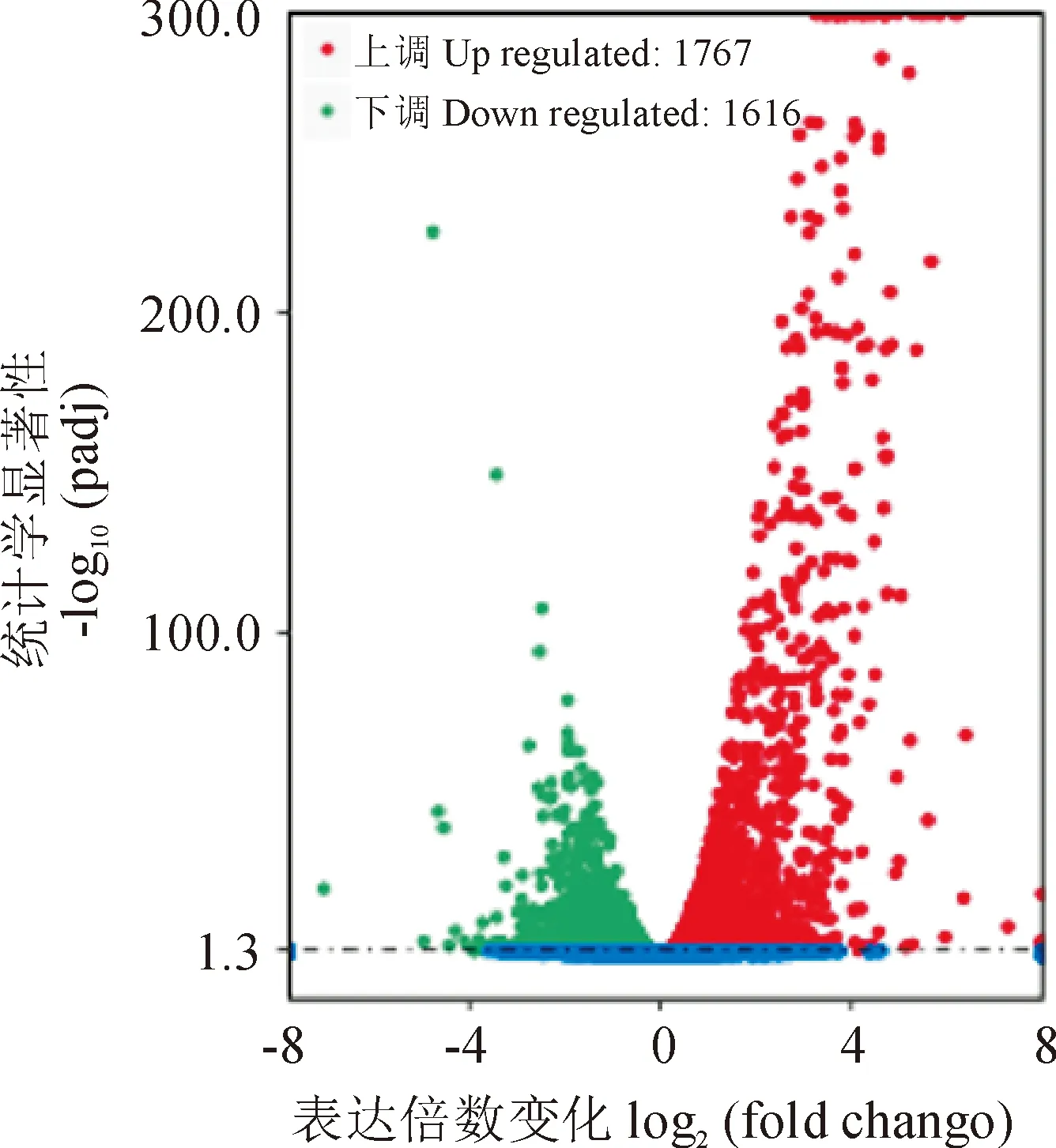
图4 发菜差异表达基因火山图Fig.4 Differential gene volcano plot of N. flagelliforme

* 表示显著富集图5 吸水和干燥条件下发菜差异表达基因GO富集图* is significant enrichmentFig.5 GO enrichment of differential genes in N. flagelliforme subjected to hydration and dehydration

图6 吸水和干燥条件下发菜基因的相对表达量Fig.6 Relative expression of genes in N. flagelliforme subjected to hydration and dehydration
3 讨 论
本研究通过GO功能富集分析和KEGG pathway富集分析发现,在吸水和干燥条件下发菜差异表达基因主要富集在蛋白质合成与代谢等相关途径,并且核糖体代谢途径被显著富集(P≤0.05)。核糖体代谢途径包含了均为上调表达的46个差异基因。经过qRT-PCR验证发现,干旱条件下的核糖体代谢途径的差异表达基因的表达量显著增加。
植物通过新陈代谢的变化来适应环境信号,蛋白质合成便是其中之一[16]。核糖体是应激条件下的基本亚细胞结构,核糖体大亚基蛋白基因的上调可能会通过维持或改善核糖体的正常功能,从而维持蛋白质的正常合成[17]。核糖体蛋白是核糖体生物发生和蛋白质合成中不可或缺的物质。小麦的蛋白质组学研究显示,核糖体蛋白在干旱条件下会发生显著变化[18]。核糖体是一种复杂的负责合成多肽的核糖核蛋白复合体,含有大量的核糖体蛋白质组分,这些核糖体蛋白的合成协调对植物细胞应对干旱胁迫构成了重大的挑战,其中,转录调控是植物核糖体蛋白基因调控的重要组成部分[19]。
前人研究发现,核糖体蛋白L4、L22辅助RNA形成多肽出口通道,且多肽出口通道主要由大亚基核糖体蛋白L19、L22、L23、L24、L31e组成,以上核糖体蛋白具有分泌和参与折叠新生蛋白的功能[20]。此外,有研究指出拟南芥种子萌发和幼苗早期对渗透胁迫和脱落酸的灵敏性可通过核糖体蛋白L24A调节拟南芥锌指结构(atrzf1)突变体中的脯氨酸含量来改变[21]。核糖体蛋白L5是一个穿梭蛋白,在 5S rRNA核质转运过程中起作用[22]。干旱、盐和冻害胁迫对核糖体L5基因表达有一定的诱导作用[23]。蛋白质翻译过程中核糖体蛋白L10、L11、L7/L12具有招募蛋白因子和激活GTP酶的作用[24]。UV-B辐射应激信号可能通过CKB1调控核糖体L10家族的表达来积极调节[25]。核糖体蛋白L44基因在烟草中过表达会提高对干旱胁迫的耐受性[26]。植物核糖体蛋白基因的表达在各种胁迫处理下的转录水平都发生了变化,如拟南芥的核糖体蛋白L23a[27]、烟草L3[28]等。本研究发现以上这些核糖体蛋白的相关基因在发菜干燥条件下都上调表达,说明这些基因和发菜的耐旱性关系密切。

表2 吸水和干燥条件下发菜参与核糖体代谢途径相关差异表达基因

续表2 Continued Table 2
核糖体蛋白S21、S8、S2、S11和S7可作为解旋酶帮助聚合到原核生物核糖体上的mRNA解旋,调控肽链的合成[29]。有研究发现在拟南芥中核糖体蛋白S10在小亚基中具有非常重要的作用,缺失S10直接导致具有功能的核糖体数量减少[30]。细菌核糖体蛋白S1接近肽链合成通道附近,可以与核糖体蛋白S2、S3、S5、S6、S18等核糖体蛋白互作[31]。核糖体蛋白S6的修饰参与了拟南芥发育调节和对环境刺激的适应性,S6是翻译效率和核糖体生物发生水平上的一个关键的蛋白翻译调节因子[32]。拟南芥中的核糖体蛋白S21突变损害光合作用和叶绿体发育,并且对葡萄糖高度敏感[33]。比较蛋白质组学发现核糖体蛋白S5影响了光系统Ⅰ和Ⅱ蛋白以及质体核糖体蛋白的大量积累,而且叶绿体核糖体蛋白S5和PSRP2影响干旱胁迫中种子的萌发以及盐胁迫中种子的生长[34-35]。此外,植物还可以通过高度动态的翻译机制来应对干旱胁迫,这种机制与转录机制协同作用[36]。以上研究结果说明核糖体蛋白可以适当调控植物应对外界胁迫。在本研究中这些核糖体蛋白的相关基因在发菜干燥条件下也呈上调表达,说明这些基因的表达可能参与了发菜适应外界环境变化的调节。
因此,我们认为发菜在干燥条件下可能通过激活特定的基因来维持核糖体组分的完整性,有助于核糖体重构和选择性翻译,从而帮助抗旱相关的蛋白质的合成和正确折叠、并参与渗透调节作用等重要生理活动进而调控其对干燥环境条件的适应。
