彩斑突变体菊花CmF3′Ha基因及启动子的克隆与分析
2021-11-09陈新娜李彦慧陈东亮潘晓飞黄丛林
王 森,陈新娜,李彦慧,陈东亮,潘晓飞,黄丛林*
(1 河北农业大学 园林与旅游学院,河北保定 071000;2 北京市农林科学院 北京农业生物技术研究中心/农业基因资源与生物技术北京市重点实验室,北京 100097;3 北京市功能花卉工程技术研究中心,北京 100097;4 大名县自然资源和规划局,河北邯郸 056900)
花青素(anthoyanidins)是植物最重要的一类植物色素,是许多植物根、茎、叶、花、果实等呈现出多种色泽的重要物质基础。除呈色反应,花青素还具有清除自由基,增强植物对低温、干旱、盐分等非生物胁迫抵抗能力的作用[1-2]。对人类而言,植物花青素也具有十分重要的应用价值,目前已被广泛应用于作物改良、医药、食品等众多领域[3]。植物花青素生物合成途径的研究已比较清楚,主要包括矢车菊素(cyanidin)、天竺葵素(pelargonidin)和飞燕草素(delchindin)3个途径。3种色素合成途径的上游阶段完全一致,自形成二氢黄酮醇(dihydrokaempferol)之后,分别经由F3′H和类黄酮3′,5′-羟化酶(F3′5′H)催化形成二氢槲皮素(dihydroquercetin)和二氢杨梅素(dihydromyricetin),进而分化出矢车菊素、天竺葵素和飞燕草素3种合成途径[4]。因此,F3′H和F3′5′H被认为是决定植物花青素的关键酶,如果其活性缺失,可能会导致无法形成天竺葵素或者飞燕草素,从而导致植物缺少红色或蓝色花[5]。
菊花(Chrysanthemummorifolium)为菊科菊属多年生宿根草本植物,是当今最重要的观赏植物之一。花青素类色素是菊花中最重要的呈色物质,但由于缺失F3′5′H酶活性,导致缺少飞燕草类色素,因此菊花不存在自然的蓝色品种[6]。对不同颜色菊花花青素分析显示,菊花主要含有矢车菊类色素[7],而花青素合成相关基因的表达分析也显示,F3′H可能是菊花花青素合成最关键的基因[8]。
本试验前期筛选到粉色菊花品种CQ17的彩斑突变体CQ17-mu,其表现为粉色花瓣上分布有不规则条斑。经代谢组分析,该两种类型的菊花中主要含有矢车菊素-3-丙二酰基葡萄糖苷,并且在突变体中其含量显著增加,表明矢车菊素-3-丙二酰基葡萄糖苷可能是条斑部位呈现紫色的主要呈色色素。本研究以彩斑突变体菊花CQ17-mu为材料,利用RT-PCR技术克隆得到了其F3′H基因序列,并对不同时期和不同颜色花瓣中F3′H基因的表达情况进行了分析;同时,克隆得到了该基因的上游启动子序列,并对其含有的顺式元件进行了分析,为深入研究彩斑突变体菊花中F3′H基因功能及其参与的分子调控网络以及进一步解析彩斑突变体菊花花青素代谢机制奠定了基础。
1 材料和方法
1.1 试验材料
本研究的植物材料为北京市农林科学院生物技术研究中心保存的菊花CQ17的田间自然突变体CQ17-mu,该突变体在粉色花瓣沿脉方向上不均匀分布着紫色条状斑点(图1)。
1.2 方 法
1.2.1 彩斑菊花CmF3′Ha基因的克隆使用TaKaRa的RNA提取试剂盒提取CQ17-mu花瓣的总RNA,并取1 μg RNA利用Promega的反转录试剂盒合成cDNA第一链。根据前期构建的CQ17转录组数据中搜查到的F3′H同源基因序列为模板,利用Primer Premier 5.0软件设计 CQ17-muF3′H基因ORF克隆所需的特异性引物F3′H-F1/R1和F3′H-F2/R2(表1)。以CQ17-mu花瓣cDNA为模板,利用巢式PCR技术克隆F3′H基因,反应体系为20 μL:5×Primes STAR Buffer 4 μL,dNTP Mixture 1.6 μL,cDNA 1 μL,F3′H-F1/R1(10 μmol/L)各1 μL,Primes STAR 0.1 μL,用ddH2O补足到20 μL。反应程序为98 ℃预变性4 min;98 ℃变性50 s,退火50 s(引物退火温度见表1),72 ℃延伸2 min,循环35次;72 ℃再延伸10 min。以第一轮PCR产物为模板,F3′H-F2/R2为引物进行第二轮PCR。PCR产物用1%的琼脂糖凝胶电泳进行检测,预期大小的片段经纯化回收后连接pGEM-T easy载体,然后热激转化大肠杆菌DH5α,经蓝白斑筛选获得的阳性克隆,送至上海生工生物技术有限公司测序鉴定。

CK1、CK2分别为菊花CQ17完全展开时和未展开时花瓣;S1、S2为分别为突变体CQ17-mu完全展开时和未展开时花瓣图1 菊花CQ17及其突变体CQ17-mu的花瓣CK1 and CK2 were petals of Chrysanthemum morifolium CQ17 when fully unfolded and not unfolded, respectively; S1 and S2 were petals of mutant CQ17-mu when fully expanded and not expanded, respectivelyFig.1 Petals of Chrysanthemum morifolium CQ17 and its mutant CQ17-mu
1.2.2 彩斑菊花CmF3′Ha基因的生物信息学分析使用NCBI ORF finder在线分析F3′H基因的ORF;使用NCBI Concserved Domain在线软件分析F3′H编码蛋白的保守结构域;利用ExPASy在线工具分析F3′H编码蛋白的相对分子量、分子构成、等电点、不稳定系数、脂肪系数以及疏水性等理化性质;使用在线软件PSORT(https://psort.hgc.jp/form2.html)网站预测F3′H蛋白在细胞中的表达部位;使用NCBI Blast对F3′H编码的氨基酸序列进行一致性比较,并利用DNAMAN软件进行序列比对;利用MEGA7.0软件构建不同物种基于F3′H同源蛋白的系统进化树。
1.2.3 彩斑菊花CmF3′Ha基因的表达分析根据获得的ORF基因序列,利用Primer Premier 5.0设计菊花CmF3′Ha基因的实时定量PCR引物(表1)。分别以不同时期CQ17和突变体CQ17-mu花瓣的cDNA为模板,以ClUBI基因为内参[9],利用TaKaRa的SYBR Premix Ex Taq TM荧光定量试剂盒和Bio-rad CFX96荧光定量PCR仪进行PCR扩增和实时定量分析。20 μL的反应体系包括:2×TB Green Fast qPCR Mix 10 μL,上下游引物(10 μmol/L)各0.8 μL,cDNA 2 μL,用ddH2O补充到20 μL。反应程序为95 ℃预变性30 s;95 ℃变性5 s,55 ℃复性30 s,循环40次。每个样本设置3次生物学重复试验,使用2-ΔΔCT法计算各样本间的相对表达量。
1.2.4 彩斑菊花CmF3′Ha基因的启动子克隆与分析使用TaKaRa的DNA提取试剂盒提取CQ17-mu花瓣的DNA,采用TaKaRa Genome WalkingKit试剂盒进行启动子序列的克隆。根据获得的彩斑菊花F3′H基因序列设计启动子克隆的特异引物SP1、SP2和SP3(表1),反应体系及反应程序参考TaKaRa Genome Walking Kit说明书。PCR产物经电泳检测,符合预期特征的条带经切胶回收后连接pGEM-T easy载体,转化大肠杆菌DH5α,送上海生工进行测序。测序正确的序列提交Plant Care在线软件进行顺式元件的预测分析。

表1 引物序列
2 结果与分析
2.1 彩斑菊花CmF3′Ha基因的克隆及序列分析
以彩斑菊花CQ17-mu花瓣的cDNA为模板,经巢式PCR克隆及电泳检测,得到一条约1 600 bp的特异性条带(图2)。经测序分析显示,该基因序列全长1 595 bp,通过ORF finder分析发现,其含有一个1 527 bp ORF,编码508个氨基酸。通过NCBI Blastp比对发现,该基因编码产物与已知的菊花CmF3′H蛋白(GenBank 登录号 AWH66840)的相似性最高,为99.41%,因此将该基因命名为CmF3′Ha。
M.DL2000;1,2. CmF3′Ha图2 彩斑菊花F3′H基因克隆的电泳检测Fig.2 Electrophoretic detection of F3′H gene clone in color spot C. morifolium
2.2 CmF3′Ha蛋白的生物信息学分析
ExPASy在线分析显示,CmF3′Ha蛋白的相对分子量为56 kD,分子式为C2544H4036N682O705S17,等电点为6.96,不稳定系数为35.10,亲水性平均系数为0.121,脂肪系数为106.73,由此推测,CmF3′Ha蛋白为稳定、疏水蛋白。
保守结构域分析发现,CmF3′Ha蛋白符合P450超家族序列结构特征,与其他植物的F3′H类似,CmF3′Ha氨基酸序列包含必需的膜锚定位点LPPGP,促使形成氧分子的结合域AGTDT,血红素结合位点FGAGRRICAG以及F3′H蛋白的特异序列GGEK等4个保守序列(图3)。亚细胞定位预测结果显示,CmF3′Ha蛋白定位在不同部分的可能性分别为细胞质39.1%,线粒体17.4%,细胞核17.4%,内质网13.0%,分泌系统小泡4.3%,过氧化物酶体4.3%,高尔基体4.3%,由此推测,CmF3′Ha蛋白定位在细胞质内的可能性最大。
利用MEGA7.0软件构建彩斑菊花CQ17-mu和其他植物基于F3′H同源蛋白的系统发育树,结果如图4,CmF3′Ha与已报道的菊花CmF3′H亲缘关系较近,其次是黄花蒿(Artemisiaannua)、大丽花(Dahliapinnata)、硫华菊(Cosmossulphureus)、万寿菊(Tageteserecta)等其他菊科植物,与山茶(Camelliasinensis)、葡萄(Vitisvinifera)等非菊科植物亲缘关系相对较远,符合植物的分类学特征。
2.3 CmF3′Ha基因表达分析
以菊花ClUBI基因为内参,对CQ17及其突变体CQ17-mu不同开放度花瓣中CmF3′Ha基因的表达情况进行分析,结果表明(图5),CmF3′Ha基因在4个样本中均有表达,并且盛开期花瓣中该基因的表达显著低于未开放时期花瓣;同一时期花瓣CQ17-mu的表达显著高于CQ17,表明CmF3′Ha基因可能参与了突变体中紫色条斑部位花瓣呈色色素的合成。
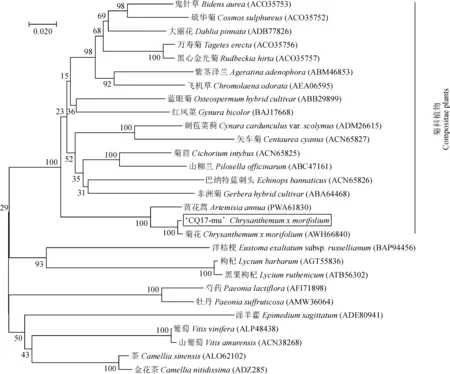
图4 基于F3′H同源蛋白的不同物种系统进化树Fig.4 Phylogenetic tree of different species based on F3′H homologous proteins

CK1、CK2分别为菊花CQ17完全展开时和未展开时花瓣;S1、S2分别为突变体CQ17-mu完全展开时和未展开时花瓣;不同的小写字母表示F3′H基因在花瓣中表达量的差异显著性(P<0.05)图5 F3′H基因在粉色菊花与彩斑菊花不同时期花中的相对表达CK1 and CK2 were petals of C. morifolium CQ17 when fully unfolded and not unfolded, respectively; S1 and S2 were petals of mutant CQ17-mu when fully expanded and not expanded, respectively; The different normal letters indicate F3′H gene expression in petals was significant (P < 0.05)Fig.5 Relative expression of F3′H gene in different stages of pink C. morifolium and color spot C. morifolium
2.4 CmF3′Ha基因启动子的克隆与分析
以彩斑菊花CQ17-mu的DNA为模板,采用染色体步移技术,克隆获得了CmF3′Ha基因的上游启动子序列1 086 bp(图6)。经Plant Care分析显示,该启动子片段中除含有启动子核心元件TATA-box和顺式元件CAAT-box外,还含有多个MYB、MYC类转录因子识别的顺式元件和光响应相关的元件,如Box 4、G-box、GT1-motif、TCT-motif,以及多个与激素相关的元件,如脱落酸响应元件ABRE,MeJA反应顺式调控元件CGTCA-motif、TGACG-motif,植物生长素反应元件TGA-element等(表2)。
3 讨 论
F3′H作为花青素矢车菊途径的决定基因,其表达与植物花青素的积累密切相关。在蝴蝶兰(Phalaenopsisspp.)中,红色蝴蝶兰F3′H的表达量是黄色品种的19倍[10];在黑稻(Oryzasativa)中,无F3′H基因的‘矮血糯’的花青素含量显著低于其他的黑稻品种[11]。因此,可认为F3′H的表达量越高,合成的花青素越多,从而导致植物该部位的颜色越深。在本研究中,未开放的小花相比盛开期小花颜色较深,而其CmF3′Ha基因的表达水平亦是盛开期的12.43~59.14倍,表明菊花CmF3′Ha表达量越高,花瓣颜色越深,推断CmF3′Ha的表达与植物花青素的积累呈正相关。相对于CQ17,彩斑菊花花瓣中CmF3′Ha基因的表达也提高了0.56~8.57倍,与前期的代谢组分析得出紫色条斑呈色物质为矢车菊类花青素的结果相对应,进一步说明了CmF3′Ha基因与植物花青素的积累直接相关,在彩斑菊花CQ17-mu中参与了紫色条斑部分的花青素代谢过程。正反义遗传学研究结果进一步表明,植物F3′H基因与花青素合成有关。橡胶树(Heveabrasiliensis)叶片中F3′H1基因的表达量随着叶片颜色的淡化明显下降,且过表达的F3′H1基因促使转基因烟草(Nicotianatabacum)花瓣中的花青素含量增加,进而使其颜色加深,说明了F3′H1基因可促进花青素合成,使植物颜色加深[12]。菊花中F3′H基因的抑制表达,使其花色变浅,花青素含量降低,证明了菊花F3′H具有相似的功能[13]。在本研究中,CmF3′Ha与其他植物F3′H蛋白高度同源,预示彩斑菊花CmF3′Ha基因的功能也具有一定的相似性,与CmF3′Ha基因表达分析得出的结论相符。

M.DL2000;1、3、5、7. 第三轮PCR产物,引物分别为AP4+SP3、AP3+SP3、AP2+SP3和AP1+SP3;2、4、6、8. 第二轮PCR产物, 引物分别为AP4+SP2、AP3+SP2、 AP2+SP2和AP1+SP2图6 彩斑菊花F3′H启动子的克隆M.DL2000; 1, 3, 5 and 7. The third round of PCR, the primers were AP4 + SP3, AP3 + SP3, AP2 + SP3 and AP1 + SP3, respectively; 2, 4, 6 and 8. The second round of PCR, the primers were AP4 + SP2, AP3 + SP2, AP2 + SP2 and AP1 + SP2, respectivelyFig. 6 Cloning of F3′H promoter from color spot C. morifolium
F3′H基因的表达受多种内外因素的调控。目前,已知MYB转录因子是植物花青素合成结构基因的重要调控因子。MYB表达量的降低会引起LDOX、DFR、F3′H等基因的表达下调[14]。有研究报道,在MYB23过表达的拟南芥(Arabidopsisthaliana)株系中,F3′H、DFR、CHI等基因的表达量显著升高,使种皮颜色加深[15];同时,MYB10基因也可对F3′H基因进行调控,使其表达上调[16]。本研究中,通过对彩斑菊花CQ17-muCmF3′Ha基因启动子序列的预测分析,发现CmF3′Ha基因启动子序列存在多个MYB类转录因子识别的顺式元件,根据前人研究,可推断CmF3′Ha基因的表达受MYB类转录因子的调控。此外,CmF3′Ha基因启动子序列还存在多个与光响应、激素调控等相关的元件,说明该基因的表达还可能受光照的影响以及生长素、茉莉酸甲酯、脱落酸等激素的调控。目前,已有相关文献对其进行报道,如对南极苔藓(Antarcticmoss)F3′H基因鉴定时发现,该基因的表达受低温、干旱、盐分、UV-B辐射以及植物激素等多种非生物胁迫的影响[17];F3′H基因在水杨酸处理下表达量增加,而在赤霉素、茉莉酸甲酯、脱落酸、吲哚乙酸等激素处理下表达量降低[18];在水稻(Oryzasativa)类黄酮合成关键基因的研究中发现,F3′H基因的表达还受光照的诱导[19]。另外,F3′H基因可增强酶活性,提高植物抵御外界侵害的能力[20]。在低温胁迫下,大豆(Glycinemax)中F3′H基因的转录水平明显上调,提高了植物的抗寒能力[21]。在UV-B、脱水和盐分胁迫下,番红花(Crocussativus)中F3′H基因的表达量明显增加,叶绿素和可溶性糖含量增加,MDA含量降低,使番红花对环境胁迫的耐受性增强[22]。关于彩斑菊花CmF3′Ha基因的功能研究还有待进一步探索。

表2 彩斑菊花F3′H基因启动子元件分析
