黄瓜叶绿素降解关键酶基因CsPAO的克隆与分析
2021-11-09程奕秋刘伟康陈广玲
程奕秋,刘伟康,陈广玲,孙 锦
(南京农业大学 园艺学院,南京 210095)
叶绿素(chlorophyll, Chl)所进行的光合作用是自然界一切生命的基础和源泉,对植物生长及农业产量的形成具有极其重要的作用。叶绿素是自然界最重要的光合色素之一,植物中的叶绿素主要为叶绿素 a 和叶绿素 b,以激发形式将光子能量转变成化学能。叶绿素降解是衰老叶片与成熟果实中绿色消失的深层原因[1]。许多生物和非生物胁迫均可促进植物叶绿素降解,如高温[2]、低温[3]、强光[4]以及黑暗[5]都可能引发叶绿素的降解。叶绿素降解包括叶绿素的氧化降解和酶降解两个方面[6]。其中,氧化降解与活性氧的产生和猝灭有关,酶降解途径目前比较认可的是PAO途径,而脱镁叶绿素脱镁叶绿酸水解酶(pheophytin pheophorbide hydrolase,PPH)和脱镁叶绿酸 a 加氧酶(pheophorbide a oxygenase,PAO)是叶绿素降解代谢的关键酶[7-9]。
脱镁叶绿酸氧化酸基因(CsPAO)编码位于叶绿体的内囊体膜上的非亚铁单加氧酶,该酶具有高度的底物特异性,能专一地催化脱镁叶绿酸 a氧化生成红色叶绿素代谢产物(red chlorophylcatabo-lite,RCC)。目前,已在玉米、拟南芥、油菜、番茄、大豆、水稻、小麦、杧果等多种植物[10-15]中克隆出PAO基因。PAO基因是保守基因,存在一个 Rieske 型 (Rieske-type) 结构域与一个单核铁结合(cmononucleariron-binding) 结构域,它们在N-末端含有保守的叶绿体转运肽序列,在C-末端含有跨膜结构域。PAO基因在玉米中为致死叶斑点基因 (ethal leaf spot 1,Lls1)[13],在拟南芥中为加快细胞死亡基因 (celerated celldeath 1, Acd7)[14],而油菜中存在2个PAO基因分别为BnPAO1和BnPAO2,BnPAO1只有在种子发育的早期能够被检测,而BnPAO2则整个发育的过程中都能被检测到[15]。由此可见,PAO基因在不同的植物里作用方式不同。PAO缺失突变体和反义表达,都出现未成熟细胞坏死现象,在这些株系中,有高浓度的脱镁叶绿酸a堆积,而植物脱镁叶绿酸a具有光毒性,在光照下会导致细胞凋亡[16]。
黄瓜(CucumissativusL.)是一种世界性的重要蔬菜作物,也是设施栽培中的主栽蔬菜种类之一,其栽培面积大,经济效益好。而在不利环境下黄瓜叶片早衰,叶绿素降解,光合作用降低,严重影响黄瓜生长发育。作为叶绿素降解关键基因,挖掘脱镁叶绿酸氧化酶基因(CsPAO)中与黄瓜成熟后期叶绿素组分含量的有利变异位点对解析黄瓜叶片衰老具有重要意义。本试验通过研究黄瓜叶绿素降解关键酶(pheophorbide a oxygenase)基因CsPAO的表达模式,分析该基因在根、茎、叶、花、萼、须、果等不同组织中的特异性表达,重点分析在黑暗、温度、SA等处理下该基因的表达特征,以期对阐述黄瓜叶绿素降解的分子机制提供参考。
1 材料和方法
1.1 材 料
本试验采用‘津春2号’黄瓜为材料,种子购自市场。该品种是天津市黄瓜研究所培养的第一代杂交品种,具有播种范围广,产量高,植株生长势强,叶片较大而厚实,叶色深绿等特点。选取饱满、整齐一致的种子,经温汤浸种后置于 30 ℃催芽箱黑暗放置 24 h,选取长势良好,出芽一致的种子播于石英砂育苗穴盘中。温度控制在 20~25 ℃/15~18 ℃(昼/夜),相对湿度 60%~70%,自然光照射。
在幼苗长到二叶一心时定植于花盆中。定植后缓苗 3 d,待黄瓜幼苗生长到三叶一心时,将一部分幼苗分为5组,分别对叶面喷施摩尔浓度为100 μmol /L的ABA、GA3、JA、SA和等量清水,以喷施清水为对照。同时,另外一部分幼苗进行非生物胁迫处理:1)黑暗处理,将黄瓜幼苗置于黑暗环境中,保持温度在 20~25 ℃/15~18 ℃(昼/夜),相对湿度 60%~70%;2)低温处理,将黄瓜幼苗置于4 ℃的光照培养箱内,保持相对湿度 60%~70%;3)高温处理,将幼苗置于42 ℃的光照培养箱内,保持相对湿度 60%~70%。
试验采用随机排列,并进行3次重复,每个处理9株。分别于上述处理0.5、1、3、6、12和24 h取样,将同一处理的每一盆各取第3片展开的功能叶(自上而下数),去掉叶脉和叶片边缘,混合均匀,取约0.1 g叶片放入试管,并加2颗研磨珠。样品迅速置于液氮,带至实验室低温冰箱(-80 ℃)保存待用。同时分别取对照黄瓜幼苗的根、茎、叶、花、萼、须、果等不同组织,一并保存于低温冰箱备用。
1.2 方 法
1.2.1 引物设计在葫芦科作物基因组数据库(http://www.cucurbitgenomics.org/)搜索关键词Pheophorbidea oxygenase,找到相应的基因CsaV3_1G014120,得到CsPAO基因CDS区的序列,再通过软件Primer5设计合适的引物,RT-PAO-F和RT-PAO-R用于实时荧光定量PCR,PAO-F和PAO-R用于克隆全长。Actin作为内参基因,设计引物Actin-F和Actin-R进行qRT-PCR(表1)。
1.2.2 总RNA提取及反转录将之前取好并保存于低温冰箱中的样品取出,将其放入研磨机中研磨成细粉,期间要不断加入液氮防止样品解冻。之后进行RNA提取,黄瓜叶片的提取参照Tiangen公司的RNAsimple Total RNA Kit试剂盒说明书进行。提取RNA的过程中注意经常更换手套,使用无RNase的塑料制品和枪头防止污染使RNA产量下降。提取出总RNA后,用Nanodrop 2000c测定总RNA的纯度和质量浓度并进行标记。参照TaKaRa公司的AMV反转录试剂盒(PrimeScriptTMⅡ 1st Strand cDNA Synthesis Kit)说明书合成cDNA。
1.2.3CsPAO基因CDS全长序列的获得以1.2.2中逆转录的cDNA为模板进行全长扩增,扩增体系为20 μL:Premix Taq (Ex Taq Version 2.0 plus dye) 10 μL,上下游引物各1 μL,cDNA 模板1 μL,ddH2O 7 μL。扩增程序为:95 ℃预变性5 min;95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸1 min,34个循环;72 ℃延伸5 min。将获得的PCR产物用1%琼脂糖凝胶电泳法检测目的片段。
1.2.4 实时荧光定量PCR以获得的cDNA为模板,以黄瓜Actin为内参基因,参照诺唯赞公司的ChamQ Universal SYBR qPCR Master Mix说明书进行qRT-PCR分析,20 μL反应体系包含10 μLSYBR qPCR Master Mix、2 μL cDNA、0.8 μL+0.8 μL上下游引物、0.4 μL ROX和6 μL ddH2O。反应程序设置如下:95 ℃预变性30 s,95 ℃ 10 s、60 ℃ 30 s循环反应40次;95 ℃ 15 s、60 ℃ 60 s、95 ℃ 15 s采集溶解曲线。试验重复3次,采用2-ΔΔCT方法计算基因的相对表达量。运用SPSS软件(IBM SPSS statistics 17.0)进行统计学分析,采用3次重复的平均值和标准误数据,用软件Origin作柱状图。

表1 引物名称及序列
1.2.5 生物信息学分析应用NCBI(https://www.ncbi.nlm.nih.gov/)对CsPAO基因全长进行翻译获得其所编码的蛋白序列,利用blastp找到和黄瓜CsPAO蛋白序列相近的序列,选取最相近的10种植物,用DNAMAN 6.0 软件进行多序列比较。用 NCBI 的 Protein Blast 软件获取CsPAO蛋白的保守区,可以得到其保守结构域。然后用MEGA 7软件绘制系统进化树。利用ProtParam tool(https://web.expasy. org/protparam/)软件得到CsPAO 蛋白中每种氨基酸的含量、分子质量、等电点,同时借助于 ProtScale(http://web.expasy.org/protscale/)软件分析了CsPAO蛋白的氨基酸的亲水性和疏水性。利用PredictProtein(http://www.predictprotein.org/)进行CsPAO 蛋白质的二级结构预测。借助于 SWISS-MODE(http://swissmodel. expasy.org/interactive)软件预测了黄瓜CsPAO蛋白的三级结构。
1.2.6 亚细胞定位将1.2.3中获得的PCR产物用1%琼脂糖凝胶电泳法检测目的片段,并进行目的片段的回收,采用 TaKaRa 公司的凝胶回收试剂盒回收。将胶回收产物与载体进行重组连接,并将重组产物转化到大肠肝菌DH5α感受态细胞,活化后涂布于含有卡那霉素(50 mg·L-1)的LB固态培养基上,过夜培养进行单克隆菌液PCR验证后,挑选阳性克隆子进行测序。测序正确后提取重组质粒,采用热激法将重组质粒转入农杆菌,用农杆菌介导法侵染烟草叶片并进行CsPAO蛋白亚细胞定位观察。
2 结果与分析
2.1 CsPAO基因的克隆
以PAO-F和PAO-R为上下游引物,用RT-PCR技术扩增得到1 638 bp目的片段(图1),其编码545个氨基酸。
2.2 CsPAO基因对激素的响应
荧光定量 PCR 分析表明(图2),CsPAO响应GA3、SA和JA激素调控。GA3处理下CsPAO表达量表现出先下降后上升再下降的趋势,下降后的表达量显著低于对照,结论与赤霉素[17]可以通过抑制CsPAO基因表达的结论相一致。SA处理下黄瓜CsPAO基因表达呈现出逐步上升的趋势,在24 h表达量达到最高值,说明SA激素通过提高CsPAO基因表达来加速叶绿素降解。值得注意的是,在JA处理下CsPAO基因表达呈现出先升高后降低的趋势,而ABA对CsPAO表达没有影响,暗示植物体内不同激素之间相互协调和平衡,以调控叶绿素的降解及植株衰老,如细胞分裂素、IAA、赤霉素及多胺等激素具有延缓叶绿素降解、延迟衰老的功能, 而乙烯、脱落酸、JA等植物激素具有促进叶绿素降解、加速衰老的功能,IAA与脱落酸相拮抗,赤霉素则可以促进 IAA的作用。因此,叶绿素降解可能是不同激素之间的互作的结果。
2.3 CsPAO基因对非生物胁迫的响应
由图2可见,高温和低温胁迫条件下,CsPAO基因在12 h内并没有明显变化,胁迫24 h 后CsPAO基因表达量显著升高并达到最高值;黑暗胁迫下,与对照相比表达变化没有显著差异,表明CsPAO基因不受黑暗的诱导。本试验结果表明,黄瓜在高温处理和低温处理下CsPAO的表达量显著上升,同高温[2]或低温[3]可能引发叶绿素降解的报道一致,但本试验中黑暗处理对CsPAO基因表达没有影响,这与黑暗[5]可能引发叶绿素的降解的结论相悖,具体原因还有待进一步研究分析。

M. DL2000; 1. cDNA图1 CsPAO基因PCR扩增结果Fig.1 PCR amplification result of CsPAO gene
2.4 CsPAO基因的组织表达特性
实时定量PCR分析CsPAO基因在不同组织中的表达(图3),结果表明CsPAO基因在根、茎、叶、花、萼、须、果中均有表达,但在花器官中的表达量最高。可能的原因是花的存在时间短、代谢速度快,提高了CsPAO基因的表达量。

图3 CsPAO的组织表达Fig.3 Expression levels of CsPAO in different tissues

不同小写字母表示同一处理不同时间0.05水平差异显著图2 不同激素和逆境胁迫下CsPAO的相对表达量Different normal letters represent significant differences under different time points with same treatment at 0.05 levelFig.2 The relative expression of CsPAO under different hormones and environmental stresses

Ⅰ.黄瓜;Ⅱ.苦瓜;Ⅲ.南瓜;Ⅳ.笋瓜;Ⅴ.西葫芦;Ⅵ.枣;Ⅶ.山麻黄;Ⅷ.温州蜜柑;Ⅸ.胡桃;Ⅹ.甜橙;Ⅺ.枫香树;Ⅻ.拟南芥;.欧洲油菜;烟草;XV.玉米图4 16种植物的PAO蛋白的序列对比Ⅰ. Cucumis sativus; Ⅱ. Momordica charantia; Ⅲ. Cucurbita moschata; Ⅳ. Cucurbita maxima; Ⅴ. Cucurbita pepo subsp. pepo; Ⅵ. Ziziphus jujuba; Ⅶ. Trema orientale; Ⅷ. Citrus unshiu; Ⅸ. Juglans regia; Ⅹ. Citrus sinensis; Ⅺ. Liquidambar formosana; Ⅻ. Arabidopsis thaliana; . Brassica napus; . Nicotiana tabacum; XV. Zea maysFig.4 Sequence comparison of PAO proteins of 16 kinds of plants
2.5 黄瓜CsPAO基因编码蛋白的生物信息学分析
2.5.1 CsPAO蛋白的基序分析用 NCBI 的 Protein Blast 软件获取CsPAO蛋白的保守区,可以得到其保守结构域。结果表明,CsPAO蛋白含有 PLN02518(Pheophorbide a oxygenase)、Rieske_RO_Alpha_CsPAO[Rieske non-heme iron oxygenase (RO) family]、HcaE (Phenylpropionate dioxygenase or related ring-hydroxylating dioxygenase)、Rieske[Rieske (2Fe-2S) domain]和nirD_assim_sml{nitrite reductase [NAD(P)H]}等结构域。
2.5.2 氨基酸序列比对及系统进化分析利用 NCBI 数据库对黄瓜CsPAO(Cucumissativus, XP_031740836.1)氨基酸同源序列进行了检索和比对,发现其与同属于葫芦科黄瓜属的甜瓜(Cucumismelo, XP_008462467.1)相似度最高,达到了95.6%。与同属于葫芦科的冬瓜(Benincasahispida, XP_038894382.1)、南瓜(Cucurbitamoschata, XP_022964963.1)、西葫芦(Cucurbitapepo, XP_023519435.1)、苦瓜(Momordicacharantia, XP_022152935.1)、笋瓜(Cucurbitamaxima, XP_022970307.1) 相似度较高,分别为94.13%、92.11%、91.94%、91.77%和91.56%。通过DNAMAN6.0软件中的多重比对功能,对黄瓜CsPAO蛋白的氨基酸序列与其他15个物种的氨基酸序列进行多序列比对(图4),结果显示,PAO氨基酸中间区域保守性较高,两端的氨基酸序列差异较大。通过MEGA 7软件对系统进化树进行分析,构建了黄瓜与其他15个物种的PAO氨基酸序列系统发育进化树(图5),结果显示,PAO的进化基本符合植物分类学地位,且具有明显的种属特性。同为黄瓜属的甜瓜、黄瓜聚为一组,同为葫芦科植物PAO聚类较近,特别是与冬瓜、苦瓜、西葫芦、南瓜、笋瓜等植物PAO蛋白相似度较高,而与玉米、欧洲油菜、拟南芥等植物相距较远。

图5 16种植物基因的PAO蛋白序列的系统发育关系Fig.5 Phylogenetic relationship of PAO protein sequences of 16 plant genes
2.5.3 CsPAO蛋白的理化特性和亲/疏水性分析借助于ProtParam得到CsPAO基因编码氨基酸545个,其中丝氨酸(Ser)、亮氨酸(Leu)的含量最高,分别为9.7%和8.3%,理论等电点为6.09,其蛋白相对分子质量为61.02 kD,分子式C2746H4195N745O800S18。CsPAO蛋白不稳定指数为40.40,归类为不稳定蛋白。同时利用ProtScale在线分析了CsPAO蛋白的氨基酸的亲疏水性,发现构成CsPAO蛋白的所有氨基酸的亲水性(负值)和疏水性(正值)均分布在 -2.833~2.700,为亲水性氨基酸。
2.5.4 CsPAO蛋白结构及亚细胞定位的预测利用PredictProtein进行CsPAO蛋白质的二级结构预测,结果表明在CsPAO中α-螺旋占20.37%,β-折叠占12.11%,无规则卷曲占67.51%。同时预测到CsPAO具有2个蛋白结合位点,存在跨膜现象,亚细胞定位预测CsPAO蛋白定位于叶绿体膜。借助于 SWISS-MODE对黄瓜CsPAO蛋白的三级结构进行预测,预测出两种三级结构模型(图6)。
2.6 CsPAO蛋白的亚细胞定位
将构建好含有CsPAO与GFP融合蛋白载体的农杆菌注射到烟草叶片,将侵染后的烟草置于光/暗时间为16 h/8 h、光/暗温度为22 ℃/18 ℃条件下培养3 d后,使用激光共聚焦显微镜观察,分析CsPAO蛋白的定位情况。结果显示(图7):导入含目的基因CsPAO融合蛋白的烟草细胞,仅在叶绿体中呈现明显的绿色荧光信号(图7,B),进而验证了CsPAO蛋白定位于叶绿体,这与PredictProtein在线网站对CsPAO蛋白亚细胞定位的预测结果相一致。
3 讨 论
叶绿素降解是植物体重要的生理活动,高温[2]、强光[4]、干旱、活性氧代谢[18]等内外因子对叶绿素降解代谢都会产生影响。脱镁叶绿酸 a 加氧酶(pheophorbide a oxygenase,CsPAO)是叶绿素降解代谢的关键酶。在对拟南芥[19]和辣椒[20]的研究中发现,CsPAO蛋白结构的破坏,会使乙烯诱导衰老过程中叶绿素含量的减少。同时研究发现叶绿体基粒内囊体膜上CsPAO蛋白活性缺失可以导致部分植物滞绿。此外,一些植物激素如赤霉素[17]、细胞分裂素[21]、茉莉酸[22]、茉莉酸甲酯[23]等都可以通过抑制CsPAO基因的表达,从而延迟了叶绿素含量的降低。这些结果显示CsPAO基因参与调控多种不同植物中叶绿素降解代谢。

图6 CsPAO 蛋白的三级结构预测结果Fig.6 Prediction results of tertiary structure of CsPAO protein
前人大量的研究结果已经表明CsPAO基因能受到多种胁迫环境的诱导,甚至会受到多种激素如GA3[20]、ABA[24]乃至活性氧[17]等信号分子的响应。同时还发现不同的诱导因子对该基因的调控各有差异,不同物种的CsPAO基因在相同诱导因子作用下的表达模式也有所不同[14-16]。尽管前人已经成功分离并克隆许多物种的CsPAO基因,并对其表达模式进行了初步探究,但是有关CsPAO基因在逆境胁迫下的具体作用机制则鲜有报道。我们的研究发现高温和低温胁迫能显著诱导黄瓜CsPAO基因表达上调,表明黄瓜CsPAO蛋白在响应胁迫时可能发挥着重要作用。另外本试验与同类研究相比增加了时间维度,处理结果不是简单地与清水对照进行对比,试图弄清环境胁迫和激素处理下,CsPAO基因的表达量随时间变化产生的响应。通过qRT-PCR分析,我们进一步发现GA3和JA处理能更快地诱导黄瓜CsPAO基因的表达,表明CsPAO基因参与胁迫响应亦会引起某些信号分子的调控,总之,CsPAO基因在逆境中会发挥重要作用,且该基因的调控网络较为复杂,有必要对其功能进行深入探究。
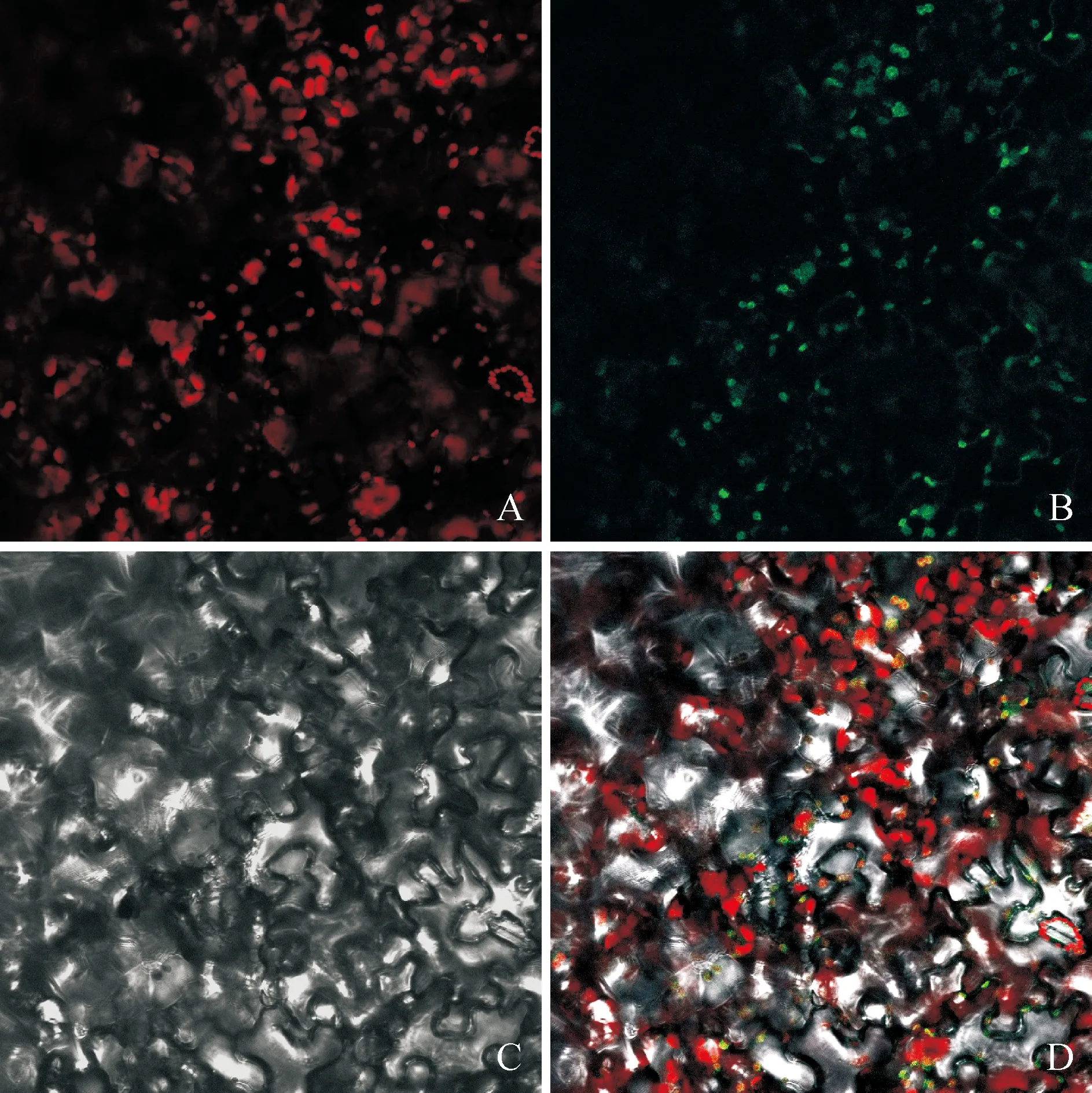
A为叶绿体自发荧光图;B为GFP荧光激发图;C为明场图;D为叠加图图7 CsPAO蛋白的亚细胞定位A was shot in fluorescent field of the chloroplast autofluorescence; B was shot in fluorescent field of the GFP; C was shot in bright field; D was shot in merged fieldFig.7 Subcellular localization of CsPAO protein
对黄瓜CsPAO蛋白的结构和功能进行预测的结果表明,CsPAO蛋白不稳定,含跨膜结构域预测该蛋白在叶绿体膜上发挥作用。此外,通过同源建模的方法,建立了黄瓜CsPAO的三维结构,为进一步鉴定其功能奠定了基础。之后可以通过构建融合蛋白载体,在激光扫描共聚焦显微镜的激光照射下GFP蛋白会发出绿色荧光,从而可以精确地定位蛋白质的位置。还可以通过构建黄瓜CsPAO基因沉默载体和过表达载体,来沉默或过表达CsPAO基因,或者利用CRISPR-Cas9基因编辑技术来敲除CsPAO基因,以进一步研究CsPAO基因在黄瓜叶片叶绿素降解中所起的作用。
