中药基于Wnt/β-catenin信号通路治疗膝骨性关节炎的研究进展
2021-11-08李远栋刘爱峰卜寒梅王俊龙张君涛
李远栋,杨 琨,王 平,刘爱峰,张 超,卜寒梅,王俊龙,张君涛
中药基于Wnt/β-catenin信号通路治疗膝骨性关节炎的研究进展
李远栋,杨 琨#,王 平,刘爱峰,张 超,卜寒梅,王俊龙,张君涛*
天津中医药大学第一附属医院 国家中医药管理局区域中医骨伤科诊疗中心,国家中医针灸临床医学研究中心,天津 300381
膝骨性关节炎(knee osteoarthritis,KOA)是一种以关节软骨被破坏及软骨下骨重塑为主要病理改变的退行性骨关节疾病,主要表现为膝关节的疼痛与功能受限,严重影响患者的生活质量,对患者及社会产生巨大的医疗负担。至今其发病机制尚不完全清楚。Wnt信号转导的活化与KOA发病机制密切相关,而当前对Wnt信号通路的研究侧重于Wnt/β-连环蛋白(Wnt/β-catenin)信号通路及其激活或抑制蛋白的表达。近年来,利用中药通过调控Wnt/β-catenin信号通路治疗KOA的机制被大量研究。综述近年来中药单体及中药复方调控Wnt/β-catenin信号通路治疗KOA的成果,进一步为临床运用中药治疗KOA提供相关基础研究。
中药;补骨脂素;青蒿素;薯蓣皂苷;大黄素;膝骨性关节炎;Wnt/β-catenin信号通路;作用机制
膝骨性关节炎(knee osteoarthritis,KOA)是以关节软骨的进行性降解、软骨下骨的改变、关节边缘的骨赘形成、滑膜组织的炎症和增生、韧带及半月板变性和关节囊肥大为主要病理变化的骨关节疾病[1]。主要表现为膝关节的疼痛、僵硬、肿胀及关节功能障碍等症状,严重影响患者的生活质量。调查显示,KOA约占骨性关节炎(osteoarthritis,OA)的85%,在世界60岁以上的人口中,约18%的女性和9.6%的男性患有KOA的症状[2]。KOA的发病机制尚不能完全阐明,但研究发现关节软骨细胞的凋亡与OA的退变程度明显相关(图1)[3-4]。经典Wnt/β-连环蛋白(Wnt/β-catenin)信号通路在细胞增殖调控中具有重要意义,它以不同的方式调节不同阶段的软骨形成,Wnt蛋白的表达与关节软骨的退变有密切的关系(图2)[5],在KOA的病理生理中起着至关重要的作用[6]。

a-健康关节 b-骨关节炎 IL-白细胞介素 ADAMTS-解聚素与金属蛋白酶 MMP-基质金属蛋白酶 TNFα-肿瘤坏死因子α IFN-γ-γ干扰IGF-1-胰岛素样生长因子-1 TGF-β-转化生长因子-β
a-healthy joint b-osteoarthritis IL-interleukin ADAMTS-a disintegrin and metalloproteinase with thrombospondin motif MMP-matrix metalloproteinase TNF-α-tumor necrosis factor α IFN-γ-interferon-γ IGF-1-insulin-like growth factor-1 TGF-β-transforming growth factor β
图1 KOA的发病机制
Fig. 1 Pathogenesis of KOA

a-组织学变化 b-关节软骨Wnt和Wnt相关分子表达 WISP-1-Wnt诱导的分泌型蛋白-1 MMP-基质金属蛋白酶 SOST-硬化蛋白 FRP-卷曲相关蛋白 FRZB-骨骼发育相关卷曲蛋白 SFRP-分泌型卷曲相关蛋白
KOA为中医学中“痹证”“骨痹”“骨痿”等病证范畴。中药治疗KOA具有独特的临床优势,并且中药单体有效成分及复方治疗KOA的作用机制已成为研究的热点,许多研究者从中药单体、提取物及复方作用于Wnt/β-catenin信号通路方面进行了广泛探索。本文主要从Wnt/β-catenin信号通路的特性及其与KOA之间的关系及中药单体与中药复方调控Wnt/β-catenin信号通路治疗KOA机制方面进行综述。
1 Wnt/β-catenin信号通路溯源与特性
Wnts是人类中至少19种不同分泌蛋白的家族,它们影响着大量的生物过程[7]。20世纪末,Nusse和Varmus于果蝇胚胎中发现基因,随后发现鼠乳腺瘤病毒整合位点中发现的基因与基因同源,遂命名基因家族,而其中的Wnt/β-catenin信号通路是研究者的研究热点。
β-catenin分布于细胞膜、细胞质和细胞核中,其在细胞增殖、迁移和分化等多种细胞事件中扮演至关重要的作用。Wnt配体与细胞膜受体蛋白卷曲蛋白(frizzled,Frz)和低密度脂蛋白受体相关蛋白能够激活Wnt信号,细胞内轴蛋白(axis inhibitor,Axin)作为一个支架蛋白,可以结合多种降解复合物的蛋白质成分,调节细胞内β-catenin水平。Wnt对糖原合成激酶-3β(glycogen synthase kinase,GSK-3β)有抑制作用,GSK-3β磷酸化可减少β-catenin的降解。因而β-catenin在细胞质中聚集增多,之后被转运到细胞核[8-9],并与T细胞因子/淋巴增强因子等转录因子结合,诱导靶基因转录激活[10-11],如细胞周期蛋白D1(Cyclin D1),这是G1/S转变的积极效应,从而影响相关细胞的增殖分化、调控细胞凋亡和代谢。
2 Wnt/β-catenin信号通路与OA
OA是一种常见的软骨退行性改变的疾病,主要由过度的机械压力、炎症和免疫改变引起[12-13]。虽然还未有明确的发病机制,但多数研究者认为OA的发生是关节软骨细胞、软骨外基质、软骨下骨质的合成及降解的平衡被破坏所导致。随着生物化学和遗传学研究在过去10年中取得的巨大进展,OA发病机制中的信号分子和转录因子已经被发现[14]。典型的Wnt信号通路涉及OA的发病机制,其中,软骨与软骨下骨的改变被认为是OA发生的首要因素,并且研究发现典型的Wnt信号通路的激活有助于增加软骨下骨重塑和骨赘形成;同时,软骨与软骨下骨的病理变化影响着OA的发展进程[15-16]。软骨下骨的广泛重塑致使骨硬化的发生,软骨下终板增厚,虽然还不清楚这种软骨下骨硬化是如何导致OA,但研究证明Wnt信号参与并能够诱导骨硬化[17]。Dickkopf1蛋白(Dkk-1)是一种分泌蛋白,是与骨吸收密切相关的功能蛋白,在维持骨质平衡过程中有重要作用,且现已证实Dkk-1能够抑制Wnt信号传导,对OA软骨破坏产生保护作用,从而降低骨赘的严重程度来降低OA的进展[18-19]。Wnt/β-catenin信号通路对软骨细胞功能的表达至关重要,参与软骨细胞的分化与增殖,通过该通路抑制关节软骨退变的促进因子水平,维持着关节软骨的健康状态[20]。
研究表明,抑制大鼠软骨细胞Wnt/β-catenin信号通路可以降低MMP的表达,继而减轻软骨炎症[21]。Xuan等[22]研究发现Wnt/β-catenin信号通路可以调节小鼠成年关节软骨表面带中糖蛋白-4的表达,在关节软骨稳态中起重要作用。研究发现SM04690是一种Wnt通路的小分子抑制剂,具有作为疾病修饰OA慢作用药的潜力,可以诱导成骨基因表达下调,软骨基因表达上调,抑制蛋白酶产生及减少软骨降解,从而改善OA进展[23]。Chen等[24]发现通过调控Wnt/β-catenin信号通路可以调控Cyclin D1参与OA的发病过程。由此推断,调控Wnt/β-catenin信号通路可以维持软骨内的平衡状态,Wnt/β-catenin信号通路可能是一种治疗OA的理想选择。
3 中药基于Wnt/β-catenin信号通路治疗KOA
3.1 中药单体
中药治疗KOA多以补益肝肾为主,中药单体治疗KOA取得了良好的疗效,研究前景广阔。补骨脂是补骨脂Linn.的干燥成熟果实,补骨脂素是补骨脂的主要活性成分之一,常被用于治疗骨质疏松症、骨肉瘤、骨折和骨软化症,研究已证实补骨脂素可以在体内刺激局部新骨形成并触发骨的形成,可用于预防和治疗KOA,但影响软骨细胞增殖的确切分子机制仍有待阐明。Zheng等[25]研究表明补骨脂素以剂量和时间相关性地方式增强软骨细胞的活力,MTT实验和药敏实验表明补骨脂素可以通过调节Wnt/β-catenin信号通路促进软骨细胞增殖,并且还发现补骨脂素可以通过增加软骨基质主要成分II型胶原蛋白(type II collagen,Col-II)的表达,对防止软骨降解具有积极作用,证明补骨脂素是治疗KOA的潜在治疗剂。青蒿素是来源于黄花蒿Linn.的一种抗疟药,以其安全性和选择性杀死受伤细胞而闻名,有学者发现基于青蒿素的抗炎活性和抑制KOA相关的Wnt/β-catenin信号通路的作用,推测青蒿素可能对KOA有影响。Zhong等[26]则采用细胞活力测定、糖胺聚糖分泌、免疫荧光、定量逆转录-聚合酶链反应和western blotting等方法,研究青蒿素对白细胞介素(interleukin,IL)-1β诱导的KOA患者源性软骨细胞的保护作用和抗骨骼活性,发现青蒿素可以通过调节Wnt/β-catenin信号通路缓解IL-1β介导的炎症反应和KOA进展。薯蓣皂苷是从黄精Delar. ex Redoute根中提取的天然产物,已有研究证实薯蓣皂苷具有抗炎、调脂、抗癌、保肝等作用。Lu等[27]通过在大鼠关节内注射碘乙酸钠建立KOA模型,用Western blotting、定量逆转录-聚合酶链反应和组织学染色法检测薯蓣皂苷的作用,结果显示薯蓣皂苷能通过抑制内质网应激、氧化应激、细胞凋亡和炎症反应,发挥对软骨和细胞外基质(extracellular matrix,ECM)的保护作用。更重要的是,薯蓣皂苷能通过抑制Wnt/β-catenin信号通路和上调过氧化物酶体增殖物激活受体-γ的表达来改善KOA的进展,有望成为治疗KOA的一种新型天然药物,但还需要进一步的基础研究。大黄素(1,3,8-三羟基-6-甲基蒽醌)是一种从大黄Baill.的根和根茎中分离出来的天然蒽醌,被证明具有抗菌、抗癌和抗炎活性。此外,大黄素可抑制多种细胞类型的MMP-2和MMP-9表达。Ding等[28]通过采用大鼠前交叉韧带横断建立大鼠KOA的实验模型,关节内注射大黄素,观察大黄素的体内作用,结果显示大黄素可降低IL-1β诱导的核转录因子-κB(nuclear factor kappa-B,NF-κB)和Wnt信号的激活,从而改善KOA的进展。以上研究表明中药单体有效成分不仅可以通过Wnt信号抑制炎症反应,降低软骨退化速度,同时还可以促进软骨细胞的增殖分化,修复软骨损伤,这些成果对于研究中药单体有效成分对KOA进行靶向精准治疗具有临床指导意义。中药单体通过Wnt/β-catenin信号通路对KOA的调控作用见表1。
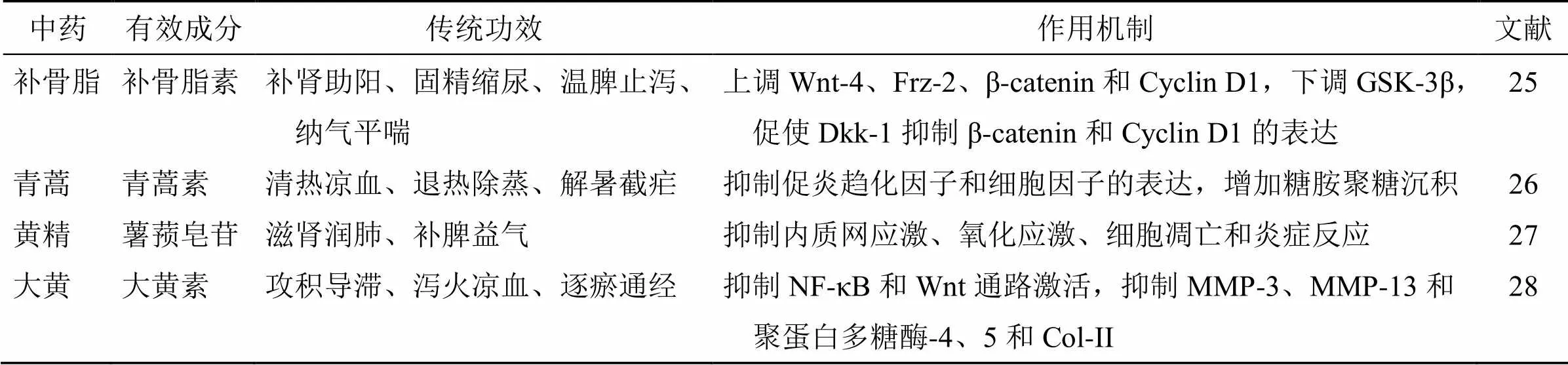
表1 中药单体通过Wnt/β-catenin信号通路对KOA的调控作用
3.2 中药复方
传统中药复方在治疗KOA中效果明显,通常采用活血通络、补肾益气的治疗方法,但中药复方制剂的药物成分较为复杂,其中药物有效成分和具体的作用机制还不明确。加味阳和汤常被用于治疗KOA,前期研究表明加味阳和汤具有保护软骨的作用,Xia等[29]通过加味阳和汤干预大鼠模型,测得促炎细胞因子IL-1β、IL-6和肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)水平降低,说明加味阳和汤能够通过Wnt/βcatenin信号通路降低IL-1β诱导的软骨细胞MMP-3、MMP-13及细胞凋亡蛋白酶-3、9(Caspase-3、9)水平,进而保护关节软骨。独活寄生汤因具有补肝肾、益气血、祛风湿和止痹痛之效,常用于治疗以关节肿胀、疼痛为主要临床症状的骨关节疾病,谭敏枝等[30]采用独活寄生汤对KOA大鼠进行关节腔注射,不仅可以改善KOA模型大鼠膝关节肿胀程度,而且血清中骨形态发生蛋白-2(bone morphogenetic protein,BMP-2)、MMP-3、MMP-9的表达水平也有不同程度降低,说明独活寄生汤可以下调Wnt/β-catenin信号通路,为独活寄生汤治疗KOA提供一定的研究借鉴意义。温经通络方以桂枝为君药,具有温经通络、散寒除湿、活血止痛之效,唐芳等[31]发现温经通络方干预大白兔KOA模型,测得β-catenin、GSK-3β蛋白表达水平显著降低,Axin表达水平显著升高,结果表明温经通络方可通过调控Axin水平负性调节Wnt/β-catenin信号通路,进而抑制软骨细胞中β-catenin和GSK-3β表达水平而达到治疗KOA的目的。盘龙七片具有消炎镇痛、通痹止痛、活血化瘀的作用,常被用于治疗肢体疼痛、麻木等症状,朱鹏等[32]通过选用SPF级8周龄雄性SD大鼠构建KOA大鼠模型,发现盘龙七片组TNF-α、IL-1β、MMP-13显著降低,可能通过抑制Wnt信号通路活性以缓解KOA症状。七厘散主要由秦皮、川贝母、除虫菊酯和龙骨组成,对于OA的疗效较佳。宋寒冰等[33]通过建立KOA兔模型,制备七厘散含药血清,实验表明七厘散可以减轻KOA模型兔软骨的损伤程度,这种改善作用可能与增加核心结合因子(runt related transcription factor,)、骨钙素(osteocalcin,)基因的表达水平以及激活Wnt/β-catenin信号通路促进骨髓间充质干细胞的增殖和成骨分化有关。有学者已发现雌激素可调控Wnt/β-catenin信号通路[34],谭志韵等[35]通过研究发现经切除卵巢以及关节注射的KOA模型组中,Wnt-4、β-catenin表达上升,GSK-3β表达下降,表明此模型中大鼠雌激素的降低可能激活了Wnt通路,在予以加味二仙颗粒干预后,Wnt/β-catenin信号通路激活被抑制,软骨ECM降解和软骨细胞凋亡受到影响,软骨得以保护,KOA得到有效缓解。郭洁梅等[36]对模型大鼠ig壮骨健膝方,研究表明壮骨健膝方可能通过提高Dkk-1、分泌型卷曲相关蛋白-3(secreted frizzled-related protein 3,sFRP-3)蛋白的表达水平,抑制Wnt/β-catenin信号通路激活,从而对经IL-1β诱导退变的大鼠膝关节软骨细胞起保护作用,揭示了壮骨健膝方保护膝关节退变软骨细胞的可能分子机制,为该方的临床应用提供了进一步的实验依据。以上研究采用中药复方治疗KOA的动物模型均取得了良好的治疗效果,通过对Wnt信号的调控作用降低炎症因子,增强软骨的修复能力,为运用此类药物治疗KOA分子机制的研究奠定了一定的基础。中药复方通过Wnt/β-catenin信号通路对KOA的调控作用见表2。
4 结语与展望
目前,中药通过Wnt/β-catenin信号通路干预KOA相关机制的研究越来越多,无论是中药单体有效成分还是中药复方均可较好地保护软骨细胞,延缓疾病的发展,为临床治疗KOA提供新的思路。本文总结了基于Wnt/β-catenin信号通路的中药干预KOA的研究进展,目前中药治疗手段包括中药单体和中药复方;中药调节Wnt/β-catenin信号通路的途径包括上调Wnt蛋白及Wnt通路关键因子β-catenin促进软骨细胞增殖;下调Wnt蛋白及Wnt通路关键因子β-catenin,从而起到治疗KOA的作用。但目前虽然相关研究越来越多,仍存在一定的不足:中药对Wnt/β-catenin信号通路的双向调节作用还有待进一步研究;中药调控Wnt/β-catenin信号通路及与其他信号通路的交互作用在KOA中的详细机制还有待深入研究;中药单体和中药复方仅仅是部分机制研究,缺乏有效成分及其体内代谢产物具体的作用靶点及对准确作用剂量的量效研究。应对中药调控Wnt/β-catenin信号通路具体的有效作用成分及相应的靶点进行深入研究,为更加精准地治疗KOA提供参考,更好地发挥中药治疗KOA的优势。
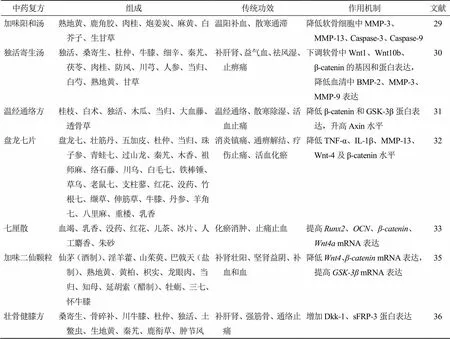
表2 中药复方通过Wnt/β-catenin信号通路对KOA的调控作用
利益冲突 所有作者均声明不存在利益冲突
[1] Chen D, Shen J, Zhao W W,. Osteoarthritis: Toward a comprehensive understanding of pathological mechanism [J]., 2017, 5(1): 1-13.
[2] Woolf A D, Pfleger B. Burden of major musculoskeletal conditions [J]., 2003, 81(9): 646-656.
[3] Kuyinu E L, Narayanan G, Nair L S,. Animal models of osteoarthritis: Classification, update, and measurement of outcomes [J]., 2016, 11: 19.
[4] Glyn-Jones S, Palmer A J, Agricola R,. Osteoarthritis [J]., 2015, 386(9991): 376-387.
[5] Usami Y, Gunawardena A T, Iwamoto M,. Wnt signaling in cartilage development and diseases: Lessons from animal studies [J]., 2016, 96(2): 186-196.
[6] Sassi N, Laadhar L, Allouche M,. The roles of canonical and non-canonical Wnt signaling in human de-differentiated articular chondrocytes [J]., 2014, 89(1): 53-65.
[7] Lories R J, Monteagudo S. Review article: Is wnt signaling an attractive target for the treatment of osteoarthritis? [J]., 2020, 7(2): 259-270.
[8] Zeng X, Tamai K, Doble B,. A dual-kinase mechanism for Wnt co-receptor phosphorylation and activation [J]., 2005, 438(7069): 873-877.
[9] Doble B W, Patel S, Wood G A,. Functional redundancy of GSK-3α and GSK-3β in Wnt/β-catenin signaling shown by using an allelic series of embryonic stem cell lines [J]., 2007, 12(6): 957-971.
[10] Bougault C, Priam S, Houard X,. Protective role of frizzled-related protein B on matrix metalloproteinase induction in mouse chondrocytes [J]., 2014, 16(4): R137.
[11] MacDonald B T, Tamai K, He X. Wnt/β-catenin signaling: Components, mechanisms, and diseases [J]., 2009, 17(1): 9-26.
[12] Komori T. Molecular mechanism of Runx2-dependent bone development [J]., 2020, 43(2): 168-175.
[13] Huang J, Zhao L, Chen D. Growth factor signalling in osteoarthritis [J]., 2018, 36(5/6): 187-195.
[14] Nishimura R, Hata K, Nakamura E,. Transcriptional network systems in cartilage development and disease [J]., 2018, 149(4): 353-363.
[15] Monteagudo S, Lories R J. Cushioning the cartilage: A canonical Wnt restricting matter [J]., 2017, 13(11): 670-681.
[16] Funck-Brentano T, Bouaziz W, Marty C,. Dkk-1-mediated inhibition of Wnt signaling in bone ameliorates osteoarthritis in mice [J]., 2014, 66(11): 3028-3039.
[17] Blom A B, van Lent P L, van der Kraan P M,. To seek shelter from the WNT in osteoarthritis? WNT-signaling as a target for osteoarthritis therapy [J]., 2010, 11(5): 620-629.
[18] Oh H, Chun C H, Chun J S. Dkk-1 expression in chondrocytes inhibits experimental osteoarthritic cartilage destruction in mice [J]., 2012, 64(8): 2568-2578.
[19] Funck-Brentano T, Bouaziz W, Marty C,. Dkk-1-mediated inhibition of Wnt signaling in bone ameliorates osteoarthritis in mice [J]., 2014, 66(11): 3028-3039.
[20] Joiner D M, Less K D, van Wieren E M,. Heterozygosity for an inactivating mutation in low-density lipoprotein-related receptor 6 (Lrp6) increases osteoarthritis severity in mice after ligament andinjury [J]., 2013, 21(10): 1576-1585.
[21] Xu K, Ma C Y, Xu L H,. Polygalacic acid inhibits MMPs expression and osteoarthritis via Wnt/β-catenin and MAPK signal pathways suppression [J]., 2018, 63: 246-252.
[22] Xuan F J, Yano F, Mori D,. Wnt/β-catenin signaling contributes to articular cartilage homeostasis through lubricin induction in the superficial zone [J]., 2019, 21(1): 247.
[23] Wang Y D, Fan X H, Xing L,. Wnt signaling: A promising target for osteoarthritis therapy [J]., 2019, 17(1): 97.
[24] Chen Y Y, Chen Y, Wang W C,. Cyclin D1 regulates osteoarthritis chondrocyte apoptosisWNT3/β-catenin signalling [J]., 2019, 47(1): 1971-1977.
[25] Zheng W W, Lin P D, Ma Y H,. Psoralen promotes the expression of cyclin D1 in chondrocytes via the Wnt/β-catenin signaling pathway [J]., 2017, 40(5): 1377-1384.
[26] Zhong G, Liang R M, Yao J,. Artemisinin ameliorates osteoarthritis by inhibiting the Wnt/β-catenin signaling pathway [J]., 2018, 51(6): 2575-2590.
[27] Lu J W, Zhang T W, Sun H J,. Protective effects of dioscin against cartilage destruction in a monosodium iodoacetate (MIA)-indcued osteoarthritis rat model [J]., 2018, 108: 1029-1038.
[28] Ding Q H, Ye C Y, Chen E M,. Emodin ameliorates cartilage degradation in osteoarthritis by inhibiting NF-κB and Wnt/β-catenin signalingand[J]., 2018, 61: 222-230.
[29] Xia H, Cao D, Yang F,. Jiawei Yanghe decoction ameliorates cartilage degradationandvia Wnt/β-catenin signaling pathway [J]., 2020, 122: 109708.
[30] 谭敏枝, 刘俊. 独活寄生汤对膝骨关节炎模型大鼠Wnt/-catenin信号通路的作用研究 [J]. 湖北中医药大学学报, 2019, 21(5): 8-12.
[31] 唐芳, 马武开, 周静, 等. 温经通络方对兔膝骨关节软骨细胞中β-catenin、Axin及GSK-3β蛋白表达水平的影响 [J]. 中华中医药杂志, 2020, 35(4): 1747-1750.
[32] 朱鹏, 薛欣, 赵晨, 等. 盘龙七片对膝骨关节炎大鼠关节软骨的保护作用及对Wnt通路的调控机制 [J]. 西部医学, 2020, 32(8): 1110-1114.
[33] 宋寒冰, 刘家兴, 王革强, 等. 七厘散治疗兔膝骨关节炎及其相关分子机制研究 [J]. 陕西中医, 2021, 42(1): 18-22.
[34] Wang F S, Ko J Y, Lin C L,. Knocking down dickkopf-1 alleviates estrogen deficiency induction of bone loss. A histomorphological study in ovariectomized rats [J]., 2007, 40(2): 485-492.
[35] 谭志韵, 罗汉文, 涂泽松, 等. 基于Wnt/β-catenin信号通路探讨加味二仙颗粒治疗KOA的作用 [J]. 按摩与康复医学, 2021, 12(1): 85-88.
[36] 郭洁梅, 陈秀明, 陈鹏, 等. 壮骨健膝方含药血清对经IL-1β诱导的大鼠膝关节退变软骨细胞Wnt/β-catenin信号通路抑制因子蛋白表达的影响 [J]. 福建中医药, 2021, 52(2): 18-20.
Research progress on mechanism of traditional Chinese medicine against knee osteoarthritis based on Wnt/β-catenin signaling pathway
LI Yuan-dong, YANG Kun, WANG Ping, LIU Ai-feng, ZHANG Chao, BU Han-mei, WANG Jun-long, ZHANG Jun-tao
National Clinical Research Center for Chinese Medicine Acupuncture and Moxibustion, Regional Traditional Chinese Medicine Bone Injury Diagnosis and Treatment Center of State Administration of Traditional Chinese Medicine, First Teaching Hospital of Tianjin University of Traditional Chinese Medicine, Tianjin 300381, China
Knee osteoarthritis (KOA) is a degenerative osteoarthritis with destruction of articular cartilage and remodeling of subchondral bone as the main pathological changes. It is mainly manifested as pain and function limitation of knee joint, which seriously affects patient’s quality of life and causes huge medical burden to patients and society. Up to now, its pathogenesis is not fully understood. The activation of Wnt signal transduction is closely related to the pathogenesis of KOA, and the current research on Wnt signaling pathway focuses on the Wnt/β-catenin signaling pathway and its activation or inhibition protein expression. In recent years, a large number of studies have been conducted on mechanism of traditional Chinese medicine in treatment of KOA by regulating Wnt/β-catenin signaling pathway. The recent achievements in the regulation of Wnt/β-catenin signaling pathway by traditional Chinese medicine monomers and traditional Chinese medicine compounds in treatment of KOA are reviewed in this paper, in order to provide basic research for the clinical application of traditional Chinese medicine in treatment of KOA.
traditional Chinese medicine; psoralen; artemisinin; diosgenin; emodin; knee osteoarthritis; Wnt/β-catenin signaling pathway; mechanism
R285
A
0253 - 2670(2021)21 - 6717 - 07
10.7501/j.issn.0253-2670.2021.21.030
2021-06-08
国家自然科学基金资助项目(82074470);国家自然科学基金资助项目(81673994);国家自然科学基金资助项目(81873316);国家自然科学基金资助项目(51573137);天津市教委科研计划项目(2019KJ064);王平劳模创新工作室-天津市教委资助项目(2016-3);中医传承工作室-天津卫计委资助项目(2017-193)
李远栋(1980—),男,吉林人,副主任医师,硕士生导师,研究方向为脊柱关节疾病的防治。E-mail: 33724755@qq.com
张君涛(1977—),男,主任医师,硕士生导师,研究方向为脊柱关节疾病的基础与临床研究。E-mail: zhangjuntaoliyan@sina.com
#共同第一作者:杨 琨(1994—),男,河北人,硕士研究生,研究方向为脊柱关节疾病的防治。E-mail: wo521kun66@163.com
[责任编辑 崔艳丽]
