瑶药材搜山虎的化学成分研究
2021-11-08周艳林刘曲山覃柳馨周泽阳王晓艳陈晓双邹节明奉建芳2
王 刚,邹 准,周艳林,刘曲山,覃柳馨,周泽阳,王晓艳,陈晓双,邹节明*,奉建芳2, *
瑶药材搜山虎的化学成分研究
王 刚1, 2, 3,邹 准1,周艳林1,刘曲山1,覃柳馨3,周泽阳3,王晓艳3,陈晓双3,邹节明1*,奉建芳2, 3*
1. 桂林三金药业股份有限公司,广西 桂林 541004 2. 江西中医药大学,江西 南昌 330004 3. 广西中医药大学,广西 南宁 530200
研究搜山虎(岭南花椒的根和茎)的化学成分,为双虎肿痛宁酊剂的药效物质基础研究和质量标准提升提供依据。利用AB-8大孔树脂、硅胶、制备色谱进行成分分离,并结合核磁共振氢谱、碳谱和质谱鉴定化合物结构;采用脂多糖(lipopolysaccharide,LPS)刺激小鼠单核巨噬细胞RAW264.7细胞对化合物进行抗炎活性的研究;采用小鼠醋酸扭体法、热板法对分离得到的成分进行镇痛活性的研究。从搜山虎根中共分离得到10个化合物,分别鉴定为胡芦巴碱(1)、甲芬那酸(2)、4-羟基肉桂酸(3)、小檗碱(4)、橙皮苷(5)、新绿原酸(6)、白藜芦醇(7)、芥子酸(8)、脯氨酸(9)和甘草次酸(10)。抗炎活性研究结果表明,化合物2、4~7、10能够显著抑制肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-6(interleukin-6,IL-6)的释放。镇痛实验结果表明,化合物2、4、7能够显著降低小鼠扭体次数,显著提高痛阈值。所有化合物均为首次从该植物及花椒属植物中分离得到,化合物2、4、7具有很好的抗炎和镇痛作用。
岭南花椒;抗炎;镇痛;甲芬那酸;小檗碱;白藜芦醇
搜山虎是芸香科植物岭南花椒Huang的根和茎,主要产于广西、广东和江西等地[1]。《广西本草选编》《广西药用植物名录》等本草论著均有记载,又名地蜈蚣、爬山虎、过山龙,性微寒,归脾胃经,具有化瘀行气、消肿止痛、舒筋活络、驱风除湿、舒筋活络、消积滞、通大便、降火的作用,用于治疗全身筋骨疼痛、坐骨神经痛,跌打损伤、外伤出血等症状[2-3]。有研究表明搜山虎中含有生物碱、氨基酸、酚类化合物、香豆素、萜类内酯化合物等[4]。但具体成分均未明确,因此不利于搜山虎的质量控制。
双虎肿痛宁酊剂是桂林三金药业股份有限公司研制开发的一种非处方药,临床用于跌打损伤、扭伤、摔伤、风湿关节痛等疾病的治疗,并可作骨折及脱臼复位等手术局部麻醉止痛用。搜山虎作为双虎肿痛宁酊剂的君药,是发挥镇痛作用的主要药味之一。搜山虎在广西壮、瑶族民间医中有广泛的临床应用,也是靖西、恭城端午药市上常见交易药材,但相关基础研究十分薄弱,开展其化学成分及药效物质基础研究,将为该民族药资源的可持续开发利用,指导临床合理用药,促进新药开发和民族药现代化提供依据。并有助于双虎肿痛宁酊剂、古威活络酊等临床常用中成药的质量标准提升。本研究以60%的乙醇为溶剂,利用渗漉法提取,结合硅胶柱色谱进行分离纯化,通过波谱技术鉴定化合物的结构。从搜山虎中共分离得到10个化合物,分别鉴定为胡芦巴碱(trigonelline,1)、甲芬那酸(mefenamic acid,2)、4-羟基肉桂酸(4-hydroxycinnamic acid,3)、小檗碱(berberine,4)、橙皮苷(hesperidin,5)、新绿原酸(neochlorogenic acid,6)、白藜芦醇(resveratrol,7)、芥子酸(erucic acid,8)、脯氨酸(proline,9)和甘草次酸(glycyrrhetinic acid,10)。以上所有成分均为首次从搜山虎中分离得到,也是首次从花椒属植物中分离得到。体内外活性研究表明,化合物2、4~7、10具有显著的抗炎活性,化合物2、4、7具有显著的镇痛作用。
1 仪器与材料
1.1 实验仪器
Bruker AM-600 MHz核磁共振波谱仪(德国Bruker公司);Waters Q-TOF Premier质谱仪(美国Waters公司);安捷伦1260高效液相色谱仪(美国安捷伦公司);AB-8大孔树脂(天津市海光化工有限公司);C18制备色谱柱(250 mm×20 mm,5 μm,日本YMC公司);CP214分析天平(奥豪斯仪器上海有限公司);硅胶(100~200、200~300目,青岛海洋化工厂);GF254高效薄层板(青岛海洋化工厂);其他试剂皆为分析纯(天津大茂试剂有限公司);高效液相流动相为色谱纯(Thermo Fisher公司);CO2培养箱(美国Thermo公司);96孔板(美国Thermo Fisher公司);Synergy H1酶标仪(美国博腾公司);RB-200智能热板仪(成都泰盟科技有限公司);YP5002电子天平(上海佑科仪器仪表有限公司)。
1.2 药品
研究所用的搜山虎药材(标本号20180201)采自广西桂林,经桂林三金药业股份有限公司邹节明教授鉴定为芸香科植物岭南花椒Huang的根和根茎,样本存放于广西中医药大学科学实验中心天然药物研发实验室。
双虎肿痛宁酊(批号180501,桂林三金药业股份有限公司);脂多糖(lipopolysaccharide,LPS,质量分数>99%,美国Sigma公司);胎牛血清(批号19460202,浙江天杭生物科技股份有限公司);DMEM高糖培养基 [批号SH40007.03,海克隆生物化学制品(北京)有限公司];肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)及白细胞介素-6(interleukin-6,IL-6)ELISA试剂盒(批号201906)、BCA试剂盒(批号A81911151),杭州联科生物有限公司。
1.3 动物及细胞
SPF 级昆明种小鼠,体质量18~20 g,雌雄兼用,湖南斯莱克景达实验动物有限公司,许可证号SCXK(湘)2019-0004,实验动物伦理批准单位为广西中医药大学,实验动物伦理审批号为DW20210311-021,动物饲养在温湿度可控的动物中心,自由摄食及饮水。
RAW264.7单核细胞购买于上海元和生物有限公司。
2 方法
2.1 提取与分离
取搜山虎根粉10 kg,用60%乙醇渗漉提取,收集提取液,减压浓缩回收溶剂,得棕黑色浸膏190 g。取上述浸膏,用AB-8大孔树脂柱色谱进行梯度洗脱,洗脱溶剂分别为水及20%、45%、65%、85%乙醇溶液。65%乙醇洗脱部分(50 g)经正己烷-醋酸乙酯系统分离,反相C18柱色谱(流动相为1%甲酸水-甲醇)分离得到化合物1(17.2 mg,R=24.1 min)、3(122.6 mg,R=36.3 min)、7(23.1 mg,R=42.1 min)、8(10.1 mg,R=27.6 min);85%乙醇洗脱部分(80 g)经正己烷-醋酸乙酯系统分离,反相C18柱色谱(流动相为水-甲醇)分离得到化合物2(142.2 mg,R=68.4 min)、4(12.1 mg,R=49.8 min)、5(7.7 mg,R=52.1 min)、6(17.2 mg,R=37.5 min)、9(8.3 mg,R=18.5 min)和10(6.6 mg,R=53.6 min)。
2.2 ELISA法检测RAW264.7细胞释放TNF-α和IL-6水平
用0.5%胰酶消化对数生长期的RAW264.7细胞,制成细胞悬液,接种于24孔板,接种密度为6×105个/孔,于5%CO2培养箱中培养24 h。用搜山虎60%乙醇提取物、化合物1~9(给药剂量为80 μg/mL)处理细胞1 h后,加入LPS(1 μg/mL)共培养20 h,取上清,按照ELISA试剂盒说明书进行炎症因子TNF-α和IL-6检测。另外,设置对照组(不用LPS和药物孵育)和LPS组(1 μg/mL LPS孵育)。
2.3 小鼠醋酸扭体致痛实验
昆明种小鼠110只,雌雄各半,随机分成11组,每组10只,分别为对照组(水)、阳性对照组(双虎肿痛宁酊剂)、搜山虎药材60%乙醇提取物组、化合物1~9(100 mg/kg),对照、阳性对照及搜山虎药材60%乙醇提取物组按1.6 mL/只涂于小鼠4足,化合物1~9组小鼠按照0.4 mL/只分别涂于小鼠4足。给药后30 min,ip 0.6%冰醋酸,0.2 mL/只,同时用秒表计时,记录小鼠15 min内出现的扭体次数扭体(反应指标为腹部内凹、后肢伸展、抬高臀部),记录ip冰醋酸后15 min内扭体总次数,并计算扭体反应抑制率。
2.4 小鼠热板镇痛实验
筛选出合格昆明种小鼠110只[痛阈值在5~30 s(以小鼠舔后足反应为疼痛反应指标)且无跳跃反应的合格小鼠],随机分成11组,每组10只,分别为对照组(水)、阳性对照组(双虎肿痛宁酊剂)、搜山虎药材60%乙醇提取物组、化合物1~9(100 mg/kg),对照、阳性对照及搜山虎提取物组按1.6 mL/只涂于小鼠4足。给药完成0.5、1.0、1.5 h后,分别测定各组小鼠痛阈值,计算痛阈抑制率。
痛阈抑制率=(给药组小鼠平均痛阈值-对照组小鼠平均痛阈值)/对照组小鼠平均痛阈值
3 结果
3.1 结构鉴定
化合物1:白色粉末。分子式C7H7NO2,ESI-MS/: 136.238 2 [M-H]−。碘化汞钾沉淀试验、碘-碘化钾沉淀试验、苦味酸沉淀试验均呈阳性反应[5]。1H-NMR (600 MHz, DMSO-6): 9.20 (1H, s, H-2), 8.89 (1H, d,= 6.0 Hz, H-4), 8.74 (1H, d,= 7.9 Hz, H-6), 8.05~7.98 (1H, m, H-5), 4.36 (3H, s, -CH3);13C-NMR (150 MHz, DMSO-6): 162.4 (C-7), 146.4 (C-6), 145.1 (C-2), 144.4 (C-4), 140.7 (C-3), 127.1 (C-5), 48.1 (-CH3)。以上波谱数据与文献报道对照基本一致[6],故鉴定化合物1为胡芦巴碱。
化合物2:白色粉末。分子式C15H15NO2,ESI- MS/: 240.122 9 [M-H]−。1H-NMR (600 MHz, DMSO-6): 12.98 (1H, s, -COOH), 9.45 (1H, s, -NH), 7.89 (1H, dd,= 8.1, 1.5 Hz, H-3), 7.33~7.28 (1H, m, H-5), 7.14~7.09 (2H, m, H-5′, 6′), 7.05~7.00 (1H, m, H-4′), 6.69 (2H, dd,= 11.9, 4.3 Hz, H-4, 6), 2.29 (3H, s, 7′-CH3), 2.10 (3H, s, 8′-CH3);13C-NMR (150 MHz, DMSO-6): 170.7 (C-1), 149.2 (C-2), 138.8 (C-3), 138.4 (C-4), 134.7 (C-5), 132.2 (C-6), 131.7 (C-7), 126.9 (C-8), 126.5 (C-9), 122.7 (C-10), 116.7 (C-11), 113.6 (C-12), 111.7 (C-13), 20.7 (C-14), 14.1 (C-15)。以上波谱数据与文献报道对照基本一致[7-9],故鉴定化合物2为甲芬那酸。
化合物3:白色粉末。分子式C9H8O3,ESI-MS/: 163.263 4 [M-H]−。1H-NMR (600 MHz, DMSO-6): 7.47 (2H, d,= 8.1 Hz, H-2, 6), 6.79 (2H, d,= 7.9 Hz, H-3, 5), 6.29 (1H, d,= 15.9 Hz, H-8);13C-NMR (150 MHz, DMSO-6): 168.4 (C-9), 160.1 (C-4), 144.6 (C-7), 130.7 (C-6), 130.6 (C-6), 125.7 (C-1), 116.4 (C-3), 116.2 (C-5), 115.8 (C-8)。以上波谱数据与文献报道对照基本一致[10-12],故鉴定化合物3为4-羟基肉桂酸。
化合物4:白色粉末。分子式C17H17N,ESI-MS/: 236.312 2 [M+H]+。1H-NMR (600 MHz, DMSO-6): 9.91 (1H, s, H-8), 8.97 (1H, s, H-13), 8.20 (1H, d,= 9.2 Hz, H-11), 8.01 (1H, d,= 9.0 Hz, H-12), 7.80 (1H, s, H-1), 7.09 (1H, s, H-4), 6.17 (2H, s, -O-CH2-O-), 4.95 (2H, t,= 6.3 Hz, H-6), 4.10 (3H, s, -OCH3), 4.07 (3H, s, -OCH3), 3.23~3.19 (2H, t,= 6.4 Hz, H-5);13C-NMR (150 MHz, DMSO-6): 150.9 (C-3), 150.3 (C-10), 148.2 (C-2), 145.9 (C-8), 144.1 (C-9), 137.9 (C-13a), 133.5 (C-12a), 127.2 (C-4a), 124.0 (C-11), 121.9 (C-8a), 120.9 (C-13b), 120.7 (C-13), 108.9 (C-1), 62.4 (9-OCH3), 57.5 (10-OCH3), 55.6 (C-6), 26.8 (C-5)。以上波谱数据与文献报道对照基本一致[13-14],故鉴定化合物4为小檗碱。
化合物5:白色粉末。分子式C28H34O15,ESI-MS/: 611.125 6 [M+H]+。1H-NMR (600 MHz, DMSO-6): 12.02 (1H, s, 5-OH), 9.09 (1H, s, 3′-OH), 6.97~6.92 (2H, m, H-2′, 5′), 6.90 (1H, d,= 8.4 Hz, H-6′), 6.16~6.11 (2H, m, H-6, 8), 5.50 (1H, ddd,= 10.9, 7.7, 3.0 Hz, H-2), 5.39 (1H, d,= 5.1 Hz, H-1′), 5.17 (2H, dd,= 10.7, 5.2 Hz, H-1′′′, 2′′), 4.98 (1H, t,= 8.2 Hz, H-1″), 4.52 (1H, s, H-3‴), 3.77 (3H, s, 4′-OCH3), 3.57~3.52 (1H, m, H-6″), 3.32~3.25 (2H, m, H-5″′, 3″), 3.24~3.20 (1H, m, H-3), 3.19~3.10 (2H, m, H-4″, 4‴), 1.09 (3H, dd,= 6.1, 3.5 Hz, 6‴-CH3);13C-NMR (150 MHz, DMSO-6): 197.5 (C-4), 165.6 (C-7), 163.5 (C-5), 163.0 (C-9), 148.4, (C-4′), 146.9 (C-3′), 131.4 (C-1′), 118.4 (C-6′), 114.6 (C-2′), 112.5 (C-5′), 103.8 (C-10), 101.1 (C-1′′′), 99.9 (C-1′), 96.8 (C-6), 96.0 (C-8), 78.8 (C-2), 76.7 (C-5′′), 76.0 (C-2′′), 73.4 (C-4′′′), 72.5 (C-3′′), 71.2 (C-4′′), 70.7 (C-3′′′), 70.1 (C-2′′′), 68.8 (C-5′′′), 66.5 (C-6′′), 56.1 (-OCH3), 42.5 (C-3), 18.3 (-CH3)。以上波谱数据与文献报道对照基本一致[15-16],故鉴定化合物5为橙皮苷。
化合物6:白色粉末。分子式C16H18O9,ESI-MS/: 353.341 1 [M-H]−。1H-NMR (600 MHz, DMSO-6): 12.28 (1H, s, -COOH),7.46 (1H, d,= 15.8 Hz, H-β), 7.07~6.95 (2H, m, H-6′, 2′), 6.77 (1H, d,= 8.1 Hz, H-5′), 6.20 (1H, d,= 15.9 Hz, H-α), 5.34~4.82 (2H, m, H-3, 5), 3.87 (1H, dd,= 12.1, 5.7 Hz, H-8′), 3.55 (1H, d,= 2.7 Hz, H-4), 2.51 (1H, dt,= 3.6, 1.8 Hz, H-6), 2.06~1.84 (4H, m, 2×-CH2);13C-NMR (150 MHz, DMSO-6): 176.5 (-COOH), 166.6 (-C=O), 148.6 (C-4′), 146.0 (C-β), 144.9 (C-3′), 126.2 (C-1′), 121.6 (C-6′), 116.3 (C-5′), 115.5 (C-α), 115.1 (C-2′), 73.4 (C-1), 71.4 (C-4), 67.7 (C-3), 56.5 (C-5), 35.6 (C-2), 19.0 (C-6)。以上波谱数据与文献报道基本一致[17-18],故鉴定化合物6为新绿原酸。
化合物7:白色粉末。分子式C14H12O3,ESI-MS/: 229.244 1 [M+H]+。1H-NMR (600 MHz, DMSO-6): 7.42~7.37 (2H, m, H-2′, 6′), 6.93 (1H, d,= 16.3 Hz, H-1), 6.82 (1H, d,= 16.3 Hz, H-1′), 6.78~6.74 (2H, m, H-3′, 5′), 6.39 (2H, d,= 2.1 Hz, H-2, 6), 6.13 (1H, t,= 2.1 Hz, H-4);13C-NMR (150 MHz, DMSO-6): 159.0 (C-3′), 157.7 (C-6), 139.7 (C-1′), 128.5 (C-3), 128.3 (C-2), 128.3 (C-4), 126.1 (C-1), 116.0 (C-5), 104.7 (C-2′), 102.2 (C-4′)。以上波谱数据与文献报道基本一致[19-20],故鉴定化合物7为白藜芦醇。
化合物8:白色粉末。分子式C11H12O5,ESI-MS/: 223.122 1 [M-H]−。1H-NMR (600 MHz, DMSO-6): 12.13 (1H, s, -COOH), 7.50 (1H, d,= 15.9 Hz, H-7), 6.99 (2H, s, H-1, 6), 6.42 (1H, d,= 15.9 Hz, H-8), 3.80 (6H, s, 2×-CH3);13C-NMR (150 MHz, DMSO-6): 168.4 (-COOH), 148.5 (C-3, 5), 145.3 (C-β), 138.5 (C-4), 125.1 (C-1), 116.5 (C-α), 106.5 (C-2, 6), 56.6 (-OCH3)。以上波谱数据与文献报道对照基本一致[21-22],故鉴定化合物8为芥子酸。
化合物9:白色粉末。分子式C5H9NO2,ESI-MS/: 115.146 1 [M-H]−。1H-NMR (600 MHz, DMSO-6): 8.66 (1H, s, -COOH), 3.64 (1H, dd,= 8.3, 5.4 Hz, H-2), 3.29~3.13 (2H, m, 5-CH2), 2.07~1.86 (2H, m, 3-CH2), 1.84~1.60 (2H, m, 4-CH2);13C-NMR (150 MHz, DMSO-6): 169.8 (-COOH), 61.2 (C-2), 45.6 (C-5), 29.4 (C-3), 24.4 (C-4)。以上波谱数据与文献报道对照基本一致[23-24],故鉴定化合物9为脯氨酸。
化合物10:白色粉末。分子式C34H50O7,ESI-MS/: 569.076 1 [M-H]−。1H-NMR (600 MHz, DMSO-6): 12.18 (1H, s, -COOH), 5.40 (1H, s, H-12), 3.02 (1H, d,= 10.9 Hz, H-3), 2.58 (2H, dt,= 12.9, 3.1 Hz, H-1), 2.33 (1H, s, H-9),1.31 (3H, m, H-27), 1.25 (3H, td,= 14.1, 3.7 Hz, H-29), 1.15 (3H, d,= 12.0 Hz, H-25), 1.11 (3H, d,= 8.9 Hz, H-23), 1.03 (3H, d,= 6.0 Hz, H-26), 0.96 (2H, dd,= 13.7, 2.6 Hz), 0.91 (3H, s, H-26), 0.76 (3H, s, H-24), 0.70 (3H, d,= 8.6 Hz, H-28);13C-NMR (150 MHz, DMSO-6): 199.5 (C-11), 178.1 (C-29), 170.1 (C-13), 127.7 (C-12), 77.1 (C-3), 61.6 (C-9), 54.6 (C-5), 48.5 (C-18), 45.3 (C-8), 43.5 (C-20), 43.4 (C-14), 41.1 (C-19), 39.2 (C-4), 39.0 (C-1), 38.0 (C-22), 37.1 (C-10), 32.6 (C-7), 32.0 (C-17), 30.8 (C-21), 28.9 (C-28), 28.6 (C-30), 28.3 (C-23), 27.4 (C-2), 26.5 (C-16), 26.3 (C-15), 23.5 (C-27), 18.8 (C-26), 17.6 (C-6), 16.7 (C-25), 16.5 (C-24)。以上波谱数据与文献报道对照基本一致[25-26],故鉴定化合物10为甘草次酸。
3.2 ELISA法检测RAW264.7细胞释放TNF-α和IL-6水平
搜山虎60%乙醇提取物和分离得到化合物的抗炎活性研究如表1所示。结果表明,在LPS的作用下,RAW264.7细胞释放的TNF-α和IL-6明显升高,搜山虎60%乙醇提取物能够显著降低上清液中TNF-α和IL-6的含量。另外从药材中分离得到的化合物2、4~7、10能够显著抑制细胞分泌TNF-α和IL-6。而化合物1、3、8、9与RAW264.7细胞孵育后,细胞上清液中TNF-α和IL-6的分泌量与LPS诱导组接近(>0.05),说明这些化合物对TNF-α和IL-6的分泌没有抑制作用。
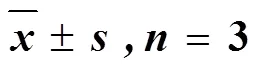
表1 搜山虎药材提取物及不同成分对LPS诱导的RAW264.7细胞分泌TNF-α和IL-6水平的影响()
与LPS组比较:*<0.05**<0.01
*< 0.05**< 0.01LPS group
3.3 小鼠醋酸扭体致痛实验
小鼠醋酸扭体致痛实验结果(表2)表明,与对照组相比,双虎肿痛宁酊剂能够显著降低小鼠扭体次数,抑制率为74.2%。60%乙醇提取的搜山虎亦能减少小鼠的扭体次数,抑制率为36.1%,但小于双虎肿痛宁酊剂。另外从搜山虎药材中分离得到的化合物2、4、7能够显著降低小鼠扭体次数。抑制率由高到低排序依次为双虎肿痛宁酊剂>甲芬那酸(2)>白藜芦醇(7)>小檗碱(4)>搜山虎60%乙醇提取物。化合物1、3、5、6、8、9对小鼠醋酸扭体无影响。
3.4 小鼠热板法镇痛实验
小鼠热板法镇痛反应的研究结果(表3)表明,与对照组相比,给药后30、60、90 min双虎肿痛宁酊剂组、甲芬那酸组和白藜芦醇组的痛阈值显著升高(<0.05、0.01)。给药后60、90 min搜山虎乙醇提取物组的痛阈值显著升高(<0.05)。给药后90 min小檗碱组的痛阈值显著升高(<0.05)。痛阈值抑制率由高到低分别为双虎肿痛宁酊剂>甲芬那酸(2)>白藜芦醇(7)>搜山虎60%乙醇提取物>小檗碱(4)。化合物1、3、5、6、8、9对小鼠热板镇痛无作用。
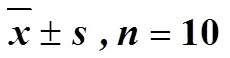
表2 双虎肿痛宁酊剂、搜山虎药材提取物及不同成分对醋酸所致小鼠扭体反应的影响()
与对照组比较:*<0.05**<0.01,下表同
*< 0.05**< 0.01control group, same as Table below
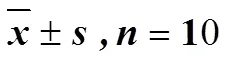
表3 双虎肿痛宁酊剂、搜山虎药材提取物及不同成分对小鼠热板法镇痛的影响()
4 讨论
采用现代色谱技术手段对瑶药材搜山虎进行了系统的化学成分研究,共得到了10个化合物,包括2个生物碱类化合物、3个苯丙素类化合物、1个黄酮类化合物、1个皂苷类化合物、1个氨基酸、1个多酚类化合物、1个芳基烷酸类化合物,均为首次从搜山虎中分离得到,也是首次从花椒属植物中分离得到。
组织损伤诱发疼痛和炎症反应,二者相互因果,形成炎症性疼痛[27-28]。炎症反应发生时,细胞分泌大量的TNF-α、IL-6等细胞因袭,这些因子可以延长炎症的时间,增加炎症的强度,促进疼痛级别的升高[29]。本研究发现搜山虎醇提物能够有效的降低TNF-α和IL-6的分泌,说明该搜山虎能够通过抑制炎症因子的分泌来产生抗炎作用。另外从药材中分离得到的化合物2、4~7、10能够显著抑制细胞分泌TNF-α和IL-6,说明这些化合物可能为搜山虎抗炎的药效成分。另外在镇痛的体内研究中,发现搜山虎药材醇提物和双虎肿痛宁酊的镇痛作用非常明显,而分离得到的化合物2、4、7具有一定的镇痛作用,表明搜山虎入药镇痛作用存在多组分整体协同效果。本研究结果为阐明白搜山虎药效物质基础和质量标准提升提供了依据,在保证药品质量的稳定性、有效性和安全性方面具有重要意义。
利益冲突 所有作者均声明不存在利益冲突
[1] 刘雪婷, 韦秋菊, 周小苏, 等. 搜山虎水提液对小鼠抗疲劳、耐缺氧作用的实验研究 [J]. 右江医学, 2019, 47(10): 743-747.
[2] 广西壮族自治区革命委员会卫生局. 广西本草选编(下)[M]. 南宁: 广西人民出版社, 1974: 1684-1685.
[3] 黄晓芳, 倪洪岗, 徐寒松, 等. 苗族民间药“搜山虎”的考证 [J]. 中国民族民间医药, 2018, 27(18): 44-45.
[4] 李干孙. “搜山虎”成份初探 [J]. 广西师范大学学报: 自然科学版, 1984(15): 76.
[5] 于洋. 胡芦巴生物碱的提取、纯化及分离的研究 [D]. 长春: 吉林农业大学, 2012.
[6] Li C Y, Lin C H, Wu T S. Quantitative analysis of camptothecin derivatives in nothapodytes foetida using1H-NMR method [J]., 2005, 53(3): 347-349.
[7] Munro S, Craik D J. NMR conformational studies of fenamate non-steroidal anti-inflammatory drugs [J]., 2011, 32(6):335-342.
[8] Tadić A N, Poljarević J, Krstić M,. Ruthenium -complexes with NSAIDs: Synthesis, characterization and bioactivity [J]., 2018, 42(4): 3001-3019.
[9] Nykaza T V, Cooper J C, Li G,. Intermolecular reductive C-N cross coupling of nitroarenes and boronic acids by PIII/PV═O catalysis [J]., 2018, 140(45): 15200-15205.
[10] Yong D M, Min C Y, Lee K H,Protoberberine alkaloids and their reversal activity of P-gp expressed multidrug resistance (MDR) from the rhizome ofMakino [J]., 2006, 29(9): 757-761.
[11] Moussouni S, Karakousi C V, Tsatalas P,. Biological studies with phytochemical analysis ofunripe fruits [J]., 2020, 56(1): 141-144.
[12] Liao C R, Kuo Y H, Ho Y L,. Studies on cytotoxic constituents from the leaves ofMaxim. in non-small cell lung cancer A549 cells [J]., 2014, 19(7): 9515-9534.
[13] Gatland A E, Pilgrim B S, Procopiou P A,. Short and efficient syntheses of protoberberine alkaloids using palladium-catalyzed enolate arylation [J]., 2014, 53(52): 14555-14558.
[14] Lin H J, Ho J H, Tsai L C,. Synthesis andphotocytotoxicity of 9-/13-lipophilic substituted berberine derivatives as potential anticancer agents [J]., 2020, 25(3): E677.
[15] Reinhardt J K , Zimmermann-Klemd A M , Danton O,. Compounds from: Immunosuppressant activity and absolute configurations [J]., 83(10): 3012-3020.
[16] Correia-Da-Silva M, Sousa E, Duarte B,. Flavonoids with an oligopolysulfated moiety: A new class of anticoagulant agents [J]., 2011, 54(1): 95-106.
[17] Ornano L, Venditti A, Ballero M,. Chemopreventive and antioxidant activity of the chamazulene-rich essential oil obtained fromL. growing on the isle of La Maddalena, Sardinia, Italy [J]., 2013, 10(8): 1464-1474.
[18] Kalinowska M, Bajko E, Matejczyk M,. The study of anti-/pro-oxidant, lipophilic, microbial and spectroscopic properties of new alkali metal salts of 5--caffeoylquinic acid [J]., 2018, 19(2): E463.
[19] Thiel N O, Kaewmee B, Tran Ngoc T,. A simple nickel catalyst enabling an-selective alkyne semihydrogenation [J]., 2020, 26(7): 1597-1603.
[20] Yang S Y, Tian W J, Pan Z R,. Polyphenols fromreactivate latent HIV [J]., 2020, 56(2): 318-322.
[21] 孙凯, 李铣, 康兴东, 等. 南葶苈子的化学成分 [J]. 沈阳药科大学学报, 2005, 22(3):181-182.
[22] Dong H B, Hou M, Ma W B,. First total synthesis of a new phenylpropanoid glycoside: Natural cytotoxic compound from[J]., 2018, 20(12): 1154-1161.
[23] Lokesh, Suryaprakash N. Weakly ordered chiral alignment medium derived from 5'-GMP: Guanosine [J]., 2013, 49(20): 2049-2051.
[24] Thiele C M, Pomerantz W C, Abbott N L,. Lyotropic liquid crystalline phases from helical β-peptides as alignment media [J]., 2011, 47(1): 502-504.
[25] Beseda I, Czollner L, Shah P S,. Synthesis of glycyrrhetinic acid derivatives for the treatment of metabolic diseases [J]., 2010, 18(1): 433-454.
[26] Wang X, Gu X, Wang H,. Synthesis, characterization and liver targeting evaluation of self-assembled hyaluronic acid nanoparticles functionalized with glycyrrhetinic acid [J]., 2017, 96: 255-262.
[27] Grösch S, Niederberger E, Geisslinger G. Investigational drugs targeting the prostaglandin E2 signaling pathway for the treatment of inflammatory pain [J]., 2017, 26(1): 51-61.
[28] 费雪瑜, 邰昭霞, 王涵芝, 等. P2X受体介导慢性疼痛的研究进展[J]. 世界中医药, 2019, 14(6): 1363-1367.
[29] 王国峰, 赵霞, 李宁, 等. 川芎嗪对脂多糖诱导内皮细胞花生四烯酸通路炎症反应的影响 [J]. 中国药理学通报, 2012, 28(4): 563-567.
Study on chemical constituents fromet
WANG Gang1, 2, 3, ZOU Zhun1, ZHOU Yan-lin1, LIUQu-shan1, QIN Liu-xin3, ZHOU Ze-yang3, WANG Xiao-yan3, CHEN Xiao-shuang3, ZOU Jie-ming1, FENG Jian-fang2, 3
1. Guilin San jin Pharmaceutical Company Limited, Guilin 541004, China 2. Jiang xi University of Chinese Medicine, Nanchang 330004, China 3. Guang xi University of Chinese Medicine, Nanning 530200, China
Identificationthe chemical constituents ofetis an important work for evaluating the potential pharmacodynamicsubstances and controlling the quality of Shuanghu zhongtong ning tincture.The compounds were isolated by AB-8 macroporous resin, silica gel column chromatography and preparative chromatography. And the structural analysis was performed with NMR and UPLC-Q-TOF and their anti-inflammatory activity and analgesic effects were investigated.Ten compounds were isolated fromHuang and identified as trigonelline (1), mefenamic acid (2), 4-hydroxycinnamic acid (3), berberine (4), hesperidin (5), neochlorogenic acid (6), resveratrol (7), erucic acid (8), proline (9) and glycyrrhetinic acid (10). The anti-inflammatory experiment indicated that compound 2, 4—7, 10 exhibited significant biological activities, which suppressed the release of TNF-α and IL-6. In addition, compound 2, 4, 7 had significant analgesic effects on rats by a reduced writhing and increased the pain threshold.All the compounds were isolated fromfor the first time. Compounds 2, 4 and 7 exhibited significantly anti-inflammatory activity and analgesic effects.
Huang; anti-inflammatory; analgesic; mefenamic acid;berberine; resveratrol
R284.1
A
0253 - 2670(2021)21 - 6466 - 07
10.7501/j.issn.0253-2670.2021.21.003
2021-07-09
国家自然科学基金资助项目(82060641);中国博士后面上基金资助项目(2019M653814XB);广西科技基地和人才专项(2018AD19035);广西自然科学基金课题(2018JJB140377、2018JJB140325);广西中青年教师提升项目(2019KY0338);广西一流学科建设开放性课题(2019XK127);广西中医药大学校级课题(2018MS003)。
王 刚,男,硕士生导师,副研究员,从事药物新制剂、新剂型研究与开发。E-mail: 99329388@qq.com
邹节明,男,博士生导师,教授级高级工程师,从事中药新药研究。E-mail: zjm@sanjin.com.cn
奉建芳,男,博士生导师,研究员,从事中药新型给药系统研究。E-mail: fengjianfang@vip.163.com
[责任编辑 王文倩]
