黄芪甲苷配伍三七总皂苷对脑缺血大鼠BMSCs移植后神经修复的影响
2021-11-08李艳玲傅馨莹陆展辉杨芙蓉刘晓丹邓常清
李艳玲,丁 煌,傅馨莹,唐 三,陆展辉,杨芙蓉,刘晓丹,邓常清
• 药理与临床 •
黄芪甲苷配伍三七总皂苷对脑缺血大鼠BMSCs移植后神经修复的影响
李艳玲,丁 煌,傅馨莹,唐 三,陆展辉,杨芙蓉,刘晓丹*,邓常清*
湖南中医药大学,中西医结合心脑疾病防治湖南省重点实验室,细胞生物学与分子技术湖南省高校重点实验室,湖南 长沙 410208
探讨黄芪甲苷IV(astragaloside IV,AST IV)与三七总皂苷(saponins,PNS)配伍联合骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)移植对脑缺血大鼠神经功能修复的影响。大鼠随机分为对照组、模型组、AST IV(10 mg/kg)与PNS(25 mg/kg)低剂量组、AST IV(20 mg/kg)与PNS(50 mg/kg)高剂量组、BMSCs输注组、BMSCs输注联合AST IV(10 mg/kg)与PNS(25 mg/kg)低剂量组、BMSCs输注联合AST IV(20 mg/kg)与PNS(50 mg/kg)高剂量组。全骨髓贴壁法分离、纯化BMSCs,流式细胞术检测BMSCs表面标志物CD29、CD90、CD34、CD45阳性表达率。各给药组给予药物进行干预,采用大脑中动脉阻塞(middle cerebral artery occlusion,MCAO)建立局灶性脑缺血模型,采用Longa法测定各组大鼠神经功能缺损症状;采用苏木素-伊红(HE)染色与尼氏染色测定各组大鼠脑组织病理变化;采用免疫荧光法检测各组大鼠海马区BMSCs和神经元特异性烯醇化酶(neuron specific enolase,NSE)阳性表达;采用Western blotting法测定各组大鼠脑组织脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)和胶质细胞源性神经营养因子(glial cell line derived neurotrophic factor,GDNF)蛋白表达。成功分离培养BMSCs,表面标志物CD29、CD90、CD34、CD45鉴定符合BMSCs特征。大鼠脑缺血后出现神经功能缺损症状及脑组织病理损伤,模型组大鼠神经功能缺损评分和脑组织细胞损伤率显著升高(<0.01),尼氏体数量显著减少(<0.01);各给药组均能够不同程度减轻上述病理改变,其中效应最强为BMSCs输注联合AST Ⅳ+PNS高剂量组(<0.01),优于单用药物和单用BMSCs输注。大鼠脑缺血后神经元损伤,输注BMSCs后,细胞可在缺血侧脑组织增殖并分化为神经元,药物联合BMSCs输注能够增强BMSCs在大鼠脑内的增殖和分化。大鼠脑缺血后,BDNF和GDNF蛋白表达增加,各药物组均能够不同程度上调其表达,其中效应最强为BMSCs输注联合ASTⅣ+PNS组(<0.01),优于单用药物和单用BMSCs输注。AST Ⅳ配伍PNS能够促进BMSCs移植的存活,靶向修复脑缺血后受损神经元,其机制可能与改善脑缺血后脑内局部微环境,促进移植干细胞的存活、增殖和分化有关。
黄芪甲苷;三七总皂苷;骨髓间充质干细胞;脑缺血;增殖;迁移;神经分化
缺血性脑损伤的病因和发病机制复杂,具有高发病率、高死亡率、高致残率和治疗费用高等特点,且目前受治疗时间窗限制,临床上大部分病人均未得到有效的救治。骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)具有向神经细胞分化的潜力,其移植后对缺血性实验大鼠的神经功能具有改善作用,为神经系统疾病的治疗提供了一种新的治疗途径[1]。但目前BMSCs的移植存在在实验动物脑内成活率较低且向神经细胞定向分化能力不足等问题。因此,促进BMSCs移植后在体内的增殖并向神经细胞定向分化是目前研究的重点。近年研究发现[2-4],中药复方及有效单体能够诱导BMSCs的分化,开辟了中药干预BMSCs治疗心脑血管疾病的新途径。
黄芪甲苷IV(astragaloside IV,AST IV)和三七总皂苷(saponins,PNS)是黄芪和三七发挥心脑血管保护效应的有效组分。本课题组前期大量研究证实[5-7],黄芪总苷的有效成分AST IV和PNS配伍可多靶点、多环节发挥对缺血性脑损伤的神经保护作用,并在体外能够促进缺血再灌注模型BMSCs增殖、迁移,抑制其凋亡,诱导其向神经元、星形胶质细胞定向分化。基于此,本研究采用大脑中动脉栓塞(middle cerebral artery occlusion,MCAO)建立缺血性脑损伤模型,观察黄芪和三七主要有效成分AST IV和PNS配伍促BMSCs移植对MCAO大鼠神经修复的作用,为中药有效组分配伍促进脑缺血后神经修复的治疗提供实验依据。
1 材料
1.1 动物
3周龄SPF级雄性SD大鼠,体质量(150±20)g,购自湖南斯莱克景达实验动物有限公司,动物合格证号ZS-202008110006;8周龄SPF级雄性SD大鼠,体质量(220±20)g,购自湖南斯莱克景达实验动物有限公司,动物合格证号ZS-202008040008。动物饲养于湖南中医药大学动物实验中心,实验动物许可证号SKY(湘)2013-0005。实验前适应性饲养5~7 d,造模前禁食12 h,自由饮水。动物的使用符合科技部《关于善待实验动物的指导性意见》相关规定,批准号LLBH-202004290001。
1.2 药品与试剂
AST IV(质量分数为98%,批号AF9102805)、PNS(质量分数为90%,批号AF20033002)购自成都埃法生物科技有限公司;PKH26Red Fluorescent Cell Linker Mini Kit(批号MINI25-1KT)购自美国Sigma公司;CD29-FITC(批号HMb1-1)、CD90-FITC(批号HIS51)、CD34-PI(批号4H11)、CD45-PI(批号OX1)购自美国eBioscience公司;兔抗大鼠脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)单克隆抗体(批号ab108319)、兔抗大鼠胶质细胞源性神经营养因子(glial cell line derived neurotrophic factor,GDNF)单克隆抗体(批号ab176564)、兔抗大鼠神经元特异性烯醇化酶(neuron specific enolase,NSE)单克隆抗体(批号ab180943)购自英国Abcam公司;兔抗大鼠β-actin单克隆抗体(批号20536-1-AP)、山羊抗兔IgG二抗(批号SA00001-2)购自美国Thermo Fisher Scientific公司;L-DMEM培养基(批号AF29527017)购自美国Hyclone公司;胎牛血清(批号SA190501)购自武汉普诺赛生命科技有限公司;BCA蛋白定量试剂盒(批号A00445)购自杭州联科生物技术股份有限公司;MCAO栓线(批号2634-A4)购自北京西浓科技有限公司;FITC标记的山羊抗兔荧光二抗(批号GB27303)购自武汉赛维尔生物科技有限公司。
1.3 仪器
CO2培养箱(德国Heraeus公司);SW-CJ-1FD型超净工作台(苏州安泰空气技术有限公司);DxP Athenatm流式细胞仪(上海迪发仪器仪表有限公司);Chemi-DoC-XRS+化学发光成像分析仪、CYTATION5多功能酶标成像系统仪(美国Bio-Rad公司);BX51光学显微镜(日本Olympus公司);Eclipse C1正置荧光显微镜(日本Nikon公司)。
2 方法
2.1 BMSCs分离、培养及鉴定
根据课题组前期方法[7],取体质量(150±20)g的SD大鼠进行BMSCs分离、培养以及细胞表面标志物CD29、CD90、CD34、CD45的检测。大鼠尾iv第3代BMSCs(1×104/mL)前用PKH26Red Fluorescent Cell Linker Mini Kit进行细胞标记使细胞自发红光。
2.2 大鼠MCAO模型制备
参照Longa法改良[8],取体质量(220±20)g的SD大鼠,ip 10%水合氯酸(300 mg/kg)麻醉,颈正中切口,依次分离右侧颈总动脉、颈外动脉、颈内动脉,结扎右侧颈总动脉近心端、颈外动脉及其所有分支动脉,在右侧颈总动脉分叉处做一切口,向右侧颈内动脉方向插入栓线,推进17~20 mm感阻力时停止,固定栓线,缝合皮肤,此时即完成一侧大脑中动脉阻塞。对照组大鼠仅分离血管,不进行血管结扎及线栓导入。
2.3 分组及给药
根据前期的研究结果[6],将大鼠随机分为对照组、模型组、AST IV(10 mg/kg)与PNS(25 mg/kg)低剂量组、AST IV(20 mg/kg)与PNS(50 mg/kg)高剂量组、BMSCs输注组、BMSCs输注联合AST IV(10 mg/kg)与PNS(25 mg/kg)低剂量组、BMSCs输注联合AST IV(20 mg/kg)与PNS(50 mg/kg)高剂量组,每组10只。药物以0.5%羧甲基纤维素钠(CMCNa)配制成相应质量浓度的混悬液。于造模前1 d,各给药组ig 1 mL相应药物,2次/d,并尾iv 1 mL 0.9%氯化钠溶液,1次/d;对照组和模型组ig等体积0.5% CMCNa并尾iv等体积0.9%氯化钠溶液。于给药后24 h行MCAO,术后除BMSCs输注组及BMSCs输注与药物联用组外同前给药,BMSCs输注组尾iv BMSCs并ig等体积0.5% CMCNa,BMSCs输注与药物联用组尾iv BMSCs并ig相应药物,术后连续给药2 d。缺血7 d后处死大鼠,取材。
2.4 Longa法测定大鼠神经功能评分
大鼠造模清醒后每天采用Longa神经功能评分法进行评分。评分标准:0分,无神经功能缺损体征;1分,患侧前爪不能完全伸展,为轻度神经功能缺损;2分,行走时大鼠身体向瘫痪侧转圈,为中度神经功能缺损;3分,行走时大鼠身体向瘫痪侧倾倒,为重度神经功能缺损;4分,不能自发性走并伴有意识障碍。选取实验第7天的评分结果进行分析。
2.5 苏木素-伊红(HE)染色考察大鼠脑组织病理变化
造模7 d后,再次麻醉大鼠,以0.9%氯化钠溶液进行心脏灌注后,断头取脑,将脑组织置于4%多聚甲醛固定,固定结束后进行切片、二甲苯脱蜡、乙醇梯度脱水、苏木素染色、清洗、伊红染色、乙醇梯度脱水、封片,于显微镜下观察并拍照,采用Image J软件分析缺血侧脑组织海马CA1区的病理损伤情况,计算每个视野下的总细胞数和损伤细胞数,计算细胞损伤率。
细胞损伤率=损伤细胞数/总细胞数
2.6 尼氏染色测定神经细胞的损伤
取各组大鼠损伤侧脑组织,置于4%多聚甲醛固定,固定结束后进行切片、脱蜡、甲基紫染色、冲洗、分化、封片,于显微镜下观察并拍照,采用Image J软件统计单位面积下尼氏体染色阳性数。
2.7 荧光双标法测定大鼠海马区BMSCs和NSE表达
取各组大鼠损伤侧脑组织,固定后切片,石蜡切片脱蜡,置于盛满EDTA抗原修复缓冲液(pH 8.0)的修复盒中,于微波炉进行抗原修复;滴加3% BSA孵育30 min进行封闭,滴加兔抗大鼠NSE单克隆一抗(1∶500),湿盒内4 ℃孵育过夜;滴加FITC标记的山羊抗兔荧光二抗(1∶500),加入自发荧光淬灭剂5 min,流水冲洗10 min;滴加DAPI染液,封片,烘干后于显微镜下观察并拍照,BMSCs为自发的红色荧光,NSE为FITC标记的绿色荧光。采用Image J软件分析BMSCs和NSE共表达区的荧光强度,以荧光强度表示蛋白表达。
2.8 Western blotting检测大鼠脑组织BDNF和GDNF蛋白表达
取大鼠大脑患侧视交叉后3~4 mm脑组织25 mg,提取总蛋白,采用BCA蛋白定量法测定蛋白质量浓度,蛋白样品经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转至PVDF膜,于5%脱脂牛奶中封闭1~2 h,分别加入兔抗大鼠β-actin单克隆抗体(1∶10 000)、兔抗大鼠BDNF单克隆抗体(1∶8000)、兔抗大鼠GDNF单克隆抗体(1∶8000),4 ℃孵育过夜;TBST清洗3次,再加入山羊抗兔二抗(1∶10 000),37 ℃孵育1 h,TBST洗膜后,显影,采用Image Lab软件分析条带灰度值。
2.9 统计分析
3 结果
3.1 BMSCs的鉴定
如图1所示,BMSCs表面抗原CD29、CD90、CD34、CD45阳性率分别为80.4%、88.1%、4.5%、10.4%,原代细胞符合BMSCs表面抗原特征,鉴定为BMSCs。
3.2 AST IV与PNS配伍联合BMSCs对大鼠神经功能评分的影响
如图2所示,与对照组比较,模型组大鼠出现明显的神经功能障碍,神经功能评分显著升高(<0.01);与模型组比较,各给药组神经功能评分显著降低(<0.05、0.01);与AST IV+PNS低、高剂量组比较,BMSCs输注联合AST IV+PNS低、高剂量组神经功能评分显著下降(<0.01);与BMSCs输注组比较,BMSCs输注联合AST IV+PNS低、高剂量组神经功能评分显著降低(<0.01)。
3.3 AST IV与PNS配伍联合BMSCs对脑组织形态损伤的影响
如图3、4所示,对照组海马CA1区无明显病理学改变,锥体细胞排列整齐规则,形态完整,胞核饱满,核仁清晰,染色质分布均匀。与对照组比较,模型组CA1区锥体细胞缺失较多,而且残留的锥体细胞排列不整齐,形态不完整,多数锥体细胞的细胞核固缩,核仁不清晰,细胞损伤率显著升高(<0.01)。与模型组比较,各给药组细胞损伤率显著降低(<0.05、0.01);与AST Ⅳ+PNS低、高剂量组比较,AST Ⅳ+PNS低、高剂量组联合BMSCs输注组细胞损伤率显著降低(<0.01);与BMSCs输注组比较,BMSCs输注联合AST Ⅳ+PNS低、高剂量组细胞损伤率显著降低(<0.01)。
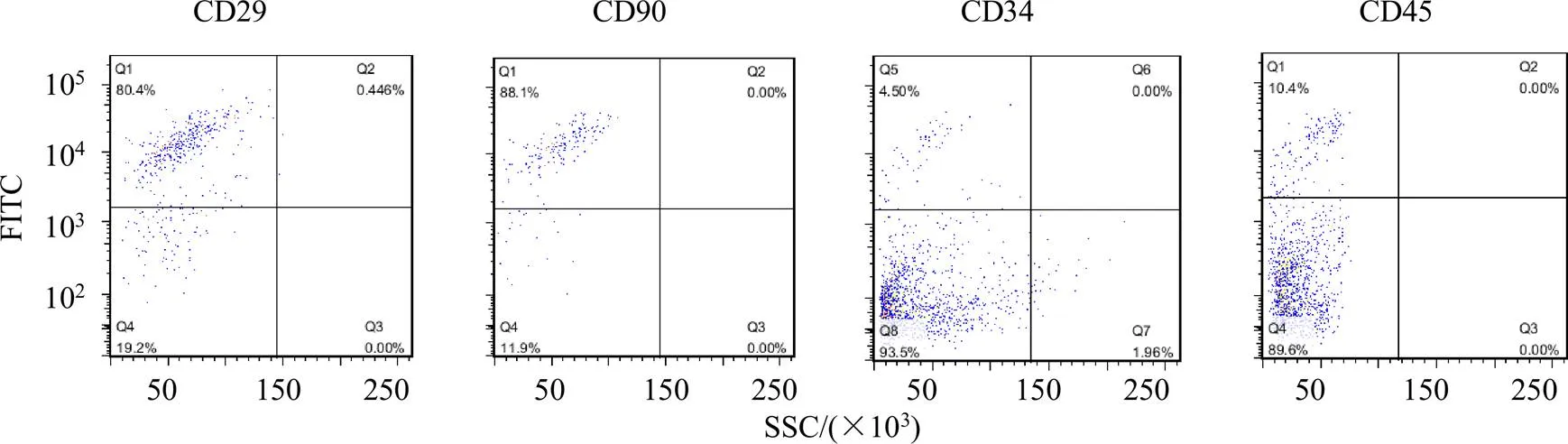
图1 流式细胞术检测BMSCs表面抗原

1-对照组 2-模型组 3-AST IV+PNS低剂量组 4-AST IV+PNS高剂量组 5-BMSCs输注组 6-BMSCs输注联合AST IV+PNS低剂量组 7-BMSCs输注联合AST IV+PNS高剂量组 与对照组比较:##P<0.01;与模型组比较:▲P<0.05 ▲▲P<0.01;与BMSCs输注联合AST IV+PNS低剂量组比较:**P<0.01;与BMSCs输注联合AST IV+PNS高剂量组比较:&&P<0.01;与BMSCs输注组比较:■■P<0.01,图4、7同
3.4 AST IV与PNS配伍联合BMSCs对大鼠海马区尼氏体数目的影响
如图5和表1所示,对照组海马CA1区神经元胞质内可见大量深蓝色斑块状尼氏体;与对照组比较,模型组尼氏体数量显著减少(<0.01);与模型组比较,AST Ⅳ+PNS低、高剂量组以及BMSCs输注组、BMSCs输注联合AST Ⅳ+PNS低、高剂量组尼氏体数量显著增加(<0.01);与AST Ⅳ+PNS低、高剂量组比较,AST Ⅳ+PNS低、高剂量联合BMSCs输注组尼氏体数量显著增多(<0.01);与BMSCs输注组比较,BMSCs输注联合AST Ⅳ+PNS低、高剂量组尼氏体数量显著增多(<0.01)。
3.5 AST IV与PNS配伍联合BMSCs对大鼠脑组织NSE蛋白表达的影响
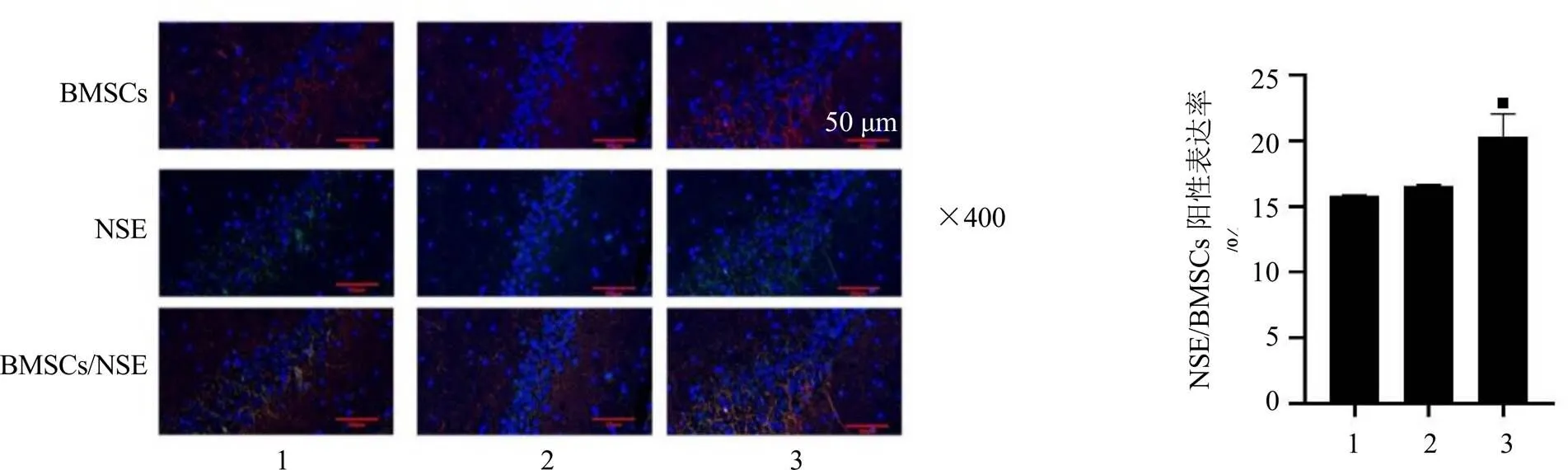
如图6所示,与BMSCs输注组比较,BMSCs输注联合AST IV+PNS高剂量组海马区NSE/ BMSCs阳性表达显著升高(<0.05)。
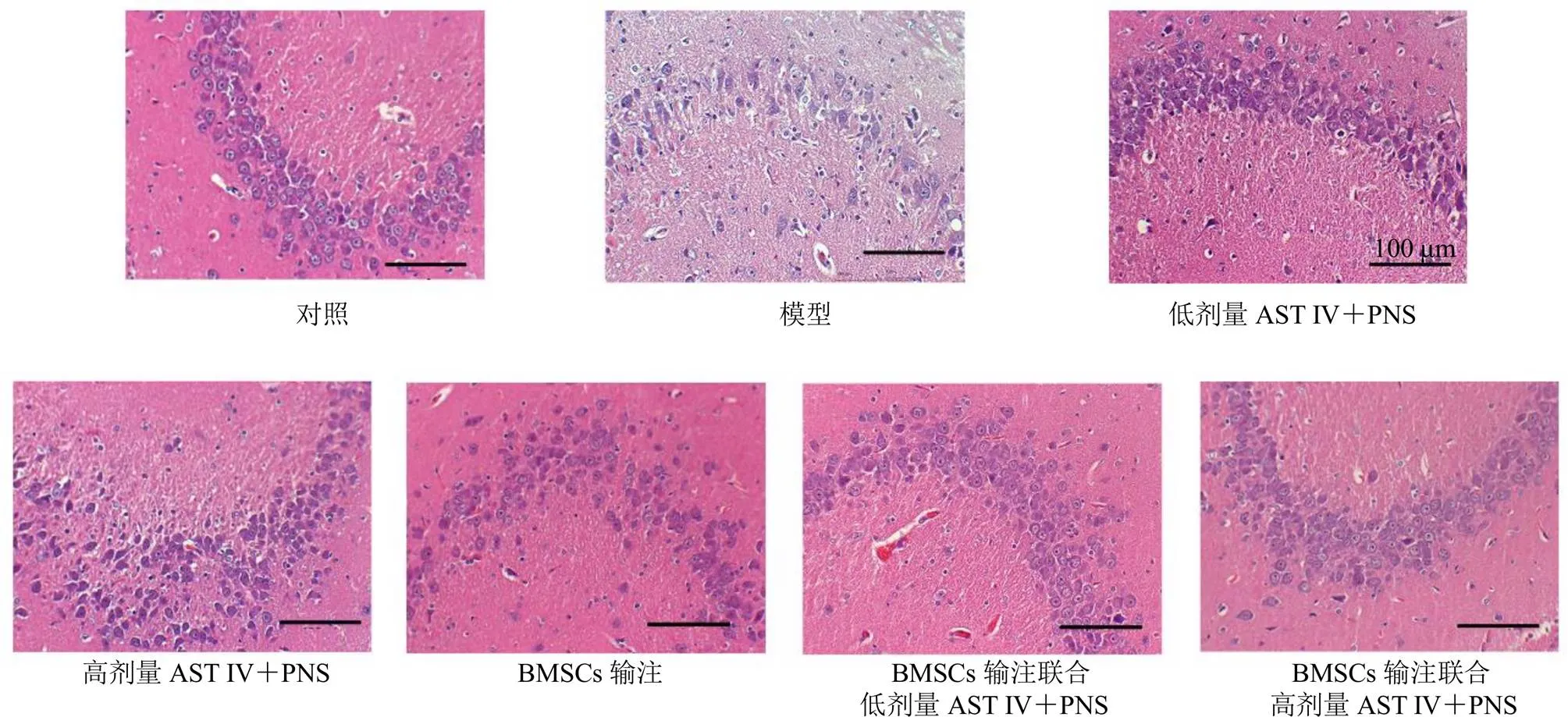
图3 AST IV与PNS配伍联合BMSCs对大鼠脑组织海马区病理变化的影响(HE, ×200)
3.6 AST IV与PNS配伍联合BMSCs对大鼠脑组织BDNF和GDNF蛋白表达的影响
如图7所示,与对照组比较,模型组大鼠脑组织BDNF和GDNF蛋白表达水平显著升高(<0.01);与模型组比较,各给药组BDNF蛋白表达水平显著升高(<0.01),AST Ⅳ+PNS低、高剂量组以及BMSCs输注组GDNF蛋白表达水平显著降低(<0.05),BMSCs输注联合AST Ⅳ+PNS低、高剂量组GDNF蛋白表达水平显著升高(<0.01);与AST Ⅳ+PNS低、高剂量组比较,BMSCs输注联合AST Ⅳ+PNS低剂量组BDNF和GDNF蛋白表达水平显著升高(<0.01),BMSCs输注联合AST Ⅳ+PNS高剂量组脑组织BDNF蛋白表达水平显著降低(<0.01),GDNF蛋白表达水平显著升高(<0.01)。

图4 AST IV与PNS配伍联合BMSCs对大鼠脑组织海马区细胞损伤率的影响(, n = 5)
4 讨论
缺血性脑损伤的病理是一个复杂的级联反应,目前已知的病理机制主要有兴奋性氨基酸毒性、氧自由基过度生成、Ca2+超载、炎性反应等,这些病理反应引起的微环境变化发生在脑缺血的各个阶段且相互作用[9],造成血脑屏障破坏、血管损伤、神经细胞肿胀,发生炎型反应,产生大量的有害因子,进一步加重脑损伤。针对脑缺血后的各种损伤变化,对神经细胞给予及时的保护,对减少神经功能缺损、改善预后具有重要意义。BMSCs是一种多能干细胞,具有来源广、易培养、低免疫原性和无伦理学争议的优势,可作为治疗神经系统疾病的理想种子[10],其治疗神经系统疾病的主要方式为直接修复和间接修复:直接修复是BMSCs直接分化神经细胞参与组织的修复和再生;间接修复则是BMSCs通过分泌一些物质从而达到组织的修复作用[11-12]。但单一的BMSCs移植后在实验动物脑内存活率低和定向分化为神经细胞的能力不足,这可能与缺血后脑内微环境的改变有关。
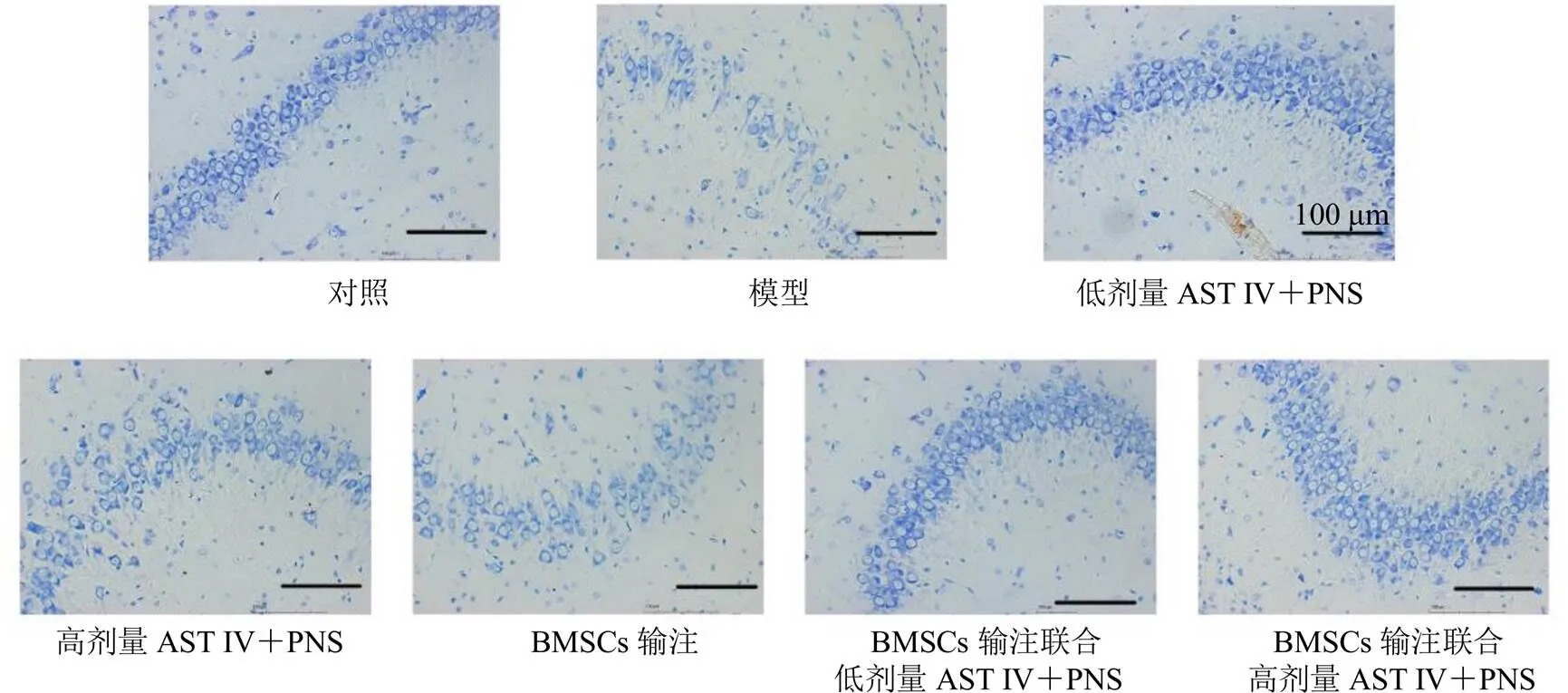
图5 AST IV与PNS配伍联合BMSCs对大鼠海马区尼氏体的影响 (×200)

表1 AST IV与PNS配伍联合BMSCs对大鼠海马区尼氏体数目的影响(, n = 5)
与对照组比较:##<0.01;与模型组比较:▲▲<0.01;与BMSCs输注联合AST IV+PNS低剂量组比较:**<0.01;与BMSCs输注联合AST IV+PNS高剂量组比较:&&<0.01;与BMSCs输注组比较:■■<0.01
#< 0.05##< 0.01control group;▲< 0.05▲▲< 0.01model group;**< 0.01BMSCs infusion combined with AST IV + PNS low dose group;&&< 0.01BMSCs infusion combined with AST IV + PNS high dose group;■■< 0.01BMSCs infusion group
传统医学认为,脑缺血属于脑卒中范畴,气虚血瘀为其主要病机,益气活血法为其主要治法。黄芪和三七是治疗心脑血管的主要有效中药,黄芪益气,三七活血,两者配伍具有益气活血的功效。本课题组前期对黄芪和三七的有效组(成)分配伍抗缺血性脑损伤的作用进行了系统研究[13-17],发现AST IV配伍PNS可减轻脑组织炎型反应、抑制神经细胞凋亡、改善脑组织能量代谢、提高脑缺血后神经细胞存活率、促进神经功能的修复,进而改善脑缺血后微环境;最新研究发现[7],AST IV配伍PNS在体外可促进BMSCs向神经元和星形胶质细胞分化。
1-BMSCs输注组 2-BMSCs输注联合AST IV+PNS低剂量组 3-BMSCs输注联合AST IV+PNS高剂量组 与BMSCs输注组比较:■P<0.05
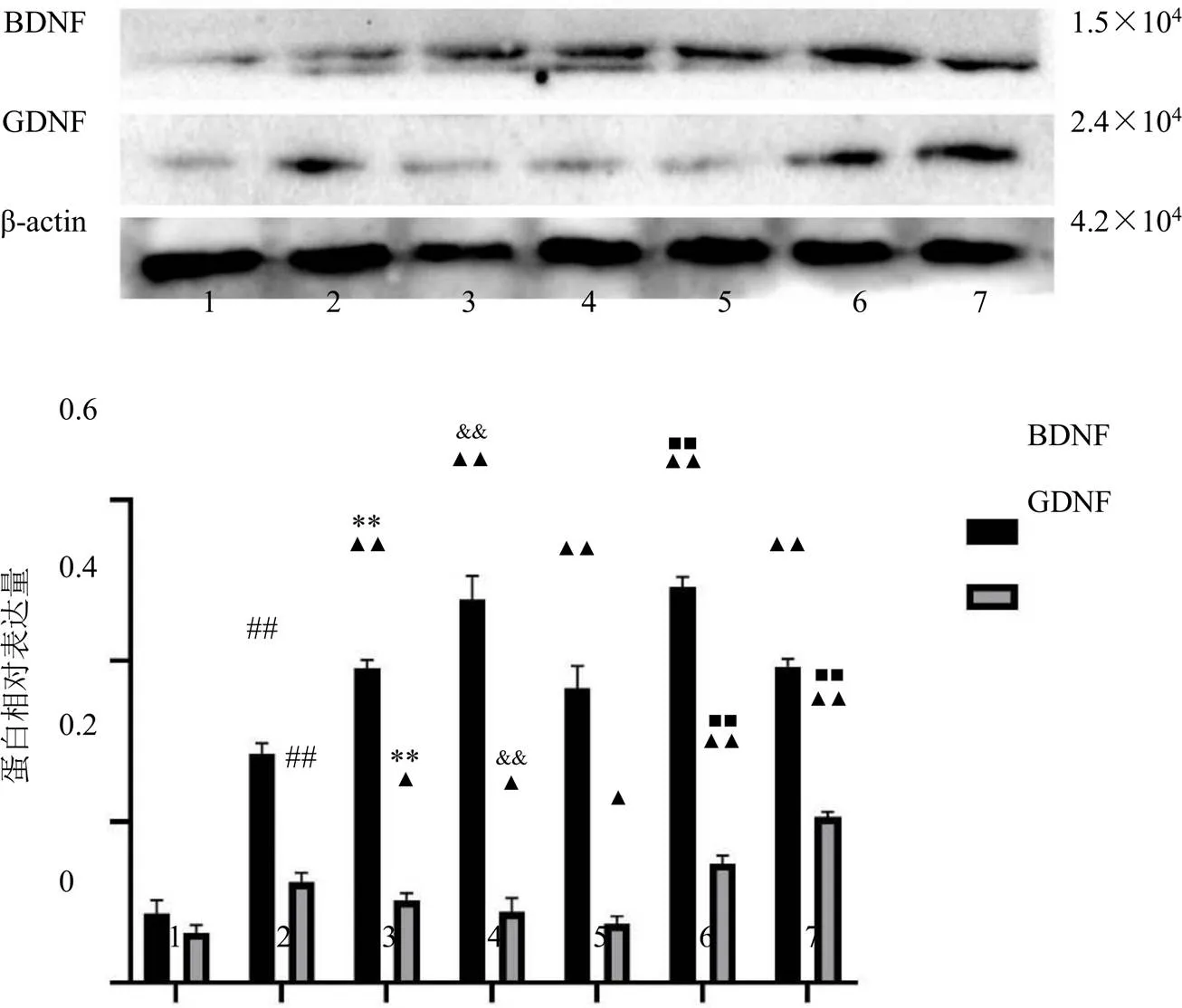
图7 AST IV与PNS配伍联合BMSCs对大鼠脑组织BDNF和GDNF蛋白表达的影响(, n = 5)
为进一步验证AST IV配伍PNS是否能够改善脑缺血后微环境,促进BMSCs移植后细胞的存活、增殖及定向分化,减轻脑缺血后神经损伤,本研究建立MCAO模型,探究AST IV配伍PNS对脑缺血大鼠BMSCs移植后神经修复的影响。结果显示,MCAO损伤后,动物发生明显的神经功能缺损,脑组织发生病理损伤,尼氏体明显减少,提示脑缺血可导致大鼠脑组织损伤;各给药组均能不同程度减轻脑组织损伤,且BMSCs输注与药物联用组疗效最佳;脑缺血后BDNF和GDNF蛋白表达水平升高,提示脑缺血后脑内微环境会发生应激变化,AST IV配伍PNS低、高剂量组以及BMSCs输注组、BMSCs输注联合药物低、高剂量组均能够促进BDNF蛋白表达,BMSCs输注联合药物低、高剂量组均能够促进GDNF蛋白表达,但与BMSCs输注联合药物相比,BMSCs输注组效果不佳,可能与缺血微环境改变有关,提示AST Ⅳ配伍PNS主要通过促进BDNF和GDNF蛋白表达改善缺血后微环境,从而促进BMSCs移植后的存活和增殖。此外,BMSCs输注联合药物组的免疫荧光共染结果显示,NSE/BMSCs阳性表达升高,提示药物可促进BMSCs向神经元的分化。
综上所述,本研究发现AST IV配伍PNS一方面可减轻脑缺血后的脑组织损伤,促进BMSCs的存活,另一方面可通过改善脑缺血后的微环境促进BMSCs向神经元分化,发挥神经修复的作用。
利益冲突 所有作者均声明不存在利益冲突
[1] Zhang Q, Zhao Y H, Xu Y H,. Sodium ferulate and-butylidenephthalate combined with bone marrow stromal cells (BMSCs) improve the therapeutic effects of angiogenesis and neurogenesis after rat focal cerebral ischemia [J]., 2016, 14(1): 223.
[2] 陈亚男. 红景天苷通过ERK1/2和PI3K/AKT/mTOR信号通路介导小鼠骨髓间充质干细胞向神经元样细胞定向分化的研究 [D]. 兰州: 兰州大学, 2014.
[3] 车冠华, 戴支凯. 中药诱导骨髓间充质干细胞分化为神经样细胞的研究进展 [J]. 当代医学, 2015, 21(8): 14-16.
[4] 江羽, 王叶叶, 梁晨, 等. 经木香烃内酯诱导的骨髓间充质干细胞用于治疗脑缺血再灌注损伤的研究 [J]. 世界科学技术—中医药现代化, 2019, 21(4): 573-579.
[5] 黄小平, 谭华, 陈北阳, 等. 黄芪总苷和三七总皂苷配伍对脑缺血再灌注后MMP-9和TIMP-1表达的影响 [J]. 中国中药杂志, 2010, 35(16): 2187-2191.
[6] 丁煌, 唐三, 杨筱倩, 等. 冰片配伍黄芪甲苷与三七总皂苷对脑缺血/再灌注后血脑屏障通透性的影响 [J]. 中国药理学通报, 2019, 35(11): 1516-1523.
[7] 刘晓丹, 丁煌, 邓常清. 黄芪甲苷配伍三七总皂苷对OGD/R大鼠骨髓间充质干细胞增殖、凋亡、迁移及神经分化的影响 [J]. 中草药, 2019, 50(23): 5795-5801.
[8] Longa E Z, Weinstein P R, Carlson S,. Reversible middle cerebral artery occlusion without craniectomy in rats [J]., 1989, 20(1): 84-91.
[9] 孔令提, 宋春丽, 石庆平. 人参皂苷对脑缺血再灌注损伤的保护机制研究现状 [J]. 中国药房, 2019, 30(17): 2445-2448.
[10] Schmal H, Niemeyer P, Roesslein M,. Comparison of cellular functionality of human mesenchymal stromal cells and PBMC [J]., 2007, 9(1): 69-79.
[11] 刘淑艳, 刘莲娜, 杨亦青. 间充质干细胞应用研究进展 [J]. 河北北方学院学报: 自然科学版, 2020, 36(10): 61-65.
[12] 戚亚钦, 方燕. 间充质干细胞及其迁移的研究进展 [J]. 临床医学研究与实践, 2021, 6(6): 184-186.
[13] Huang X P, Ding H, Lu J D,. Effects of the combination of the main active components ofandon inflammation and apoptosis of nerve cell after cerebral ischemia-reperfusion [J]., 2015, 43(7): 1419-1438.
[14] Huang X P, Ding H, Yang X Q,. Synergism and mechanism of astragaloside IV combined with ginsenoside Rg1against autophagic injury of PC12 cells induced by oxygen glucose deprivation/reoxygenation [J]., 2017, 89: 124-134.
[15] 黄小平, 刘晓丹, 邓常清. 黄芪和三七主要有效成分配伍对氧化损伤所致的PC12细胞凋亡及其活性氧、线粒体膜电位的影响 [J]. 中西医结合学报, 2012, 10(10): 1127-1134.
[16] 欧阳波, 刘晓丹, 杨筱倩, 等. 冰片配伍黄芪甲苷和三七总皂苷通过Notch信号通路对大鼠脑缺血再灌注损伤模型的神经保护作用 [J]. 中草药, 2020, 51(23): 5990-5997.
[17] 刘晓丹, 邓常清. 黄芪甲苷和三七总皂苷中主要有效成分抗PC12细胞氧化损伤的配伍研究 [J]. 湖南中医药大学学报, 2012, 32(1): 8-12.
Effect of astragaloside IV combined withsaponins on nerve repair after BMSCs transplantation in rats with cerebral ischemia
LI Yan-ling, DING Huang, FU Xin-ying, TANG San, LU Zhan-hui, YANG Fu-rong, LIU Xiao-dan, DENG Chang-qing
Hunan Provincial Key Laboratory of Cell Biology and Molecular Technology, Hunan Provincial Key Laboratory of Integrated Traditional Chinese and Western Medicine, Hunan University of Traditional Chinese Medicine, Changsha 410208, China
To investigate the effect of astragaloside IV (AST IV) andsaponins (PNS) combined with bone marrow mesenchymal stem cells (BMSCs) transplantation on neural function repair in rats with cerebral ischemia.Rats were randomly divided into control group, model group, AST IV (10 mg/kg) + PNS (25 mg/kg) low dose group, AST IV (20 mg/kg) + PNS (50 mg/kg) high dose group, BMSCs infusion group, BMSCs infusion combined with AST IV (10 mg/kg) and PNS (25 mg/kg) low dose group, BMSCs infusion combined with AST IV (20 mg/kg) and PNS (50 mg/kg) high dose group. BMSCs were isolated and purified by whole bone marrow adherent method. The positive expression rates of CD29, CD90, CD34 and CD45 were detected by flow cytometry. Each drug administration group was given drugs for intervention, model of focal cerebral ischemia was established by middle cerebral artery occlusion (MCAO). Longa method was used to determine the symptoms of neurological deficits in each group of rats; Hematoxylin-eosin (HE) staining and Nissl staining were used to determine the pathological changes in brain tissue of each group of rats; Immunofluorescence was used to detect positive expressions of neuron specific enolase (NSE) and BMSCs in hippocampus of rats in each group; Western blotting was used to determine brain-derived neurotrophic factor (BDNF) and glial cell-derived neurotrophic factor (GDNF) protein expressions in brain tissue of rats in each group.BMSCs were isolated and cultured successfully. The surface markers CD29, CD90, CD34 and CD45 were identified to be in accordance with the characteristics of BMSCs. Neurologic defects and pathological damage of brain tissue occurred after cerebral ischemia. Neurological deficit score and brain tissue cell damage rate in model group were significantly increased (< 0.01), and number of Nissl bodies was significantly reduced (< 0.01). Each administration group alleviated the above-mentioned pathological changes to varying degrees. Among them, the strongest effect was BMSCs infusion combined with AST Ⅳ + PNS high dose group (< 0.01), which was better than the single drug and BMSCs infusion. Neurons were damaged after cerebral ischemia in rats. After BMSCs infusion, cells could proliferate and differentiate into neurons in ischemic brain tissue. The infusion of drugs and BMSCs could enhance the proliferation and differentiation of BMSCs in brain of rats. After cerebral ischemia in rats, BDNF and GDNF protein expressions were increased, and each drug group could increase their expression to varying degrees. Among them, the strongest effect was BMSCs infusion combined with AST IV + PNS group (< 0.01), which was better than single drug and BMSCs infusion.AST Ⅳ combined with PNS can promote the survival of bone marrow mesenchymal stem cells transplantation and repair the damaged neurons after cerebral ischemia. The mechanism may be related to improve the local microenvironment after cerebral ischemia and promote the survival, proliferation and differentiation of transplanted stem cells.
astragaloside IV;saponins; BMSCs; cerebral ischemia; proliferation; migration; neural differentiation
R285.5
A
0253 - 2670(2021)21 - 6537 - 08
10.7501/j.issn.0253-2670.2021.21.011
2021-04-19
国家自然科学基金资助项目(81904181);湖南省自然科学基金资助项目(2018JJ3382);湖南省教育厅优秀青年项目(18B236);湖南省科技厅科技创新平台与人才计划项目(2017SK4005);湖南中医药大学研究生创新课题(2020CX63)
李艳玲(1995—),女,硕士研究生,研究方向为心脑血管疾病的中医药防治。Tel: 15108955149 E-mail: 374038521@qq.com
邓常清(1963—),男,教授,博士生导师,从事心脑血管疾病及中药(成)分配伍研究。Tel: (0731)88458710 E-mail: dchangq@sohu.com
刘晓丹(1985—),女,实验师,研究方向为心脑血管疾病的中医药防治。E-mail: 314086131@qq.com
[责任编辑 李亚楠]
