头穴丛刺调控NF-κB信号通路介导阿尔茨海默病炎症反应的机制研究*
2021-11-08武文鹏谷栩萌孙兴华王春霞
武文鹏,谷栩萌,孙兴华,王春霞△
(1.黑龙江中医药大学附属第二医院,黑龙江 哈尔滨 150001;2.黑龙江中医药大学,黑龙江 哈尔滨 150040)
阿尔茨海默病(Alzheimer’sdisease,AD)又称为老年性痴呆,是一种常见的老年神经系统变性病[1-3],以进行性的智能衰退、精神行为异常为临床表现[4-5],以老年斑及神经元纤维缠结为病理特征[6-8]。随着人口老年化加剧,阿尔茨海默病的发病率呈逐年增加的趋势,且已成为仅次于恶性肿瘤和心脑血管疾病的重要致死性疾病。迄今尚无有效的预防与治疗阿尔茨海默病的策略[9-10]。已有研究表明,炎症反应参与阿尔茨海默病的发生与发展的过程,慢性持续性神经炎症反应可导致阿尔茨海默病渐进性神经损伤[11-13]。针灸疗法在阿尔茨海默病的防治中发挥着重要作用,并被广泛应用于临床[14-16]。但有关针刺调控阿尔茨海默病神经炎症反应的研究较少。因此,本研究从神经炎症反应通路入手,通过双侧海马区注射Aβ制备大鼠AD模型,通过测定IL-1β、IL-6及TNF-α的mRNA转录水平和COX-2、NF-κB的蛋白表达水平,探讨头穴丛刺对NF-κB信号通路的调控,了解其抗炎反应机制。
1 材料与方法
1.1 主要仪器与试剂
1.1.1 仪器 大鼠脑立体定位仪(成都泰盟科技有限公司);超速冷冻离心机(型号:H-2050R,湖南湘仪实验室仪器开发有限公司);荧光定量PCR仪(型号:Exicycler 96,韩国BIONEER公司);徕卡RM2135型切片机(德国Leica);Moticam3000显微摄影成像系统(美国Motic公司);LKB-V型超薄切片机(瑞士BROMMA公司)。
1.1.2 试剂 淀粉样β蛋白片段1-42(批号:MB3894,大连美伦生物技术有限公司);COX-2免疫组化试剂盒(货号:BA3708,武汉博士德生物公司);NF-κB免疫组化试剂盒(货号:A00284-1,武汉博士德生物公司);兔抗多克隆一抗(北京博奥森生物技术有限公司);兔抗多克隆二抗PV6001(北京中杉金桥生物技术有限公司);DAB显色剂(北京中杉金桥生物技术有限公司);IL-1β ELISA试剂盒(货号:EK0393,武汉博士德生物公司);IL-6 ELISA试剂盒(货号:EK0412,武汉博士德生物公司);TNF-α ELISA试剂盒(货号:EK0526,武汉博士德生物公司);TRIpure(货号:RP1001,北京百泰克生物技术有限公司);Super M-MLV反转录酶(货号:PR6502,北京百泰克生物技术有限公司);RNase inhibitor(货号:RP5602,北京百泰克生物技术有限公司);2×Power Taq PCR MasterMix(货号:PR1702,北京百泰克生物技术有限公司);SYBR Green(货号:SY1020,北京百泰克生物技术有限公司)。
1.2 实验动物与分组
1.2.1 实验动物 SPF级Wistar大鼠70只,雄性,3月龄,体质量(220±20)g,购买于黑龙江中医药大学实验动物中心[许可证号:SYXK(黑)2016004]。
1.2.2 动物分组 适应性饲养7 d后将过于迟钝或反应特别敏感的大鼠剔除,保留60只大鼠作为实验用。按随机原则,分出12只为正常组,再分出12只为假手术组,其余大鼠用于AD模型制备。取AD造模成功大鼠24只,按照随机数字表法分为模型组和头穴丛刺组,每组各12只。
1.3 AD模型制备
采用双侧海马内注射Aβ1-42诱导AD模型。采用1%戊巴比妥钠(45 mg/kg)腹腔注射进行麻醉,固定大鼠于脑立体定位仪上,以Bregma为0点,向后3 mm,左右旁开1.5 mm,钻颅骨打孔,应用微量进样器经打孔处进针,深入颅内3 mm,将Aβ1-42溶液2.5 μg/μL缓慢注入,注射速度为0.5 μL/min,留针5 min。退针后,缝合头皮并切口消毒。假手术组除用等量生理盐水代替Aβ1-42溶液外,其余同模型组。
1.4 干预方法
1.4.1 头穴丛刺组 造模成功后第7天开始,参照《实验针灸学》[17]取穴,取百会穴及百会穴左侧旁开1 mm处、百会穴右侧旁开1 mm,用0.35 mm×15 mm毫针针刺,针刺深度约2 mm,每穴平补平泻快速捻转1 min,留针30 min,1次/d,连续干预14 d。
1.4.2 正常组 不给予任何处理,正常饲养。
1.4.3 假手术组、模型组 同时段抓取、捆绑固定30 min,不进行其他处理。
1.5 检测指标
1.5.1 免疫组化法检测海马组织COX-2、NF-κB的表达 最后1次Morris水迷宫实验结束后,每组取6只大鼠,大鼠腹腔注射10%水合氯醛(300 mg/kg)麻醉,断头取脑组织,在冰台上剥离双侧海马组织,并称重,将样品放入4%多聚甲醛固定液中固定48 h。随后进行脱水、透明、浸蜡、组织包埋及切片。切片常规脱蜡到水,按照免疫组化试剂盒说明书进行具体步骤,微波修复、滴加一抗、滴加二抗、DAB显色、苏木素复染、常规脱水透明和中性树胶封片,Motic3000显微摄影系统下采集图片,并统计阳性细胞数。
1.5.2 实时荧光定量PCR法检测海马组织IL-1β、IL-6及TNF-α mRNA的表达 采用实时荧光定量PCR法,取各组大鼠海马组织,使用TRIpure试剂盒提取总RNA,进行一步法RT-PCR反应,检测IL-1β、IL-6及TNF-α水平。反应体积20 μL cDNA样本。反应体系含cDNA模板1 μL、上下游引物(10 μM)各0.5 μL和SYBR GREEN mastermix10 μL,用ddH2O补足至20 μL。引物设计由生工生物工程(上海)有限公司根据Real-time PCR引物设计原则合成。IL-1β、IL-6及TNF-α基因序列:IL-1β基因序列上下游引物分别为:ATGGCAACTGTTCCTGAACTCAACT和CAGGACAGGTATAGATTCTTTCCTTT,扩增长度257 bp;IL-6基因序列上下游引物分别是:GTTGCCTTCTTGGGACTGATG和TACTGGTCTGTTGTGGGTGGT,扩增长度102 bp;TNF-α基因序列上下游引物分别是:CATCTTCTCAAAATTCGAGTGACAA和TGGGAGTAGACAAGGTACAACCC,扩增长度175 bp。基因β-actin基因序列引物上下游引物分别是:CATCCGTAAAGACCTCTATGCCAAC和ATGGAGCCACCGATCCACA,扩增长度171 bp。Real-time PCR仪反应条件:94.00 ℃,5 min;94.00 ℃,10 s;60.00 ℃,20 s;72.00 ℃,30 s;共40个循环。反应结束后,进行溶解曲线分析。根据RealTimePCR原始检测结果,按照2-△△ct相对定量计算公式计算出各样品的目的基因相对定量结果。
1.6 统计学处理
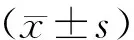
2 结果
2.1 各组大鼠海马组织COX-2、NF-κB的表达比较
与正常组比较,假手术组大鼠海马组织COX-2、NF-κB表达量差异无统计学意义(P>0.05)。与假手术组比较,模型组大鼠海马组织COX-2、NF-κB表达量显著升高(P<0.01)。与模型组比较,头穴丛刺组大鼠海马组织COX-2、NF-κB表达量明显降低(P<0.05)。见表1、图1。
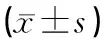
表1 各组大鼠海马组织COX-2、NF-κB的表达比较
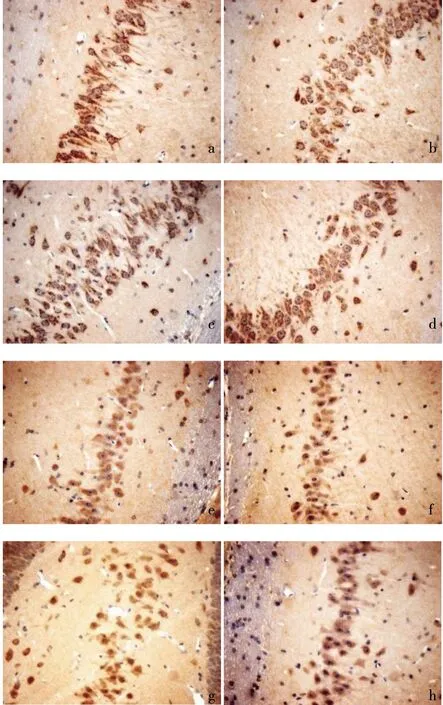
注:COX-2:a.正常组;b.假手术组;c.模型组;d.针刺组。NF-κB:e.正常组;f.假手术组;g.模型组;h.针刺组。图1 各组大鼠海马组织HE染色图(400×)
2.2 各组大鼠海马组织IL-1β、IL-6及TNF-α mRNA表达比较
与正常组比较,假手术组大鼠海马组织IL-1β、IL-6及TNF-α基因mRNA表达水平差异均无统计学意义(P>0.05)。与假手术组比较,模型组大鼠海马组织IL-1β、IL-6及TNF-α基因mRNA表达水平均显著升高(P<0.01)。与模型组比较,头穴丛刺组大鼠海马组织IL-1β、IL-6及TNF-α基因mRNA表达水平均明显降低(P<0.05)。见表2、图2。
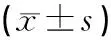
表2 各组大鼠海马组织IL-1β、IL-6及TNF-α mRNA表达比较

注:a、b:IL-1β基因实时扩增曲线图及产物溶解曲线图;c、d:IL-6基因实时扩增曲线图及产物溶解曲线图;e、f:TNF-α基因实时扩增曲线图及产物溶解曲线图。图2 基因实时扩增曲线图及产物溶解曲线图
3 讨论
阿尔茨海默病是以细胞内的神经原纤维缠结(NFT)、细胞外的β-淀粉样蛋白(Aβ)斑块和神经元丢失为病理特征的多因素和异质性神经退行性疾病。阿尔茨海默病的病因及发病机制至今仍未明确,有β-淀粉样蛋白异常聚集、Tau蛋白过度磷酸化、线粒体功能障碍、神经炎症、氧化应激、代谢障碍胰岛素抵抗、兴奋性氨基酸毒性、突触功能障碍及菌群-肠-脑轴失调等假说[18-21]。不同假说的发病机制之间存在相互的作用,任何单一假说均不能完全解释阿尔茨海默病的发病全过程,为多种机制共同作用的结果。
阿尔茨海默病属于中医学“痴呆”范畴。中医学对本病的认识较早,如《景岳全书·杂病谟》曰:“痴呆证,凡平素无痰,而或以郁结,或以不遂,或以思虑,或以疑惑,或以惊恐,而渐至痴呆,言辞颠倒,举动不经……其证则千奇万怪,无所不至。”中医药在延缓阿尔茨海默病的进展及提高患者体质方面表现出一定的优势。头穴丛刺针法是以中医学经络理论和现代医学神经解剖理论为基础建立起来的以在头部相应治疗区进行“丛式”的针刺治疗疾病的一种方法,被广泛应用于神经系统疾病的临床治疗。课题组前期临床观察发现,头穴丛刺能够延缓阿尔茨海默病的进展,改善患者的认知功能。但有关头穴丛刺治疗阿尔茨海默病作用机制的研究报道较少。因此,探究中医药防治阿尔茨海默病的思路与途径具有重要的价值与意义。
神经炎症反应机制是近年来阿尔茨海默病研究的热点和焦点,被认为是阿尔茨海默病的发生发展的重要致病因素,其中细胞因子和免疫相关基因是关键的参与者,在阿尔茨海默病的病理生理学机制中发挥着重要作用[22-25]。有研究发现,在阿尔茨海默病患者的大脑中存在补体防御蛋白、细胞因子及急性期反应物等炎症指标[26]。β-淀粉样蛋白具有强烈的诱导神经元凋亡和DNA损伤的作用,β-淀粉样蛋白能够激活星形胶质细胞和小胶质细胞,并促进其释放炎症因子。小胶质细胞是中枢神经系统的主要免疫细胞,其重要的生理功能是通过分泌细胞因子维持组织环境的稳定,其释放的细胞因子包括促炎因子(如IL-6、IL-12、IL-18、IL-1β及TNF-α等)和抗炎因子(如TGF-β、IL-10等)。有研究表明,小胶质细胞不仅能够直接吞噬可溶性β-淀粉样蛋白,还能够通过细胞外蛋白酶对不可溶性寡聚体状态的β-淀粉样蛋白进行溶解[27]。当β-淀粉样蛋白异常聚集时,能够使炎症因子持续分泌,最终发展成慢性炎症反应,使神经元变性损伤加重,同时持续分泌的炎症因子能够下调细胞表面的β-淀粉样蛋白吞噬受体表达,进而影响小胶质细胞的吞噬功能。迄今为止,已有包括IL-1β、IL-6及TNF-α在内的13种细胞因子与阿尔茨海默病的发生发展有关[28]。IL-1β在体液和细胞免疫中起始动作用,能够诱发炎性反应,IL-1β过度表达能够使小胶质细胞表达TNF-α和IL-6等炎性因子上调,进而诱导β-淀粉样蛋白的前体蛋白过度生成。此外,在动物实验研究中发现,IL-1β过表达的阿尔茨海默病转基因小鼠可使其中枢神经系统慢性炎症反应加重;IL-1β能够诱导阿尔茨海默病动物模型大鼠皮质神经元发生Tau蛋白磷酸化等特征性病理改变[29]。TNF-α是免疫和炎症过程中的关键细胞因子,主要由免疫细胞释放,在机体的各个部位发挥着重要作用。在阿尔茨海默病患者尸检的脑组织β-淀粉样蛋白斑块周围发现TNF-α的存在,这是其参与阿尔茨海默病之间联系的直接证据[30]。IL-6作为免疫炎性调节因子,在维持细胞存活、能量代谢平衡及神经元稳态等方面发挥着重要作用。在阿尔茨海默病模型小鼠中发现IL-6过表达,并增加小胶质细胞对β-淀粉样蛋白的吞噬作用,同时增加TNF-α及其他炎性反应介质的释放[31]。本实验结果表明,模型组大鼠海马组织IL-1β、IL-6及TNF-α基因mRNA表达水平均显著升高,提示模型组大鼠神经炎性反应增强;与模型组比较,头穴丛刺组大鼠海马组织IL-1β、IL-6及TNF-α基因mRNA表达水平均明显降低,提示头穴丛刺能够抑制大鼠神经炎性反应。
NF-κB是细胞内重要的核转录因子,是大脑的多种神经元基因靶点,参与机体的神经传递、细胞生长、免疫应答、炎症反应、细胞凋亡及其应激反应等。β-淀粉样蛋白肽是老年斑的主要成分,其能够刺激NF-κB活性,而NF-κB抑制剂能够减少β-位点APP裂解酶1的生成及减少β-淀粉样蛋白前体的产生。有研究表明,NF-κB信号通路的激活在β-淀粉样蛋白前体被分泌酶活性蛋白水解而产生致病性β-淀粉样蛋白过程中起着重要作用[32-33]。致病性β-淀粉样蛋白聚集体能够使神经元细胞的炎症反应增强,导致IL-1β、IL-6及TNF-α等炎症因子大量释放。COX-2是NF-κB信号转导的靶基因之一,与阿尔茨海默病的炎性反应过程密切相关[34]。活化的NF-κB与其在COX-2启动区域的结合位点结合,能够促进COX-2表达,活化的COX-2通过炎症反应等导致脑损伤,进而参与阿尔茨海默病的发生发展[35]。本实验结果表明,模型组大鼠海马组织COX-2、NF-κB表达量显著升高,提示模型组大鼠COX-2、NF-κB活化增强;与模型组比较,头穴丛刺组大鼠海马组织COX-2、NF-κB表达量明显降低,提示头穴丛刺能够抑制COX-2、NF-κB活化。
综上所述,运用头穴丛刺针刺法能够抑制NF-κB通路蛋白表达而调控炎性细胞因子而减少阿尔茨海默病模型大鼠的炎性反应。
