玉米(玉米油)中黄曲霉毒素的检测与控制
2021-11-08邱立忠王德印刘鹏飞吴正宗李子松王爱月
邱立忠,王德印,刘鹏飞*,吴正宗,李子松,王爱月,崔 波*
1.齐鲁工业大学(山东省科学院) 食品科学与工程学院,济南 250353 2.诸城兴贸玉米开发有限公司,诸城 262218 3.山东兴泉油脂有限公司,莒南 276600
玉米作为世界上三大农作物之一,产量约占世界粗粮产量的65%,营养丰富。玉米油由玉米胚芽经过榨取、精炼等工艺提炼而成,富含不饱和脂肪酸(83%~90%)、亚油酸、磷脂质、维生素E、甾醇等物质,在国际上被称为营养保健油[1]。其本身不含有胆固醇,能够溶解血液中的胆固醇,避免血液中胆固醇的积累,减少对血管产生硬化影响;维生素E的存在,使玉米油能够有效预防冠状动脉心脏疾病,延缓衰老,在世界范围内备受追捧。然而,在生产加工过程中,玉米油极易被黄曲霉毒素(Aflatoxin :AFT)侵染。AFT是一种 Ⅰ 类致癌物质,是由黄曲霉和寄生曲霉产生的一类次生代谢产物,主要包括黄曲霉毒素B1(AFB1)、黄曲霉毒素B2(AFTB2)、黄曲霉毒素G1(AFTG1)、黄曲霉毒素G2(AFTG2)、黄曲霉毒素M1(AFTM1)和黄曲霉毒素M2(AFTM2)等,具有高致癌性。长期食用会导致人体免疫系统损伤,引起肝脏出血,诱发癌症。AFT在传统的烹饪中难以祛除,对人类健康具有较大的潜在威胁[2]。当下AFT的消减主要从三个方面进行:源头控制,贮藏期预防控制以及污染后控制。但是,目前AFT的控制技术还存在一定的缺陷,人为因素影响较大,难以保证对AFT的处理效果。从AFT在玉米、玉米油中的污染及AFT的危害、检测及控制与脱毒方法等方面阐述对玉米、玉米油中AFT的消减,以期对国内玉米、玉米油中AFT的消减提供参考,减少粮食浪费,确保食品安全。
1 玉米及玉米油中AFT的危害侵染情况
1.1 AFT的危害
有文献记载,AFB1最具毒性和致癌性。国际癌症研究机构已将其归类为人类第一类致癌物[3]。AFT是由黄曲霉和寄生曲霉所产生的一系列次生代谢产物,已知有多种类型,具有较大的毒害作用有四种,即AFB1、AFTB2、AFTG1和AFTG2。其中,AFB1的毒性最大,最早报道于1960年的英国,一经发现就造成了100 000只火鸡的死亡。AFT在进入人体后,会阻止细胞中RNA、DNA和蛋白质生物大分子的合成,从而对人体造成巨大损伤[4]。AFT中毒,有两种描述形式,一是因短暂接触大量AFT而引起的“急性中毒”,其特征是严重的肝脏损伤、出血、水肿和最终死亡;二是长期接触少量的AFT所形成的“慢性中毒”,使机体免疫抑制、营养失调,严重者还会产生癌症。已有研究指出,AFT与慢性乙型肝炎病毒(HBV)感染有关[5]。每年由AFB1诱导产生的人类肝细胞癌(HCC)造成的病例全球高达155 000例。目前,肝癌已成为世界第二大癌症,在中国癌症中占比19.33%。
1.2 玉米及玉米油中AFT的危害侵染情况
玉米是世界上重要的粮食作物和食品、饲料原料,由于生长环境、加工和贮藏等因素的影响,极易被霉菌污染,进而造成玉米油的污染。兰静等[6]报告,我国玉米中AFT污染情况与地域的水分含量有关,总体上,南方玉米中AFT的污染情况要高于北方。研究显示,我国北方玉米中AFB1检出率为91.4%,超标率为2.8%。南方区域饲用玉米AFB1检出率为93.3%,超标率高26.6%。高秀芬等[7]在对中国部分地区玉米中4种AFT污染调查中,收集了279份样品,发现其中AFT阳性率为75.63%,阳性样品平均浓度为44.04 μg/kg,浓度范围为0.20~888.30 μg/kg。杨晓倩等[8]采用超高效液相色谱串联质谱仪对2016年山东省90份鲜玉米真菌毒素进行监测,结果显示,AFT检出率为8.88%。然而,在玉米油中,AFT的超标率较低。李昕等[9]在2015年山东部分地区食用植物油中AFB1污染状况调查中指出玉米胚芽油超标率为0.00%,张毅[10]、刘辉[11]等报告也证明了这一点,这表明目前玉米油中AFT的消减技术已经形成完善的体系。
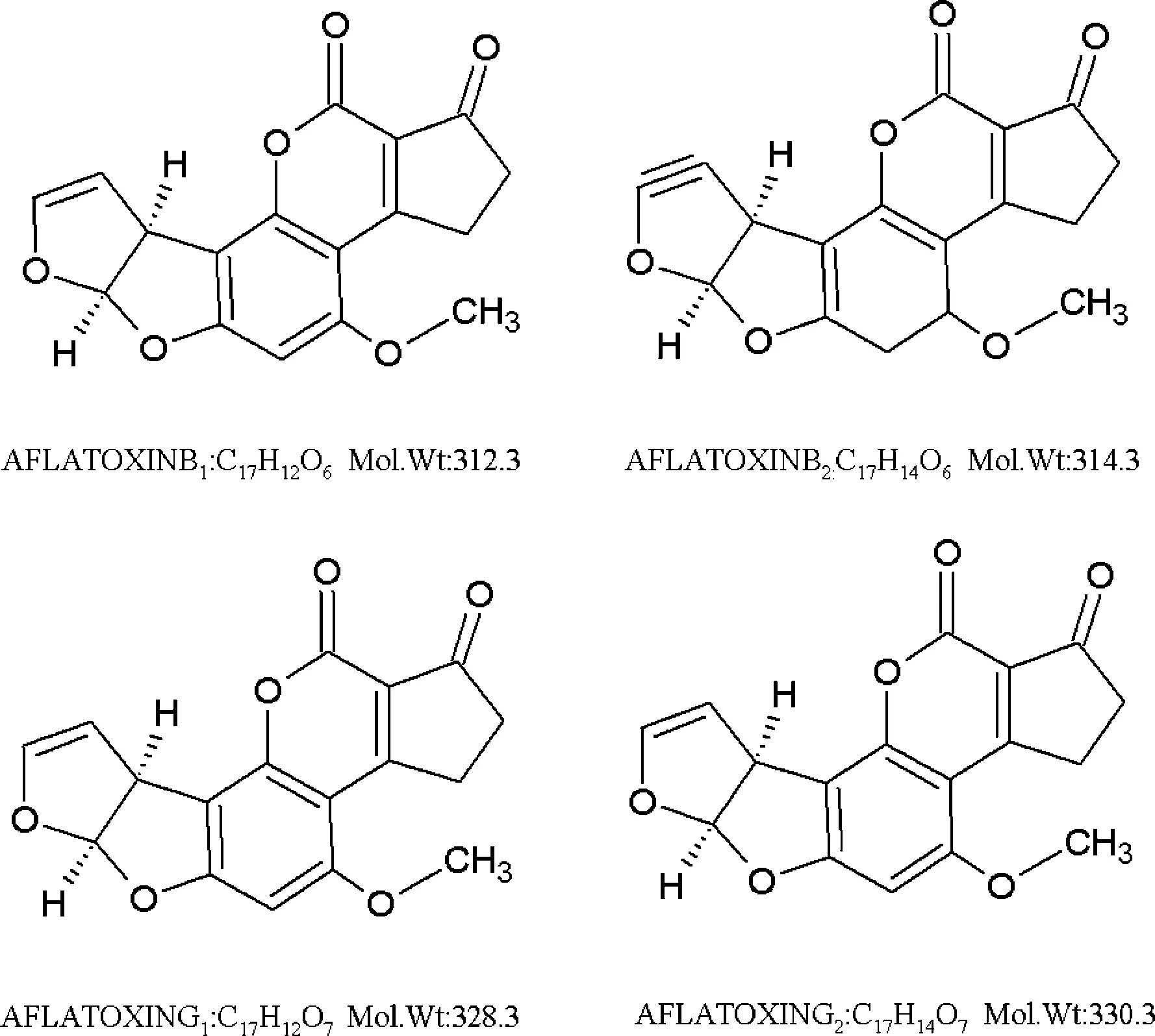
图1 四种常见的黄曲霉素毒素结构式

表1 玉米、玉米油中AFB1污染情况调查
2 AFT的限量标准
考虑到AFT对消费者健康的潜在危害,许多国家(地区)和组织都对食品和饲料中的AFT设定了最高限量。国际食品法典委员会(CAC)建议食品中AFT总量应保持在15 μg/kg以内;美国食品和药物管理局(FDA)规定,除牛奶外,所有食品中AFT总量的最大可接受限量为20 μg/kg;在欧盟,已经制定了更严格的规定,在花生、干果和谷类食品中,供人类直接食用或用作配料的AFB1和总AFT的最高允许含量分别为2 μg/kg和4 μg/kg;日本规定食品中AFT的总量要低于在10 μg/kg;南非法律规定食品中AFB1+AFB2+AFG1+AFG2≤10 μg/kg,其中,AFB1要低于5 μg/kg;印度、越南等众多国家和地区对AFT也都制定了限量标准。在中国,法律规定,供人食用的谷物产品中AFB1的限量范围为5~10 μg/kg,而动物饲料中的允许含量相对较高,达到20~50 μg/kg[19]。

表2 我国食品中AFB1限量指标 μg/kg

表3 不同地区玉米(玉米油)中黄曲霉毒素的限量标准 μg/kg
3 黄曲霉毒素的检测方法
国内外学者有很多对AFT的检测方法,但目前被广泛应用的主要有薄层色谱法(TLC)、高效液相色谱法(HPLC)、酶联免疫吸附筛查法(ELISA)和高效液相色谱-质谱法(LC-MS/MS)[20]。
3.1 TLC
TLC是检测真菌毒素最经典的方法。主要检测过程为样本提取、柱层析、洗脱、浓缩以及薄层分离等操作,是依据AFB1的荧光特性与标准样品比较从而进行定性、定量分析的一种分析方法[21]。在波长为365 nm的紫外灯照射下,AFTB1、AFTB2、AFTG1和AFTG2分别呈现出紫色、蓝紫色、绿色、绿色。TLC样品前处理简单、成本低廉,但费时费力、灵敏性不强,安全性低,目前食品安全工作者已经将重点放在精密度和特异性更高的仪器分析方法和免疫分析方法上。
3.2 HPLC
HPLC是目前应用比较广泛,前景比较好的一种AFT检测方法。此方法基于AFT在固定性、流动性之间的分配量不同实现分离后,依靠AFTD的荧光特性进行检测分析。具有特异性强、灵敏度高、分离效率好等优点,但操作相对繁琐,检出限高[22]。
目前,HPLC法各种食品基质中AFT的提取中,在很大程度上,已经用甲醇、丙酮或乙腈的水溶液混合物取代以前的一些方法中使用的氯仿提取物,这是国际上减少氯化溶剂消耗所努力的一部分。而大多数基质的萃取物中含有大量的共萃取杂质,不适合直接进行色谱分析,需要提纯。常用的是免疫亲和层析柱(IAC)或者多功能进化柱(MFC)进行分离萃取。样品在长波紫外线下进行分离,使AFT分离后发出荧光,可以被荧光检测器检测并进行测量分析。为了最大化天然AFT荧光并提高方法灵敏度,许多学者通过用三氟乙酸进行柱前衍生化以及用碘或溴进行柱后衍生化将AFT转化为更强的荧光衍生物[23]。
3.3 ELISA
ELISA具有方便、快捷、灵敏、成本低、易规模化应用等优点,能在短时间内对大量样品完成检测。主要原理是利用抗体的特异性,在抗体抗原结合后,通过检测抗体、抗原或者反应产物进行定量、定性分析。在这种测定方法中必须要有3个基本部分,即结合在固相载体上的抗原或抗体(免疫吸附剂)、酶标记的抗原或抗体(标记物)、酶作用的底物(显色剂)[24]。分析的依据是有色产物的量引起的颜色深浅程度。但实验结果抗干扰能力差,易受外来因素的干扰,出现假阳性。
3.4 LC-MS/MS
LC-MS/MS,相比于其他的检测技术,准确度和灵敏度较高,能够同时对多种真菌毒素进行测量[25]。其特点是在高效液相色谱法的基础上,进行质谱离子扫描,分析识别未知党的分析物,与图书馆可检索的电离质谱相比较,可以快速、自动、合法和可靠地进行分子鉴定。缺点是分析成本高,具有进行此类测量的技术和人力资源的实验室有限。

表4 四种常见AFT检测方法的优缺点及适用范围
4 玉米(玉米油)加工过程对AFT的控制
4.1 玉米原料的筛选与控制
已有文献表明,玉米的品种、环境对AFT的污染有着较大影响[26]。对玉米抗黄曲霉种质进行培育,是解决黄曲霉污染最有效的途径。目前,随着对玉米中黄曲霉研究的不断深入,对黄曲霉玉米基因的了解也越来越多。美国的William等[27]发明了抗黄曲霉自交系Mp313E、Mp420、Mp715等抗原种质。邓德祥等[28]通过对玉米自交系进行筛选,得到8个具有高抗黄曲霉性质的品系。
其次,在玉米的选种上,应该选择抗倒伏能力强、颗粒饱满的品种。有学者发现,玉米倒伏后,会使玉米与土地的接触面积,玉米的环境湿度有所增加,更易遭受真菌毒素的污染;环境的变化,也会引起玉米中AFT的变化,收获前期和收获末期连续降雨,会使玉米水分含量升高,从而导致玉米中AFT含量增加。所以玉米在收获后,必须及时进行晾晒,降低玉米水分含量。
在玉米原料中,破损粒中的AFT含量是正常玉米粒的几十倍,进行筛选,去除已损伤的玉米粒,能有效防止黄曲霉污染的扩散。例如,罗小虎等[29]通过比重筛选机对玉米原料进行筛选后,重质玉米中AFB1的含量相比较于原料玉米,分别降低了21.2%和38.4%。
一些学者也在研究通过对玉米原料进行脱毒处理,降低AFT的含量。李笑樱[30]等人提出用HSCAS(水合铝硅酸钠钙)与AFB1发生螯合反应,形成稳定的金属螯合物,吸附大量AFB1;刁恩杰等[31]用臭氧攻击AFT,干法处理30 h后,脱毒率为82.88%;湿法处理,脱毒率为89.78%;Mendez[32]等提出通过柠檬酸处理后的玉米,AFT降解率能达到96.7%。此外,还有紫外线照射脱毒、微生物脱毒等,均对玉米中的AFT有较好的消减作用。
4.2 贮藏过程中AFT的控制
玉米属于不耐储粮食,在储藏过程中极易产生霉菌毒素,被黄曲霉污染,对粮食安全带来很大隐患。Pitt[33]和Magan[34]对霉菌霉菌产毒条件进行了研究,发现当水分含量低于13%时,大麦中的大部分霉菌都停止了生长。王红梅[35]发现当玉米水分含量在15.7%时,贮藏40 d后,玉米中的AFT含量高于国家标准;水分含量为14.5%、13.8%时,分别在100 d、170 d达到限量标准;水分含量为12.4%的玉米中AFT含量一直在检出限以内。戴晓武等[36]通过调查表明,在一定范围内,霉菌毒素对玉米的影响随水分含量的升高而升高。季青跃等[37]通过高水分玉米储藏试验说明,水分含量在10%~15%之间时,也可以保证粮食质量,但成本较高,不适合于常规贮藏。
储藏温度也会对霉菌生长造成较大影响。丁丽等[38]发现粮食贮藏过程中,霉菌生长的最适温度为25~30 ℃。温度对黄曲霉毒素的影响与玉米水分含量息息相关。有研究表明,玉米在水分含量4.3%~5.0%,温度50 ℃ 条件下,或者水分含量为5.4%~6.2%,35 ℃ 时,AFT较少,最适贮藏。AFT调控基因在水分含量15%~30%、温度27 ℃ 条件下最为活跃,导致高水平AFB1含量的产生。一般玉米的安全贮藏条件为水分含量低于14%,温度保持在10 ℃以下。
此外,穗贮与粒贮并用是玉米贮藏的一个突出特点,常年相对湿度高的地区采用粒藏法;常年相对湿度较低的地区,例如我国北方,常采用穗藏法,但后者谷仓利用率太低。贮藏方式也可根据厂房、气候等条件选择常规储藏、氮气调储藏或者低温储藏。贮藏空间要经常通风换气,保证洁净干燥,防止AFT的再次污染。玉米在储藏过程中,AFT含量与储藏时间成正相关关系,所以需要对储藏玉米进行轮换以防止粮食变质。按照相关规定,玉米储存轮换期为三年。但根据李兰芳等[39]的报告,由于条件限制,刚储存的玉米脂肪酸含量在40~50 mg KOH/100 g之间,但经过1年储存后很容易超过50 mg KOH/100 g,为轻度不适宜,因此大多一年一轮换。
4.3 玉米油生产过程中AFT的控制
玉米胚芽油的加工工艺大致可分为压榨、碱炼、脱酸、脱色、脱臭等过程。有研究表明,玉米胚样品在经过浸出取油、压榨去油后,黄曲霉毒素含量的平均值由7.24 μg/kg减少到了0.70、1.59 μg/kg[40]。同一玉米胚,由于AFB1在正己烷溶剂中的溶解度远小于在油脂中的溶解度,所以AFB1的含量,浸出毛油要低于压榨毛油。陈金定等[41]提出在玉米油吸附脱色的精炼过程中,选用活性白土或凹凸棒石或WY2活性炭、添加量2%、吸附时间25 min、吸附温度100 ℃的工艺条件,可将玉米毛油中AFB1含量降至欧盟要求的小于等于2 μg/kg的限量指标。刘玉兰等[42]通过实验发现改进碱炼法后,对玉米毛油中AFB1的脱除率达90%以上,经碱炼后玉米毛油中AFB1含量从73.35 μg/kg降至5 μg/kg以下,明显优于GB 2716—2005《食用植物油卫生标准》中规定的小于等于20 μg/kg的限量指标。刘玉兰等[43]还曾在文献中提出,可以采用优化的高温蒸馏脱除技术对油脂中的AFT进行处理,脱毒率达60%。
4.4 玉米油中AFT的消减与控制
目前,玉米油中的AFT消减工艺已经比较成熟,经过对原料贮藏和加工过程的慎重控制后,一般都会满足国家标准[44]。但也可能因为某些意外因素导致AFT的污染。目前对于成品玉米油,最常用的是AFT消减方法是吸附法和辐射处理法。Sun等[45]发现磁性GO(氧化石墨烯)的掺杂有效地提高了TiO2在紫外光和可见光下的光催化活性,在紫外可见光下光照120 min后,玉米油中AFB1的降解率可达96.4%。Shen[46]曾在文献中提到,臭氧处理结合紫外线辐射可以显著提高AFT的降解率。Alam等[47]通过AFT与蒙脱石相互作用的研究证明,钙蒙脱石在水中对AFB1的吸附量高达0.6 mol/kg。此外,根据国内外学者研究报道,活性白土、凹凸棒石、WY1 活性炭、WY2 活性炭以及HSCAS(水合铝硅酸钠钙)、海泡石(SepSp-1)等物质对AFT也有着较好地吸附作用。

表5 玉米、玉米油中黄曲霉毒素的常见控制方法 %
5 展 望
目前,对于玉米中AFT的检测方法多种多样,对玉米油中AFT的控制更是有了一套相对成熟的体系。然而,针对其它食品中的真菌毒素污染,例如花生油中AFT的控制,还需要进一步完善检测方法、了解真菌毒素的作用机理,在考虑实际生产,大规模应用的基础上,探索脱毒方法,进一步明确真菌毒素降解产物的安全性。本文旨在为后来学者、专家提供参考,以创造出更加简捷、高效的检测方法,更加完善的加工与脱毒体系,共筑食品安全长墙。
