清香型小曲白酒生产中红曲霉的分离及发酵特性研究
2021-11-08朱丽萍刘源才陈申习
朱丽萍,杨 强,刘源才,张 龙,张 磊,陈申习
(劲牌有限公司劲牌研究院中药保健食品质量与安全湖北省重点实验室,湖北大冶 435100)
红曲霉是药食两用微生物,发酵后可以代谢产生降血脂成分莫纳可林K、降血压成分γ-氨基丁酸,可用于保健食品及功能食品中。且红曲霉在生长过程中能产生多种生物酶,如淀粉酶、糖化酶、蛋白酶和酯化酶等[1-2],可以催化发酵底物的分解和多种代谢产物的生成,促进发酵质量的改善,故在酿酒行业中多有应用。如刘新宇[3]在汾酒的清香型大曲中筛选得到2 株酯化酶活较高的红曲霉,通过培养条件优化酯化酶活达到2.46 U;冯晓山[4]在浓香型大曲中分离得到高产酯的红曲霉,应用于西凤小麦曲生产中,取得了较好的实验效果;杨维建[5]从郎酒酱香型大曲中分离得到高温红曲霉,分析发现其在酱香型郎酒酿造中起到重要的作用。虽然各香型大曲中红曲霉的相关研究报道较多,但在清香型小曲中尚无相关报道。由于清香型小曲中微生物研究较少,大量有益微生物类群至今未被解析[6],使得人们一直对清香型小曲微生物认识存在一定误区,认为其微生物菌群结构及作用不及大曲。经现代检测技术发现,在清香型小曲白酒中风味物质不仅含量丰富,而且种类多样,这决定了清香型小曲白酒具有清香纯正、醇甜柔和、余味爽净的独特品质特点,受到越来越多年轻消费者的喜爱[7-10]。
鉴于红曲霉对发酵质量具有明显的改善作用,且在清香型小曲研究领域还属于空白,为进一步阐明清香型小曲白酒微生物菌群信息,提升发酵质量,本研究从发酵源头酒曲开始,以绿衣观音土曲、糖化醅和酒醅为研究对象,采用经典分类方法,对其中的红曲霉进行系统研究。首次从中分离鉴定出多株红曲霉,并对其在酿酒环境的耐受性、发酵特性进行了研究,为解析清香型小曲白酒良好品质和升级发酵质量提供了科学依据。
1 材料与方法
1.1 材料、试剂及仪器
1.1.1 分离样品
绿衣观音土曲由劲牌有限公司提供,糖化醅和发酵醅由劲牌有限公司毛铺酒厂正常生产批次的班组提供。
1.1.2 培养基
马铃薯葡萄糖琼脂培养基:准确称取马铃薯琼脂培养基干粉46.6 g,溶于1000 mL 蒸馏水,搅拌均匀,以115 ℃灭菌20 min,备用。
乙醇马铃薯葡萄糖琼脂培养基:准确称取马铃薯琼脂培养基干粉46.6 g,溶于一定体积蒸馏水,搅拌均匀,以115 ℃灭菌20 min,冷却至50 ℃左右,加入一定量的无水乙醇,pH 值自然,配制成不同浓度的乙醇-PDA培养基。
乳酸马铃薯葡萄糖琼脂培养基:准确称取马铃薯琼脂培养基干粉46.6 g,溶于1000 mL 蒸馏水中,添加乳酸调节pH 值,配制成不同pH 值的乳酸-PDA 培养基,搅拌均匀,以115 ℃灭菌20 min,备用。
大米培养基:取一定量籼稻米,浸泡3 h 沥干后,称取50 g 沥干后的大米分装于250 mL 的三角瓶中,121 ℃灭菌20 min,趁热用手拍打三角瓶至米粒均匀不结块,冷却后备用。
麦芽汁培养基:称取一定量麦芽提取物,加入900 mL 蒸馏水中,调节波美度为10°Bx,添加5 mL乳酸,以115 ℃灭菌20 min,冷却至50 ℃左右,加入100 mL的无水乙醇。
1.1.3 仪器设备
104C ECLIPSE E200 显微镜,日本尼康有限公司;SF-CF-2A 超净工作台,郑州南北仪器设备有限公司;WD-9413B 凝胶成像系统,北京六一电泳仪器厂;2720PCR 仪,赛默飞世尔科技公司;HH-S恒温水浴锅,上海索谱仪器有限公司;Neofuge 18R高速冷冻离心机,上海Heal Force 公司;721 型分光光度计,尤尼柯上海仪器有限公司。
1.2 实验方法
1.2.1 菌株的分离筛选及显微形态观察
称取0.5 g酒曲样品或1 g酒醅样品于装有100 mL麦芽汁培养基的250 mL 锥形瓶中,置于30 ℃培养2~4 d 富集红曲霉,增殖液经适当稀释,涂布分离于新的PDA 培养基上,挑选不同形态的菌落进行划线分离,纯化出的单菌落挑取小块长有红曲霉的培养基,于装有1 mL 30%甘油溶液的甘油管中,放于-20 ℃下过夜后,置于-80 ℃保藏。
菌落的显微形态观察:将活化后的菌株接种到PDA 培养基中,取无菌盖玻片,以倾斜约45°方式插入培养基中,每皿插入4~6片,30 ℃温箱中倒置培养7 d,取盖玻片在显微镜下观察,观察包括菌丝、分生孢子、闭囊壳和子囊孢子颜色及形态在内的显微形态特征[11],记录并拍照。
1.2.2 分子生物学鉴定
真菌模板制备:使用土壤中微生物基因提取试剂盒提取红曲霉的模板DNA。
PCR 反应体系为30 μL:PremixTaq(EX Taq-Version2.0)15 μL,DNA 模板2 μL,上游引物ITS1(5'-TCCGTAGGTGAACCTGCGG-3')0.5 μL、下游引 物ITS4(5'-TCCTCCGCTTATTGATATGC-3')0.5 μL,dd H2O 12 μL。
PCR 扩增程序为:95 ℃预变性5 min;95 ℃变性45 s,52 ℃退火45 s,72 ℃延伸110 s,循环35 次;72 ℃延伸10 min,4 ℃保温。
琼脂糖凝胶电泳检测PCR产物,PCR产物送往武汉华大基因科技股份有限公司完成测序。测序结果与NCBI数据库中已知序列进行BLAST比对。
1.2.3 耐受性试验
(1)乙醇耐受性
将筛到的红曲霉接种于9 个不同乙醇浓度(0%vol、4%vol、8%vol、12%vol、15%vol、18%vol、21 %vol、23 %vol、25 %vol)的乙醇-PDA 培养基中,以30 ℃培养7 d,测量平板中的菌落直径,反映红曲霉对乙醇耐受性情况。
(2)耐高温试验
将筛到的红曲霉接种PDA 培养基中,置于30 ℃、35 ℃、40 ℃、45 ℃、50 ℃、55 ℃的培养箱中培养7 d,测量平板中的菌落直径,反映红曲霉对温度耐受性情况。
(3)耐酸试验
将筛到的红曲霉接种不同pH 值(2.5、3、4、5、6、7)的乳酸-PDA 培养基中培养,以30 ℃培养7 d,测量平板中的菌落直径,反映红曲霉对酸度的耐受性情况。
1.2.4 红曲的制作
将菌株接种于PDA 平板上活化,30 ℃培养7 d后,加入10 mL 无菌蒸馏水洗孢子,洗出液在锥形瓶中用玻璃珠振摇打散约10 min,用3 层擦镜纸过滤除去菌丝,采用血球计数板计数,取106个/mL 孢子液1 mL 接种于制备好的米饭培养基的三角瓶中,混匀,间隔24 h 以2 mL/瓶补加无菌水1 次,且连续补水3 d,在30 ℃下静置发酵14 d,发酵期间观察米粒,如有结块现象,用手拍打三角瓶至米粒均匀不结块。发酵完成后,将其于40 ℃下烘干,以磨粉机粉碎并过60 目筛,密封,于-20 ℃下避光保存,待用。
1.2.5 蛋白酶活的测定
称取5 g(精确至0.01 g)红曲样品,加入50 mL乳酸-乳酸钠缓冲液(pH3),在40 ℃水浴中浸出30 min,离心取上清液为酶浸出液。准确吸取酶浸出液1 mL,注入10 mL 离心管中,在(40±0.2)℃水浴中预热5 min,准确加入2%酪蛋白溶液1 mL,计时,保温40 min,立刻加入2 mL 的0.4 mol/L 三氯乙酸,以沉淀多余的蛋白质,终止反应。15 min 后离心分离。准确吸取上层清液1 mL,注入试管中加入5 mL 的0.4 mol/L 碳酸钠溶液和1 mL 福林试剂,摇匀,在(40±0.2)℃水浴中加热20 min显色。
空白试液与试样测定同时进行,离心管中先后注入酶浸出液1 mL,三氯乙酸2 mL,2 %酪蛋白1 mL。静置15 min 后离心分离,之后操作均与试样测定相同。
以空白试液为对照,用分光光度计于波长680 nm,10 mm比色皿测定其吸光度。
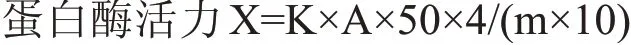
式中:X——样品的酶活力,μg/g(μg/mL);
A——样品平行试验的平均吸光度;
K——吸光常数(K=98.49实验室测定值);
50×4——试样稀释倍数;
10——反应时间10 min,以1 min计;
m——称取试样的质量。
1.2.6 糖化酶活的测定
称取5 g(精确至0.01 g)红曲样品,加乙酸-乙酸钠缓冲液6 mL,加蒸馏水至60 mL,搅拌均匀后放入35 ℃水浴锅中;恒温放置1 h(前30 min 勤搅拌,后30 min 静止),离心取上清液作为糖化的酶液。在试管中,加入2%可溶性淀粉5 mL,于35 ℃水浴锅中预热3~5 min,加入上述酶液0.5 mL,准确反应20 min,立刻取出0.5 mL 反应液于预先吸有1.5 mL DNS 的试管中,开水煮沸15 min,冷却后加10.5 mL 蒸馏水,摇匀,比色测定。空白用高温灭活酶液。
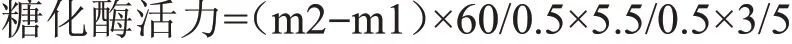
式中:m1——空白样吸光度OD1所对应的葡萄糖毫克数;
m2——试验样吸光度OD2所对应的葡萄糖毫克数;
3——min转换成h。
1.2.7 红曲酯化力测定
红曲的酯化力测定参考QB/T 5188—2017《酿造红曲》中酯化力测定方法[12]。
2 结果与分析
2.1 菌株的鉴定
2.1.1 菌株的分离
绿衣观音土曲、糖化醅、发酵醅样品经富集培养后,稀释涂布于PDA 平板上,均有菌落长出,见图1,挑选其单菌落在PDA 培养基上分离划线纯化。纯化后的菌株,点接于PDA 平板中,观察其菌落形态差异,见图2;同时,使用插片法观察其显微形态差异,见图3。通过菌落形态和显微形态观察获得9 株形态不同的疑似红曲霉菌株,依次命名为红曲霉M1—M5、T1—T4。
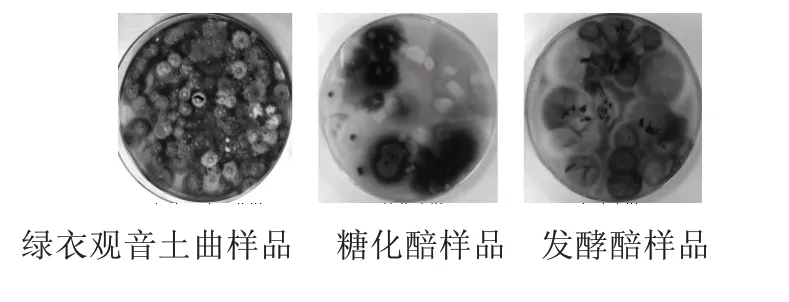
图1 待分离样品中红曲霉菌落形态
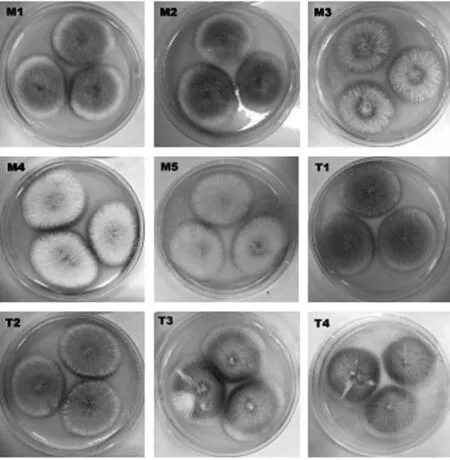
图2 9株红曲霉的单菌落形态

图3 9株红曲霉的显微形态
2.1.2 分子生物学鉴定
使用试剂盒提取9 株红曲霉的DNA,对其ITS基因序列进行扩增,PCR 产物送往武汉华大基因科技股份有限公司完成测序,测序结果与NCBI 数据库中已知序列进行BLAST比对,结果见表1。

表1 9株红曲霉的分子生物学鉴定结果
测序结果经BLAST 比对,结合菌株形态,M1—M3、T1—T4 鉴定为紫色红曲霉(Monascus purpureus),M4—M5 为红色红曲霉(Monascus ruber)。
2.2 耐受性实验
2.2.1 乙醇耐受性试验
9 株红曲霉接种于9 个不同乙醇浓度(0%vol、4 %vol、8%vol、12%vol、15%vol、18%vol、21%vol、23%vol、25%vol)的乙醇-PDA 培养基中,在30 ℃培养7 d后,记录其菌落直径的大小,结果见图4。

图4 不同浓度乙醇对红曲霉生长的影响
在红曲霉对乙醇耐受性实验中发现,红曲霉的乙醇耐受性均较高,在21 %vol的乙醇浓度下均能生长,这可能是在发酵醅中能检测出红曲霉的原因。在23%vol乙醇浓度下,除T2、M4外,其余7株菌株均能生长。红曲霉M1、T1和M3能在含25%vol乙醇的PDA 中生长,表现出对乙醇较高的耐受性。在不同乙醇浓度中,红曲霉的生长表现出一定的规律,M2、T2、T4 随乙醇浓度增高,菌落直径随之减小,表现出对高浓度乙醇较弱的耐受性。同时,也发现一个有趣的现象,M1、M3、M4、M5、T3在乙醇浓度为12%vol,T1在乙醇浓度为15%vol时出现拐点,即随乙醇浓度增高,菌落直径先减小后增大,后又不同程度下降,表现出对一定高浓度乙醇较好的耐受性。有研究表明,一定浓度(3%vol)的乙醇会刺激红曲霉的生长,并产生大量的色素[13],在本次发酵过程中,有部分菌株出现类似的现象,即在低乙醇浓度(0~8 %vol)和在拐点乙醇浓度下,平板菌落的颜色与其他浓度相比明显较深。
2.2.2 温度耐受性
把9 株红曲霉接种于PDA 平板中,置于不同温度(30 ℃、35 ℃、40 ℃、45 ℃、50 ℃、55 ℃)的培养箱中培养7 d,记录其菌落直径的大小,结果见图5。

图5 不同温度对红曲霉生长的影响
在考察红曲霉对温度的耐受性分析中,发现9株菌株均能在45 ℃的条件下生长,其中红曲霉M1、M2、T3 的菌落直径较大,表现出对高温较好的耐受性。红曲霉M3—M5、T1—T4 在设定的温度范围内呈现出随温度增高菌落直径减小的变化规律,表明高温对其生长有一定消极影响。红曲霉M1 和M2 在设定的温度范围内呈现出菌落直径随温度先增大后减小的变化规律,在35 ℃时菌落直径达到最大,说明35 ℃为其最适生长温度。由于清香型小曲发酵过程温度相对于其他香型大曲发酵温度较低[14-16],经过发酵环境长期的驯化,在绿衣观音土曲中发现的红曲霉最适温度与小曲发酵温度相符合。
2.2.3 酸度耐受性
9 株红曲霉接种于6 个不同pH 值(2.5、3、4、5、6、7)的乳酸-PDA 培养基中,30 ℃培养7 d 后,记录其菌落直径的大小,其中pH 值为2.5、3 的培养基为液态,故仅记录其生长情况,结果见图6。
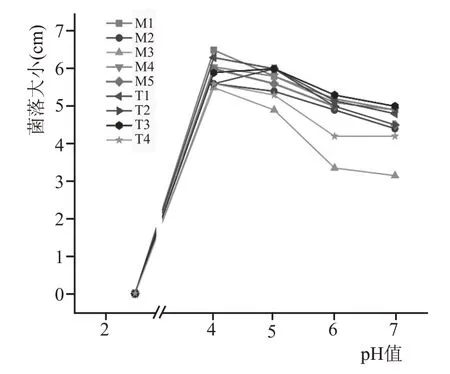
图6 不同pH值对红曲霉生长的影响
在考察红曲霉对pH值的耐受性分析中,发现9株菌株在pH3 时均能良好生长,在pH2.5 时,不能生长,表明9 株菌株对酸最大耐受性在pH3 左右。9 株菌株在pH 值为4~5 时菌落直径最大,表明其最适生长pH值为4~5,即在较酸环境中,有利于红曲霉的生长。在酒醅发酵过程中微生物生长代谢产生各种酸类物质,使酒醅的酸度不断增高,红曲霉对酸的耐受性,使其能够在其中较好生存。
2.3 红曲发酵特性研究
对9 株红曲霉制备的红曲样品进行蛋白酶活检测,结果见图7。由图7 可看出,不同的红曲,蛋白的分解利用能力相差很大,红曲T4 的蛋白酶活最高,为104.83 U/g,红曲M2 次之,为78.89 U/g,红曲M3、T1 的酶活较低,小于20 U/g,可见红曲霉同种不同株之间的差异性较大。而蛋白酶活影响白酒的口感和品质[17],为应用提供了不同酶活菌株资源。
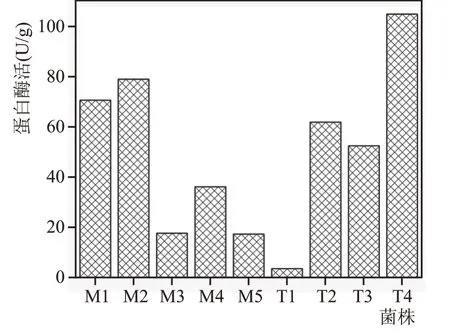
图7 9种红曲蛋白酶活
9份红曲样品的糖化酶活见图8。由图8 可知,分离的红曲霉制备成红曲后,均有一定的糖化酶活,可在发酵过程起到糖化的作用。但红曲糖化酶活均不高,红曲M2的糖化酶活最高,为9533.46 U/g·h。
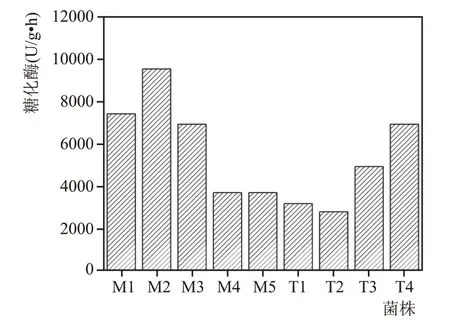
图8 9种红曲糖化酶活
9 份红曲样品的酯化力见图9,由图9 可知,土曲中分离得到的红曲霉制备成红曲后酯化力差异显著,红曲T2 的酯化力最高,为7.49 mg/g·100 h,红曲M1次之,M5的酯化力为0。

图9 9株红曲霉酯化力
3 结论
本研究采用培养组学首次从清香型小曲、糖化醅和酒醅中分离得到了9 株红曲霉,结合形态学观察和分子生物学鉴定,主要为紫色红曲霉(M.purpureus)和红色红曲霉(M.ruber),与市场上红曲产品中常用生产菌种相同,丰富了商业菌种的来源。使用固态平板模拟固态发酵过程,发现红曲霉最适生长pH 值为4~5,可耐受的最低pH 值为3;对乙醇有较好的耐受性,菌株M1、T1 和M3 最高可耐受25 %vol 的乙醇,且部分菌株对较高浓度乙醇有嗜好性,这为在高酸和高乙醇的酒醅环境中生存提供了可能。在耐温方面,9 株红曲霉最适生长温度为30~35 ℃,符合清香型小曲发酵的温度特点。另外,把分离出的红曲霉制备成红曲后检测了其蛋白酶活、糖化酶活和酯化力,结果发现同种红曲霉不同菌株之间酶活差异性较大,其中蛋白酶活、糖化酶活和酯化力分别较高的红曲霉为T4、M2 和T2,具有较好的应用价值。本研究首次对清香型小曲白酒生产中的红曲霉进行研究,获得了两种主要红曲霉种类,丰富了清香型小曲白酒的微生物信息,为阐明清香型小曲白酒良好品质物质基础提供了科学依据,也为下步在白酒发酵以及其他传统酿造食品中红曲霉的应用提供菌株资源。
