dnPD-1(MUC-1+CD19)CAR-T细胞治疗复发或转移性乳腺癌的临床研究*
2021-11-07宋海侠岳晓华张小平祁海燕孙少伯王碧莹耿广琴
宋海侠,岳晓华,张小平,祁海燕,孙少伯,王碧莹,耿广琴
(1.甘肃省肿瘤医院 甘肃 兰州 730050;2.甘肃中医药大学 甘肃 兰州 730000)
嵌合抗原受体(Chimeric antigen receptor,CAR)是由抗原识别部分和T 细胞信号转导域组成的融合蛋白[1]。以B 细胞标记物CD19 为靶点的CAR-T 细胞的临床试验已显示出对多种血液系统恶性肿瘤的明显疗效[2],包括急性淋巴细胞白血病、慢性淋巴细胞白血病、淋巴瘤和多发性骨髓瘤等。
粘蛋白1(mucin 1,cell surface associated,MUC-1)是人类MUC-1 基因编码的一种Ⅰ型跨膜蛋白,正常情况下主要表达于多种组织、器官中上皮细胞近管腔或腺腔面。最近研究表明,MUC-1 的一种同种型MUC1/Y 的表达具有肿瘤特异性,其在乳腺癌组织中表达,而相应癌旁组织不表达[3]。由于MUC-1 在肿瘤组织中的异常表达,使其成为一种潜在的肿瘤治疗生物学标志物。本研究使用目前应用最广泛的CD19 细胞,导入MUC-1 CAR基因,评价dnPD-1(MUC-1+CD19)CAR-T 靶向治疗复发或转移性乳腺癌的有效性、安全性、耐受性。
1 资料与方法
1.1 一般资料
选取2019 年4 月至2019 年11 月在甘肃省肿瘤医院治疗的1 例PD-L1 阳性(见图1)乳腺癌患者作为研究对象,年龄43 岁,左侧乳房发病,临床分期rT2N3M1,CAR-T 治疗前接受既往手术治疗、常规放疗、化疗,多周期解救化疗。免疫组织化学检测肿瘤细胞ER(2+,70%)、PR(1+,5%),C-erbB-2(3+),Ki-67(+30%),GCDFP15-60(散在+),GATA-3(+),CK7(+),符合乳腺来源。纳入标准:①病理学确诊是乳腺癌;②转移性乳腺癌,既往接受过>2~4 个化疗方案或者多线内分泌治疗,目前无标准治疗方案;③经申办方认可的实验室免疫组织化学测定MUC-1 表达≥1+,PDL阳性;④按RECIST 1.1 版标准≥1 个颅外可测量病灶,可测量病灶未接受过放疗;⑤研究开始前4周内未接受过化疗、放疗、分子靴向治疗及手术,并己从前面治疗的急性毒性反应中恢复,脱发及外周神经毒性除外;⑥预计生存期≥6 个月;⑦主要器官功能正常,即符合下列标准:a.ECOG 体能状态评分为0~2;b.血常规检查标准需符合:血红蛋白≥90 g/L(14 d 内未输血),中性粒细胞≥1.5×109/L,血小板≥80×109/L;c.生物化学检查需符合以下标准:总胆红素≤1.5×正常值上限(ULN),谷丙转氨酶(ALT)和谷草转氨酶(AST)≤2.5×ULN,如有肝转移,则ALT 和AST≤5×ULN,血清肌酐≤1×ULN,内生肌酐清除率>50 mL/min(Cockcroft-Gault 公式);⑧育龄妇女须在入组前7 d内进行妊娠实验(血清或尿液),且结果为阴性,愿意在实验期间和末次给予CAR-T 后8 周采用适当的方法避孕(接受了绝育术或绝经后>2 年的女性可认定为不具有生育能力);⑨受试者自愿加入本研究,签署知情同意书,依从性好,配合随访。排除标准:①既往5 年内有其他恶性肿瘤病史,但已治愈的皮肤基底细胞癌和宫颈原位癌除外;②既往接受过MUC-1 靶向治疗、嵌合抗原受体治疗或其他转基因T 细胞治疗;③妊娠或哺乳期妇女;④研究开始前4 周内参加过其他药物临床试验;⑤患有高血压且经单一降压药物无法获得良好控制者(收缩压>140 mmHg,舒张压>90 mmHg),患有>Ⅰ级心肌缺血或心肌梗塞、≥Ⅰ级心律失常(包括QT 间期≥440 ms)或心功能部全;⑥长期未愈合的胸部或其他部位的伤口或骨折;⑦具有精神类药物滥用史且无法戒除者或有精神障碍史;⑧既往和目前有肺纤维化史、间质行肺炎、尘肺、放射性肺炎、药物相关肺炎、肺功能严重受损等的客观证据;⑨存在不可控制或需要Ⅳ抗菌剂治疗的真菌、细菌、病毒或其他感染,如果对活性治疗有应答,在咨询医学监查员后允许存在单纯的尿路感染和无并发症的细菌性咽炎;⑩对于既往使用过化疗的受试者,根据NCI-CTCAE 4.0 标准,入组时存在≥2 级血液学毒性或≥3 级非血液学毒性;⑪已知存在艾滋病病毒或乙型肝炎(HBsAg阳性)或丙型肝炎病毒(抗HCV 阳性)感染病史;⑫存在任何留置导管或引流管(如经皮肾造口管、留置弗利氏导尿管、胆汁引流管或胸膜/腹膜/心包导管),允许使用专用中心静脉导管;⑬脑转移;⑭存在中枢神经系统感染(CNS)病史或疾病,如癫痫发作疾病、脑血管缺血/出血、痴呆、小脑疾病或任何涉及CNS 的自身免疫性疾病;⑮入组12 个月内有心肌梗死、心脏血管成形术或支架植入术、不稳定型心绞痛或其他具有临床意义的心脏疾病病史、纽约心脏协会Ⅲ类或Ⅳ类心力衰竭;⑯存在重大免疫缺陷;⑰对本研究中的主要治疗药物(包括预处理期间使用的氟达拉滨、环磷酰胺、美司钠及防治细胞因子释放综合征的托珠单抗及抗感染药物等)具有重度超敏反应病史;⑱入组6 个月内存在深静脉血栓或肺栓塞病史;⑲过去2 年内存在导致末端器官损伤或需要全身免疫抑制/全身疾病调节药物的自身免疫性疾病(如克罗恩氏病、类风湿性关节炎、系统性红斑狼疮)病史;⑳有任何可能对研究治疗的安全性或疗效评估产生干扰的疾病。

图1 患者PD-L1 阳性免疫组织化学染色
1.2 方法
受试患者采12~15 mL 外周血进行白细胞分离,获得约8×109/L 单核细胞,对白细胞分离产物中的T 细胞进行纯化处理。随后T 细胞接受激活并扩增,使用病毒载体导入MUC-1 CAR(粘蛋白1)基因,构建起靶向MUC-1 的CAR-T 细胞、进一步扩增。然后使用利用T 细胞诱导改造技术dnPD-1(dominant negative PD-1)(专利号:US 2017/0096638 A1,上海斯丹赛生物技术有限公司)改良PD-1,降低PD-L1 诱导的免疫耐受,增强CAR-T 细胞抗肿瘤活性。
1.3 治疗
1.3.1 预化疗处理 用氟达拉滨[30 mg/(m2·d)]和环磷酰胺[500 mg/(m2·d)]给药3 d,以促使淋巴细胞耗竭,创建体内靶向MUC-1 CAR-T 扩展的最佳环境。组成的预处理化疗方案后给予靶向dnPD1(MUC-1+CD19)CAR-T。
1.3.2 靶向dnPD1(MUC-1+CD19)CAR-T 输注以回输剂量为5×106dnPD1(MUC-1+CD19)CAR-T细胞/kg 的CAR 转导自体T 细胞的剂量静脉输注。
2 结果
2.1 MUC-1 CAR-T 细胞回输前后患者相关指标变化情况
CAR-T 细胞回输后1 d,患者体温升高,出现2 级发热。白细胞介素-2(IL-2)、白细胞介素-6(IL-6)、白细胞介素-10(IL-10)、肿瘤坏死因子-α(TNF-α)、干扰素-γ(INF-γ)、C-反应蛋白(CRP)出现不同程度的升高,CAR-T 细胞数量自回输3 d后明显上升。见表1。
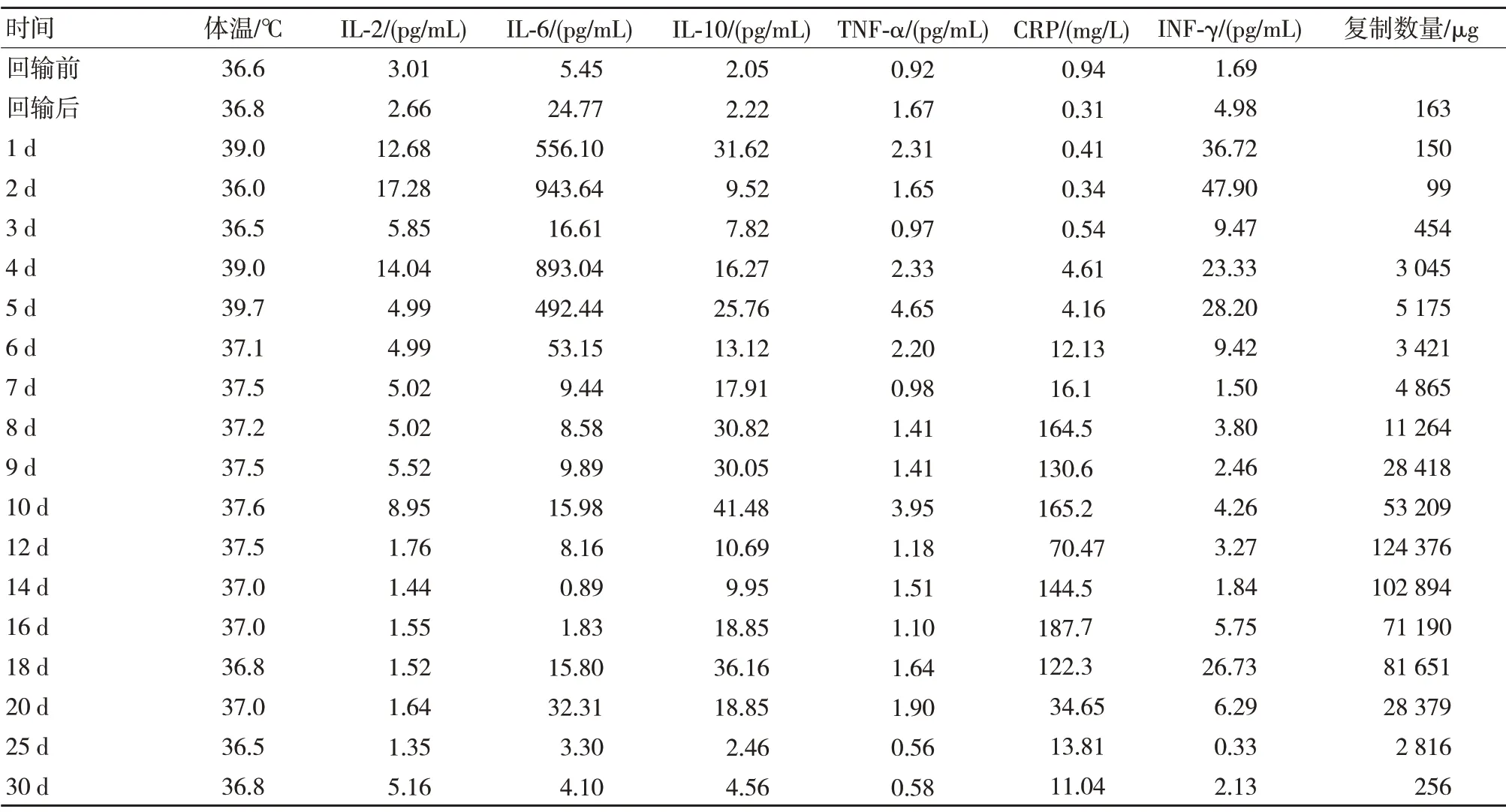
表1 CAR-T 细胞回输前后患者相关指标变化情况
2.2 患者治疗前后左侧胸骨骨转破坏及左胸壁软组织PET-CT 检查结果变化情况
PET-CT 扫描结果:患者治疗前左侧胸壁软组织肿块24 mm×20 mm,SUVmax:12.19(见图2A)。治疗后1 个月(见图2B)及3 个月(见图2C)PET-CT 提示左胸壁软组织肿块无明显变化(25 mm×19 mm vs.28 mm×17 mm),SUVmax 值变化不明显(11.55 vs.13.6),但治疗后6 个月左侧胸壁软组织肿块明显增大(40 mm×25 mm)、代谢增高,SUVmax17.7(见图2D)。

图2 左胸壁软组织及胸骨骨转破坏PET-CT 结果
2.3 患者治疗前后右侧腋窝肿大淋巴结PET-CT检查结果变化情况
右侧腋窝淋巴结体积变化:CAR-T 治疗前(见图3A),治疗后1 个月15 mm×10 mm(见图3B),3 个月16 mm×10 mm(见图3C),6 个月23 mm×27 mm(见图3D)。SUVmax:治疗后1 个月8.5,3 个月8.9,6 个月14.7。

图3 右侧腋窝肿大淋巴结PET-CT 检查结果
2.4 患者治疗6 个月后PET-CT 检查结果新发转移灶情况
PET-CT 结果显示:患者治疗6 个月后肝脏和肺部出现新发病灶。见图4。

图4 新发转移灶
2.5 患者身体其他部位PET-CT 检测结果情况
患者脑部、颈部、肺部、腹部和骨盆的基线经PET-CT 扫描,结果治疗后1 个月、3 个月、6个月均未出现明显异常。
2.6 患者缓解持续时间和无进展生存期情况
根据实体瘤的疗效评价标准1.1 版,患者的疾病缓解持续时间和无进展生存期可以达到6 个月。患者自CAR-T 治疗开始至今已经存活17 个月,且一般情况良好。
2.7 患者不良反应及毒副作用情况
CAR-T 细胞回输后1 d 出现2 级发热,持续5 d;回输18 d 出现Ⅲ°骨髓抑制;回输1 d 后降钙素原、IL-2、IL-6、IL-10 开始升高;回输1 月后B淋巴细胞(CD19+)偏低,回输6 个月后恢复正常;回输后5 d、8 d 双侧手掌、双足出现出血点(见图5),伴瘙痒;期间伴随发热、疲乏、心慌气短、血管渗漏等细胞因子释放综合征;神经系统MMSE 评分30 分,无明显异常;心脏功能、核磁共振成像、肝功能、肾功能、心肌酶谱、粪尿常规、凝血功能均在正常范围,无明显异常。

图5 双侧手掌、双足出血点
3 讨论
根据2017 年美国癌症统计研究报告显示,乳腺癌仍然高居女性恶性肿瘤发病率的第1 位,占所有新发女性恶性肿瘤约30%;而因乳腺癌死亡的病例数排在第2 位,占所有死于恶性肿瘤女性约14%[4]。目前约有40%乳腺癌患者会在接受系统性治疗后,仍出现复发转移,而且大部分复发转移患者最后均因转移而死亡[5]。乳腺癌在接受治疗后的前三年会出现1 次复发高峰期,之后复发风险将逐步下降。但是复发风险将一直存在,约有10%~20%复发病灶表现为手术区域的局部复发,60%~70%则表现为远处转移或多发转移。大部分晚期癌症最终进展为常规治疗难治性疾病,需要新的治疗模式。免疫检查点抑制剂和肿瘤浸润淋巴细胞的研究表明了T 细胞治疗癌症的潜力,程序化的T 细胞是一种非常有前景的癌症治疗方法[6]。
MUC-1 在多种肿瘤中异常表达,表达量增高可达正常时>100 倍,而且细胞表面分布改变,极性分布丧失,整个细胞表面均表达。其在乳腺癌组织中异常表达,癌旁组织不表达,使其成为一种潜在的肿瘤治疗靶点[3],所以在研究中笔者使用靶向MUC-1 CAR-T 的T 细胞进行治疗;同时因为免疫检查点的存在,为了进一步增强抗肿瘤活性,使用经过改造的抑制了PD-1 功能的CAR-T细胞。结果发现3 个月内病情稳定,PET-CT 检测结果无明显的恶化或转移灶;6 个月PET-CT 检测发现左胸壁病灶部位增大,右腋窝淋巴结增大,SUVmax 增加,肺部和肝脏出现新发转移病灶;缓解持续时间和无进展生存期可达6 个月,而且患者自治疗存活至今17 个月,且一般情况良好。
CAR-T 治疗最常见的毒性是细胞因子释放综合征和神经毒性[7]。本研究中也出现了细胞因子释放综合征,包括发热、恶心、厌食、心动过速、发热、疲乏、心慌气短、血管渗漏综合征,IL-2、IL-6、IL-10、INF-γ、CRP 明显上升。美罗培南和甲强龙联合处理后发热得到控制,期间出现的Ⅲ°骨髓抑制通过皮下注射重组人白细胞介素-11 得以纠正,神经系统MMSE 评分30 分,无明显神经毒性。治疗后1 个月B 淋巴细胞(CD19+)偏低,但治疗后6 个月恢复正常,患者肝功能、肾功能、心肌酶谱、粪尿常规、凝血功能均在正常范围,这证明笔者的治疗具有较好的安全性。
综上所述,本研究证明dnPD-1(MUC-1+CD19)CAR-T 细胞治疗复发或转移性乳腺癌能有效控制癌细胞的复发和恶化,不良反应和副作用可控,具有较好的安全性和稳定性,但因为纳入的志愿者患者数量有限,其详细机制还需进一步的研究。
