青贮饲料微生物群落组成与功能研究进展
2021-11-06陈梦言白洁柯文灿许冬梅艾琳郭旭生
陈梦言 白洁 柯文灿 许冬梅 艾琳 郭旭生
(1. 兰州大学生命科学学院,兰州 730000;2. 兰州大学益生菌与生物饲料研究中心,兰州 730000;3. 兰州大学草地农业科技学院,兰州730000;4. 中国畜牧业协会,北京 100044)
青贮饲料是指以青绿饲草为原料,在厌氧条件下通过乳酸菌发酵而调制的优质青粗饲料。青贮的成功与否与原料特性、发酵环境及原料附生微生物等因素密切相关。大量研究已经证明发酵代谢产物、降雨量、温度、湿度、经纬度和海拔都会影响青贮饲料微生物菌群的结构组成[1-3]。因此,目前已采用多种生物学方法对微生物群落组成结构及微生物在青贮饲料发酵过程中行使的生物化学过程进行了探究,如从早期的平板培养技术到以聚合酶链式反应技术为基础延展出的变性梯度凝胶电泳、末端限制性片段长度多态性、长度异质性PCR和自动核糖体基因间隔分析等技术[4-7],再到变性梯度凝胶电泳(DDGE)和16S rRNA基因的末端限制性片段分析技术(T-RFLP)方法等。虽然这些方法已获得大量并富有成效的研究成果,但其获得微生物种类的信息量较少,无法准确反映微生物的菌种类型和数量的弊端仍需进一步解决。因此,如何利用分子生物学手段全面准确检测和定量青贮饲料中的微生物群落结构和种类特征将对突破青贮饲料发酵的微生态调控研究具有重大意义,也是目前青贮饲料发酵微生物调控亟待解决的问题。对此,人们尝试使用高通量测序手段进行解决。随着高通量测序技术的发展,二代测序技术和基于SMRT测序技术的16SrRNA基因全长测序的出现为解决该问题提供了切实可行的方法。本文就国内外利用高通量测序技术对青贮微生物结构组成与功能的研究报道加以综述,旨在为进一步探讨青贮饲料中微生物群落结构与演替规律及其代谢调控网络提供参考。
1 青贮饲料微生物结构的组成及演替
青贮发酵过程是由微生物介导的动态变化过程,在这个过程中,牧草本身附着的微生物与牧草种类、生长环境等密切相关。此外,各种青贮添加剂也会在很大程度上影响其微生物的组成。通常情况下,当青贮原料中乳酸菌的数量超过105CFU/g鲜重时[8],才能保证乳酸菌在青贮发酵初期快速繁殖,产生大量乳酸,成为优势菌种,进而保证青贮饲料快速良好的发酵。一个良好的微生物发酵过程是调制高品质青贮饲料的关键。这个发酵过程不仅取决于原料本身所具有的营养成分,而且也取决于青贮发酵过程中微生物的群落结构及其演替过程与代谢网络功能的关系,所以对这些信息的了解可为有效调控青贮饲料的发酵过程以调制优质的青贮饲料提供重要的科学依据,并对于筛选优良乳酸菌菌种具有重要的实际生产意义。
1.1 苜蓿青贮饲料微生物群落组成及演替
苜蓿作为重要的饲料作物之一,因其蛋白含量高且富含多种营养成分而在国内外被广泛用于饲料加工[9]。然而,由于其缓冲能力较高、可溶性碳水化合物含量较低、乳酸菌数量较少使得青贮效果并不理想[10],因此,在日常生产实践中往往需要额外添加外源乳酸菌,以促进牧草的发酵进程。
青贮发酵是一个微生物相互竞争的过程,充分了解苜蓿青贮发酵过程中微生物群落结构的变化,寻找其发酵规律对提高苜蓿青贮发酵品质极为重要(表1)。在有关苜蓿原料附着微生物组成的研究方面,Yang等[11]发现萎蔫苜蓿原样中假单胞菌属(Pseudomonas)、微小杆菌属(Exiguobacterium)马赛菌属(Massilla)、动性球菌属(Planococcus)微生物为主要附生菌群,而乳杆菌属微生物的相对含量仅占比2%。Bao等[12]的研究表明肠杆菌属(Enterobacter)、泛 菌 属(Pantoea)、肠 球 菌属(Enterococcus)、芽胞杆菌属(Bacillus)和魏斯氏菌属(Weissella)微生物是新鲜苜蓿样品中主要附着菌群。Guo等[13]的试验表明苜蓿原料表面附着的微生物主要有泛菌属(Pantoea)、乳杆菌属(Lactobacillus)、肠杆菌属、链球菌属(Streptococcus)等。而Yang[14]的结果表明,在苜蓿青贮中,肠杆菌属微生物是最丰富的附生菌群,其次是泛菌属微生物和芽胞杆菌属微生物。出现这些差异的原因与样品所处的生长环境、地理位置等密切相关[13-14]。在环境因子对苜蓿青贮发酵的影响探究中,Agarussi等[15]发现热带地区萎蔫的苜蓿青贮与未萎蔫苜蓿青贮相比,微生物多样性显著降低,且在未萎蔫苜蓿青贮饲料中植物乳杆菌(Lactobacillus plantarum)为优势菌种,而萎蔫后的优势菌群为肠膜明串珠菌(Leuconostoc mesenteroides)。此外,Agarussi还发现原料干物质的不同也会影响其原料附着微生物组成,即从未萎蔫苜蓿原料中可以分离出赫伦魏斯氏菌(Weissella hellenica),弯曲乳杆菌(Lactobacillus curvatus),戊 糖 片 球 菌(Pediococcus pentosaceus),而酸鱼乳杆菌(Lactobacillus acidipiscis),鹑鸡肠球菌(Enterococcus gallinarum)。而肠膜明串珠菌(Leuconostoc mesenteroides)则仅能从萎蔫样品中分离得到。Zhang等[16]发现当储存温度在20-30℃时,无论是否使用接种剂,乳杆菌属微生物的相对丰度都是最高的,且一直处于主导地位。此外,使用不同乳酸菌发酵剂也能改变苜蓿青贮微生物的组成。Guo等[13]在接种植物乳杆菌和布氏乳杆菌后,发现在苜蓿青贮发酵过程中,虽然对照组、植物乳杆菌组和布氏乳杆菌组都以乳杆菌属、肠球菌属、链球菌属和魏斯氏菌属微生物为主,但其相对丰度在各处理组之间存在显著差异,在青贮发酵前期植物乳杆菌处理组的优势菌种为植物乳杆菌(L.plantarum),而布氏乳杆菌处理组则在青贮初期以布氏乳杆菌(Lactobacillus buchneri)为主,在发酵后期所有处理组都以植物乳杆菌(L. plantarum)为主,且在这个变化过程中布氏乳杆菌(L. buchneri)逐渐消失。Bai等[17]在探究不同乳酸菌及其组合对青贮苜蓿的发酵品质及微生物群落的影响时发现把植物乳杆菌(L. plantarum)、戊糖片球菌(P.pentosaceus)、粪 肠 球 菌(Enterococcus faecalis)分别或混合接种于苜蓿青贮中时,青贮发酵前期,所有处理组中乳杆菌属(Lactobacillus)、哈夫尼菌属(Hafnia)和魏斯氏菌属微生物均为优势菌群;但在发酵14 d后,随着青贮pH的降低,不耐酸的哈夫尼菌属微生物的相对丰度急剧下降,乳酸杆菌属和魏氏菌属微生物成为优势菌群,Graf等[18]在对黑麦草青贮的相关研究中也有类似发现。此外,在Bai的研究中魏斯氏菌在整个苜蓿青贮中都呈现出较高的相对丰度,这表明苜蓿本身附着的乳酸菌在青贮发酵过程可能具有较强的竞争力。在对比乳酸菌发酵剂和酶促剂对苜蓿青贮细菌多样性的影响时,Hu等[19]发现不同处理组间细菌群落存在明显差异,而乳杆菌属微生物在所有青贮饲料中均为优势菌群,且在青贮56 d后,乳杆菌属微生物的相对丰度在纤维素酶处理组和干酪乳杆菌处理组中分别达83.93%和94.17%,与对照组(75.1%)相比,添加纤维素酶和干酪乳杆菌(Lactobacillus casei)均能有效促进乳杆菌的生长,但干酪乳杆菌的作用效果更佳。
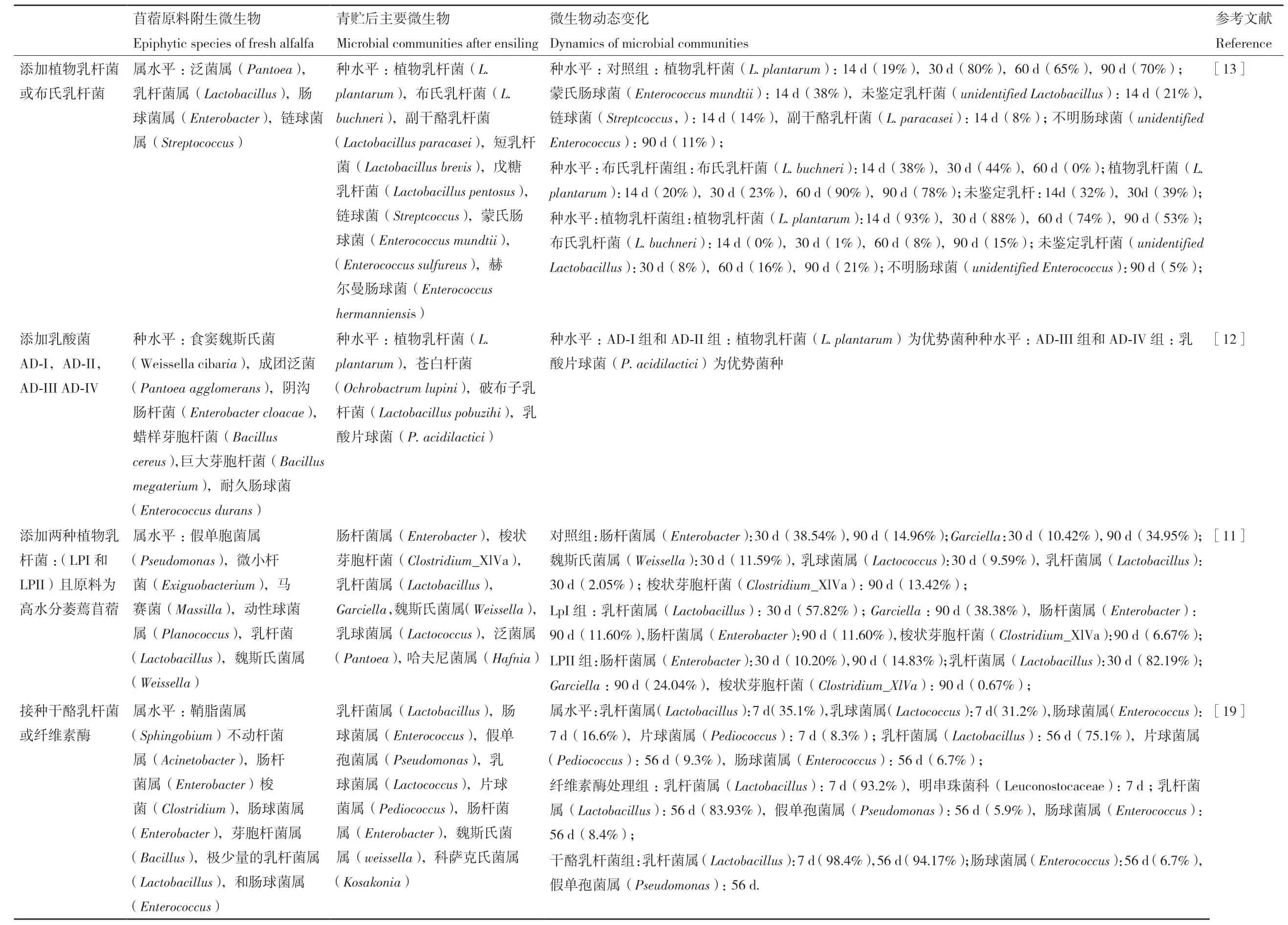
表1 苜蓿青贮细菌群落组成及其动态Table 1 Composition and dynamics of bacterial community in alfalfa silage
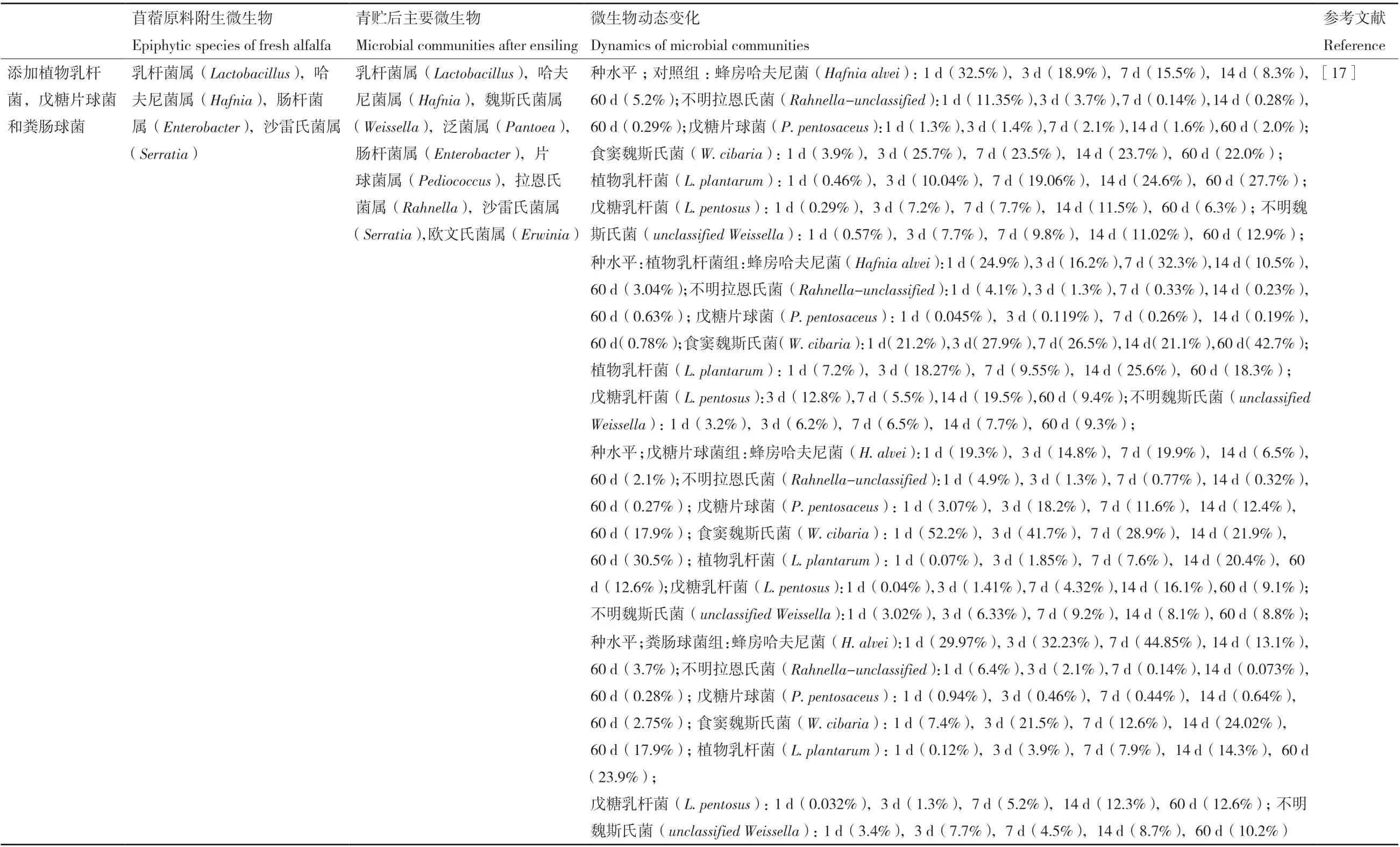
续表Continued
为进一步探讨环境因子及添加剂对苜蓿发酵过程中微生物群落的综合影响,柯文灿[20]通过在不同干物质、不同温度下接种植物乳杆菌(L.plantarum)和戊糖片球菌(P. pentosaceus)发现,随着干物质的增加,苜蓿原样中附着的魏斯氏菌属微生物的相对含量显著降低,而片球菌属微生物的相对含量明显提高,在发酵初期(7 d)对照组和戊糖片球菌处理组的优势菌群均为魏斯氏菌和片球菌属微生物,而植物乳杆菌处理组则主要由乳杆菌组成,且在20℃贮存条件下能显著抑制哈夫尼菌、葡萄球菌和节杆菌等有害微生物的生长。当发酵进行至中后期(14-60 d)时,植物乳杆菌处理组中的优势菌群转变为魏斯氏菌和植物乳杆菌(L. plantarum),且与低干物质处理组相比高干物质处理组中植物乳杆菌(L. plantarum)的相对丰度明显更高。此外,该研究还发现35℃青贮时添加植物乳杆菌对苜蓿青贮没有明显促进作用。Ni等[7]的试验结果也表明接种剂和温度对苜蓿青贮发酵特性和细菌多样性有较大影响,并建议在20℃和30℃青贮条件下,可通过提高乳酸菌的比例改善苜蓿青贮发酵品质。
综上所述,苜蓿原料表面微生物主要有泛菌属(Pantoea)、乳杆菌属(Lactobacillus)、肠球菌属(Enterococcus)、链球菌属(Streptococcus)、肠杆菌属(Enterobacter)、芽胞杆菌属(Bacillus)、魏斯氏菌属(Weissella)、假单胞菌属(Pseudomonas)等菌属。而青贮后则以肠杆菌属(Enterobacter)、芽胞杆菌(Bacillus)、乳杆菌属(Lactobacillus)、魏斯氏菌属(Weissella)、乳球菌属(Lactococcus)、泛菌属(Pantoea)、哈夫尼菌属(Hafnia)、肠球菌属(Enterococcus)、假单孢菌属(Pseudomonas)、片球菌属(Pediococcus)微生物为主。在苜蓿青贮发酵过程中微生物群落的动态变化受干物质,温度及乳酸菌添加剂等多种因素的影响,因此,严格把控各类因素对苜蓿青贮发酵过程的影响将有助于进一步改善苜蓿青贮的发酵品质。
1.2 全株玉米青贮饲料微生物群落组成及演替
全株玉米能量高,营养丰富,是世界范围内最常见的反刍动物饲料[21-22]。据统计,全球超过1.33亿头奶牛每年消耗青贮饲料高达6.65亿t,其中全株玉米青贮占比超过40%[23-24],因此提高全株玉米青贮发酵品质,有助于提高饲料的利用率,进而能促进畜牧业经济发展。
尽管前期的研究结果表明,明串珠菌科(Leuconostocaceae)、醋杆菌科(Acetobacteraceae)、肠 杆 菌 科(Enterobacteriaceae)和 莫 拉 菌 科(Moraxellaceae)是全株玉米青贮前的主要优势菌群[25],然而Xu等[26]2018年的研究却显示农杆菌属(Agrobacterium)、微 杆 菌 属(Microbacterium)、鞘氨醇杆菌属(Sphingobacterium)、金黄杆菌属(Chryseobacterium)等属的微生物是青贮前全株玉米的主要附着菌群。这种差异可能与原料的生长环境有关。Gharechahi等[24]以3个不同气候区的杂交玉米为青贮原料,研究青贮饲料中细菌群落的动态变化,结果显示青贮原料表面附着微生物与作物生长环境密切相关,且处于温暖和干燥地区的全株玉米原料附着微生物多样性相对较低。Guan等[27]对中国西南部四川、重庆和贵州5个主要生态区的全株玉米窖贮样品进行分析发现在窖贮青贮中出现了高丰度的醋酸杆菌。该研究也表明降雨和湿度是影响玉米原料中附生细菌群落变化的主要因素,而温度则是影响全株玉米青贮发酵过程中微生物群落变化的主要因素。许冬梅[28]在对不同气候区及乳酸菌影响玉米青贮发酵的微生物组与代谢组学机制研究中指出,青贮原料表面附着的微生物受气温、降雨量、光照、平均相对湿度等气候因子的影响,其中,平均相对湿度对全株玉米原料附着微生物群落的影响最为显著。此外在全株玉米发酵过程中不同气候区青贮过程标志微生物及优势菌种也有明显不同(表2),亚热带季风气候区、高原高山气候区以及热带季风气候区的全株玉米发酵过程中植物乳杆菌为优势菌种;温带大陆性气候区和温带季风气候区则分别以类食品乳杆菌(Lactobacillus paralimentarius)和短乳杆菌(L. brevis)为优势菌种。
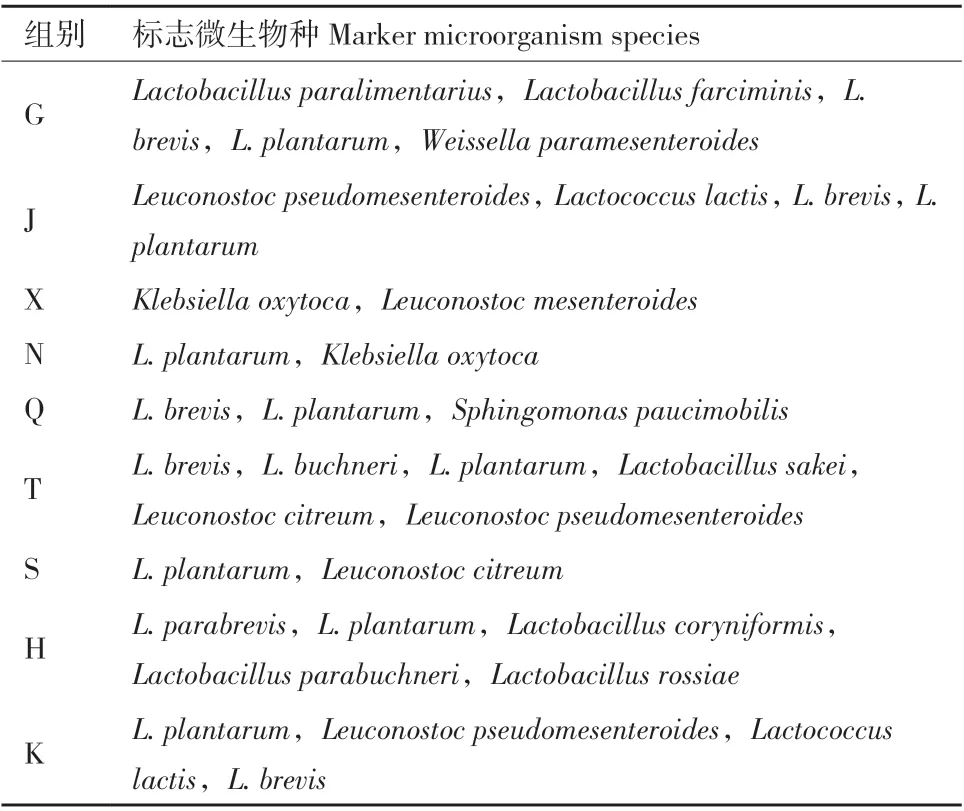
表2 不同气候区全株玉米青贮过程标志微生物(种水平)Table 2 Marker microorganisms of whole-plant corn silage in different climate zones(species)
目前对添加乳酸菌接种剂的全株玉米青贮发酵过程中微生物群落的动态变化的研究也有大量报道。Xu等[26]结合多种组学方法,通过接种植物乳杆菌及布氏乳杆菌,研究了全株玉米青贮过程中细菌菌群的变化(表3)。在整个青贮过程中,接种剂布氏乳杆菌和植物乳杆菌并不是优势菌种,说明外源乳酸菌在玉米青贮饲料中的竞争力较弱于本土乳酸菌。此外,在发酵前期,添加布氏乳杆菌增加了布氏乳杆菌的相对丰度但降低了短乳杆菌的相对丰度;添加植物乳杆菌则增加了副短乳杆菌(L. parabrevis)的相对丰度。而在发酵后期,添加布氏乳杆菌和植物乳杆菌均增加了类谷糠乳杆菌(Lactobacillus parafarraginis)的相对丰度,且降低了硅乳酸杆菌(Lactobacillus silagei)的相对丰度。除这两种最常用的接种剂外,研究者也试图将其他乳酸菌或酶制剂加入到玉米青贮中,进一步探究添加剂对全株玉米青贮微生物演替的影响,Drouin等[29]将希氏乳杆菌(Lactobacillus hilgardii)添加到玉米青贮中,与布氏乳杆菌处理组相比希氏乳酸菌处理组在发酵后期乳酸菌的相对丰度要明显提高。Li等[30]将鼠李糖乳杆菌(Lactobacillus rhamnosus)研究表明接种鼠李糖乳杆菌(L. rhamnosus)对发酵产物和微生物群落的影响不大,而接种布氏乳杆菌(L. buchneri)可能会改变发酵和有氧稳定性,但细菌和真菌群落没有明显变化。
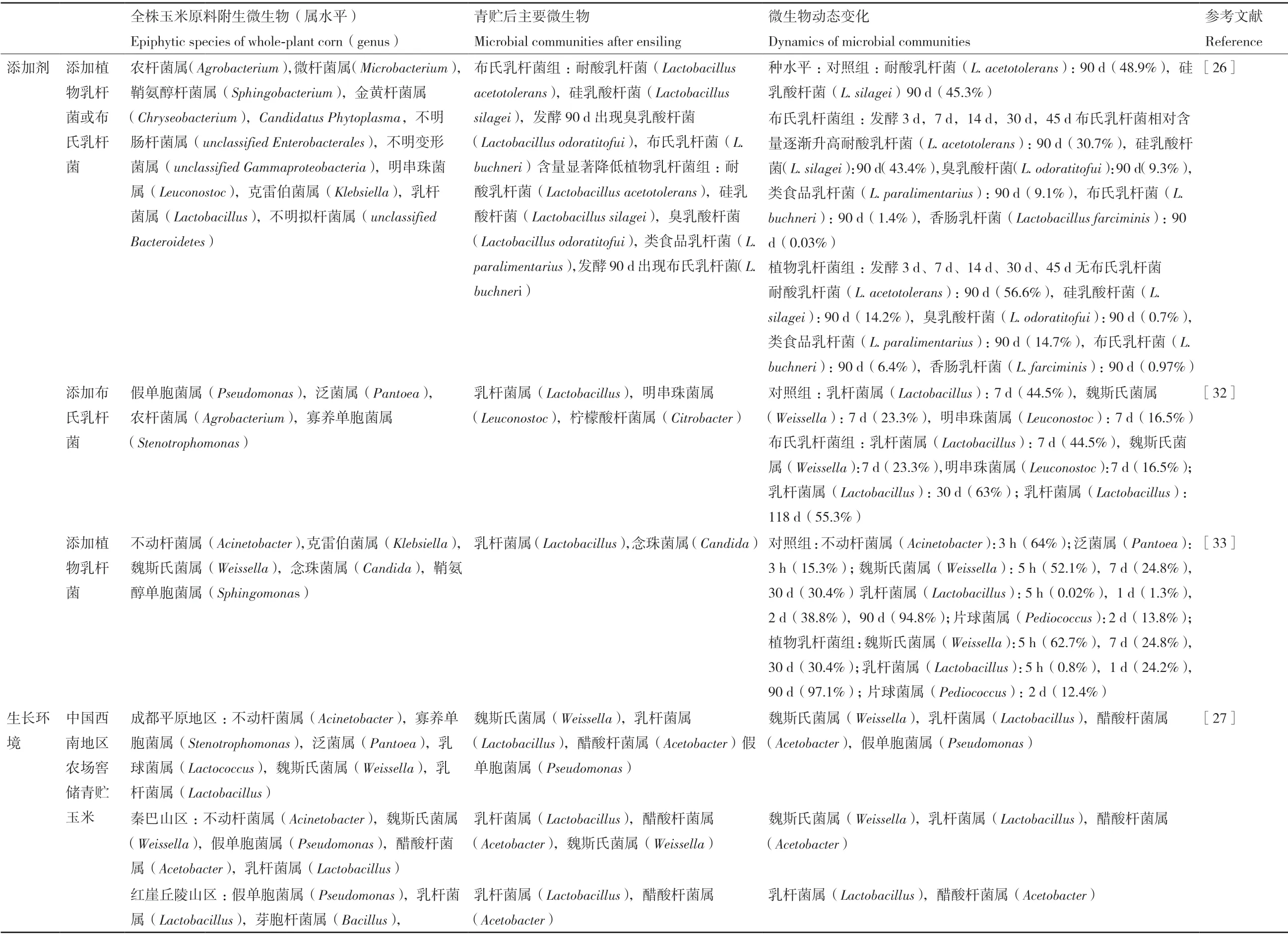
表3 添加剂及生长环境对全株玉米青贮微生物群落组成的影响Table 3 Effects of additives and growth environment on bacterial community compositions of whole-plant corn silage

续表Continued
综上所述,全株玉米原料表面微生物主要有农杆菌属(Agrobacterium)、微杆菌属(Microbacterium)、鞘氨醇杆菌属(Sphingobacterium)、金黄杆菌属(Chryseobacterium)、明串珠菌属(Leuconostoc)、克雷伯菌属(Klebsiella)、乳杆菌属(Lactobacillus)等。而青贮后则以乳杆菌属(Lactobacillus)、明串珠菌属(Leuconostoc)、柠檬酸杆菌属(Citrobacter)、魏斯氏菌属(Weissella)、醋酸杆菌属(Acetobacter)、假单胞菌属(Pseudomonas)、片球菌属(Pediococcus)为主。由于全株玉米本身的原料特性及表面附着乳酸菌的数量充足,尽管使用乳酸菌添加剂会改变全株玉米青贮过程中的微生物群落组成,但对其发酵品质的影响并不显著[31-32]。此外,不同气候区全株玉米原料表面附着的微生物组成差异较大,进而导致全株玉米青贮发酵过程微生物组成及演替也存在很大差异。所以在对于进行全株玉米青贮时,不仅要考虑气候因子对青贮原料表面附着微生物的影响,还需考虑不同添加剂对青贮微生物群落的影响。
1.3 其他牧草青贮饲料微生物群落组成及演替
除苜蓿和玉米外,其他牧草的微生物动态研究也在不断深入。Ni等[7]在研究饲料大豆与玉米、高粱混合青贮饲料发酵品质及微生物群落时发现,虽然乳杆菌和魏斯氏菌是所有青贮饲料样本中的主要菌属,但混合青贮饲料中乳杆菌属的丰度(33%-76%)要高于单一饲用大豆青贮(27%)。Xu等[34]以红豆草为研究对象,发现红豆草原料中微生物α-多样性(Shannon指数)高于苜蓿,但低于全株玉米,并且红豆草原料中不动杆菌属、脓单胞菌、假单胞菌、乳杆菌的相对丰度较高,而在青贮后苜蓿和全株玉米的α-多样性均低于红豆草。Wang等[35]将植物乳杆菌(L. plantarum)分别添加至萎蔫与未萎蔫辣木样品中发现未萎蔫辣木青贮中以乳杆菌属(Lactobacillus)占优势,而萎蔫辣木青贮中则以肠杆菌属(Enterobacter)、魏斯氏菌属(Weissella)和泛菌属(Pantoea)占优势。在环境因素对微生物群落的影响研究中,Guo等[36]的研究表明了光照对象草和意大利黑麦草发酵极为重要,不仅影响青贮发酵品质,而且对青贮微生物菌群的影响也较为显著。Ding等[37]的研究结果表明海拔也会影响牧草表面附生微生物,在低海拔地区,垂穗披碱草的附生微生物以假单胞菌属和泛菌属为主,而在高海拔地区,魏斯氏菌属和明串珠菌属占主导地位。在发酵14-90 d后,高海拔地区青贮垂穗披碱草中的魏斯氏菌属被乳酸杆菌属取代,随着发酵时间的增加,乳杆菌逐渐成为优势菌群。低海拔地区样品在发酵初期哈夫尼菌属为优势菌种,一直到青贮发酵60 d乳杆菌属才处于主导地位。除此之外,Zi等[38]的研究表明来自我国南方的12种不同的狼尾草天然发酵青贮的微生物多样性具有明显的差异,这与降水、温度、湿度、位置等环境因素密不可分。
在对接种剂对微生物群落的影响研究中,Nazar等[39]将苏丹草、象草、饲用高粱、全株玉米的外源性附着微生物分别接种于无菌苏丹草中进行青贮发现,在发酵初期苏丹草青贮中主要以片球菌属为主,青贮3 d后接种全株玉米和象草附着微生物的无菌苏丹草以乳杆菌属为主,而接种高粱附着微生物的无菌苏丹草则以魏斯氏菌属为主。Sun等[40]的研究结果表明接种乳酸菌菌悬液促进了细菌的演替和发酵过程,且全株玉米源的乳酸菌菌悬液比披碱草源的乳酸菌菌悬液更有效。
2 青贮饲料微生物群落功能初探
青贮发酵过程主要涉及的代谢途径包括碳水化合物代谢、氨基酸代谢、能量代谢、辅酶因子和维生素代谢以及异源生物的生物降解和代谢。对于这些功能变化的研究,可采用PIRUSt(Phylogenetic Investigation of Communities by Reconstruction of Unobserved States)的方法与KEGG数据库比对进行预测。近年来,PICRUSt已用于大麦青贮[41]、小麦青贮[42]、玉米青贮[26]及苜蓿青贮[17]等青贮饲料的微生物功能研究中,通过对细菌群落代谢途径的预测,可以更深入地了解代谢途径与发酵过程之间的关系,从而调控优质青贮的发酵。
前人的研究已发现不同乳酸菌调控青贮发酵过程的途径是不同的,布氏乳杆菌[43]是一种异型发酵乳酸菌,能将乳酸转化成乙酸,进而有效抑制引起青贮腐败的酵母。植物乳杆菌和戊糖片球菌[44]通过产生大量的乳酸从而快速启动青贮发酵,在抑制有害微生物的生长繁殖的同时还可以有效降低青贮饲料干物质损失。随着生物技术的发展,通过PICRUSt功能预测,可进一步探究在青贮发酵过程中乳酸菌添加剂对青贮过程微生物的代谢途径及功能的影响。Liu等[41]研究发现添加乳酸菌后,磷酸转移酶系统、果糖和甘露糖代谢、糖酵解、丙氨酸-天冬氨酸-谷氨酸代谢、甲烷代谢、丙酮酸代谢、戊糖磷酸途径的相对丰度在有氧暴露的第5天高于对照青贮饲料。Keshri等[42]发现在全株小麦青贮饲料中,相对丰度最高的代谢途径是转运体(transporters),与添加了植物乳杆菌的青贮饲料相比,对照组青贮至15 d的转运体的相对丰度显著升高,微生物种群间也存在共生关系。并且在碳水化合物代谢方面,Keshri等[42]发现添加了植物乳杆菌的青贮饲料中,碳水化合物代谢在整个青贮阶段都保持恒定水平,这与优势乳酸菌种群的代谢密不可分。相比之下,未经处理的青贮饲料的碳水化合物代谢在第15天显著增加,然后在第30天减少,直到第90天才与植物乳杆菌处理组的青贮碳水化合物代谢水平相当。之后,在Xu[26]和Bai[17]的研究中,他们选择了碳水化合物代谢、氨基酸代谢、能量代谢及辅酶因子和维生素代谢等与青贮发酵过程紧密相关的代谢途径进行了深入研究。Xu等[26]发现,这些代谢途径的相对丰度在全株玉米青贮的发酵中期有所上调。与植物乳杆菌处理组相比,接种布氏乳杆菌上调了全株玉米黄酮和黄酮醇的生物合成途径。Bai等[17]研究中发现,接种戊糖片球菌的苜蓿青贮与其他处理相比氨基酸代谢途径的相对丰度最低,同时发现该处理组的pH与氨态氮含量也较低。因此,此现象可以解释较低的pH抑制了由不良微生物生长繁殖所导致的蛋白降解及氨基酸代谢途径,从而降低了氨态氮含量。在该研究中,还有一个有趣的发现,即单独接种粪肠球菌及粪肠球菌与植物乳杆菌混合接种的苜蓿青贮中,辅酶因子与维生素代谢途径的相对丰度有所升高。他们推测粪肠球菌的接种可以直接产生维生素或促进了青贮过程中维生素的产生。且该研究也进一步表明,青贮饲料中的碳水化合物代谢途径的相对丰度较低时,微生物群落中的总乳酸菌数量也较低,反之亦然。在功能性乳酸菌的研究中,Zhang等[45-46]将具抗氧化活性植物乳杆菌添加至苜蓿青贮中发现青贮苜蓿中α-生育酚和β-胡萝卜素的浓度和多不饱和脂肪酸(PUFA)的比例显著提高了。
综上所述,植物乳杆菌在维持碳水化合物代谢、提高氨基酸代谢水平、减少转运体相对数量、降低了多环芳烃降解上调的程度等方面具有重要作用,布氏乳杆菌则可以上调黄酮和黄酮醇的生物合成途径D-丙氨酸代谢途径。而有关青贮饲料微生物群落功能研究还需进一步通过宏基因组测序技术进一进行深入研究,从而揭示青贮饲料发酵过程中微生物的代谢功能及其对青贮饲料发酵品质及代谢产物的影响。
3 展望
对于青贮发酵过程中代谢途径及功能变化的研究目前仍处于初步探索阶段。目前对青贮饲料微生物群落功能的研究只基于16S rRNA测序技术中的测序数据进行了功能预测,分析了不同处理及不同发酵时期中一些代谢途径及功能的丰度变化,并没有深入研究这些代谢途径及功能的变化具体是由哪些微生物引起,又导致了哪些生化过程及代谢产物的具体变化。因此,在未来的研究中,可结合宏基因组学和转录组学等生物技术对青贮发酵过程微生物的功能基因进行系统深入研究,进而有效揭示青贮饲料发酵过程中微生物群落结构与功能的关系及发酵代谢调控网络特征,明晰青贮饲料品质形成的微生物与生物化学过程,为优质、安全青贮饲料发酵调控提供理论依据。同时,青贮饲料不同发酵调控措施、不同饲草种类、气候环境条件等均会对青贮饲料微生物群落结构及功能产生影响,需进一步开展系统性的研究。由于我国地域辽阔,气候环境和自然条件多样,饲草资源丰富,这为我国在青贮饲料微生物发酵调控领域研究提供了得天独厚的资源,同时也为优质、安全青贮饲料的生产提出了不同挑战。
