副干酪乳杆菌对青贮苜蓿有氧暴露品质和细菌多样性的影响
2021-11-06王琦武之绚陈钟玲吴白乙拉胡宗福牛化欣
王琦 武之绚 陈钟玲 吴白乙拉 胡宗福 牛化欣
(内蒙古民族大学动物科技学院,通辽 028000)
保持厌氧状态对青贮饲料的保存是至关重要的[1]。然而,在生产实践中,青贮饲料与氧气短期和长期接触是不可避免的[2]。由于氧气的渗透,青贮中存在的耐酸(兼性)好氧微生物开始增殖,氧化分解残余的糖、乳酸、乙酸和乙醇,作为生长的底物,发生有氧变质的起始阶段[2-3]。当形成的微生物量足够大时,氧化释放出的热量会引起温度的显著上升。随着pH值的增加,其他不耐酸的好氧微生物开始增殖,进入了有氧腐败阶段[4-5]。随着青贮饲料有氧暴露期间的不断变化,青贮菌群的组成也随之发生变化[6]。然而,目前对青贮饲料有氧暴露期间的菌群多样性研究较少[7],缺少对有氧暴露青贮苜蓿菌群全面而又详细的了解。因此,本研究采用高通量二代测序对青贮苜蓿短、长期有氧暴露期间的菌群动态变化规律及其接种副干酪乳杆菌(Lactobacillus paracasei)在有氧暴露期间所起到的作用,旨在为青贮苜蓿提高有氧暴露发酵品质提供科学依据和生产指导。
1 材料与方法
1.1 材料
紫花苜蓿取自内蒙古通辽市某草业公司,为第一茬开花初期。副干酪乳杆菌(Lactobacillus paracasei LCP)由内蒙古民族大学肉牛营养与饲料高值化实验室筛选分离。培养细菌所用的MRS培养基、培养酵母、霉菌所用的马铃薯葡萄糖培养基购自G-CLONE(中国)。FastDNA SPIN Kit for Soil DNA提取试剂盒(MP Biomedicals,美国)。TransGen AP221-02 PCR扩增试剂盒(TransGen,中国)标准品(纯度≥99%):乳酸、乙酸、丙酸、丁酸购自罗恩试剂。磷酸氢二钠、次氯酸钠、硫酸铵、葡萄糖购自光复。氢氧化钠、蒽酮、购自DEEN。亚硝基铁氰化钠、苯酚购自天力。
1.2 方法
1.2.1 青贮的制作 紫花苜蓿经简单晾晒之后,干物质约为24%时制作青贮。切短至2-3 cm,分别喷洒1×106CFU/g FM的副干酪乳杆菌菌液(LCP)和喷相同量的灭菌水(CON),然后装入聚乙烯塑料袋(25 × 36 cm,厚度0.24 mm,浙江台州)中,用真空包装机(DZ-350,中国北京)真空包装。每组3个袋(重复),每袋装苜蓿500 g。将苜蓿放于室温(25-26℃)避光条件下,青贮56 d。
青贮56 d后,采样,将剩余样品蓬松装入无菌塑料瓶中,瓶口用4层纱布覆盖,有氧暴露测定样品温度,并在第0天(PO0)、第7天(PO7)和第14天(PO14)取样,一部分立即测定,其他2部分分别-80℃冰箱和-20℃冰柜保存。
1.2.2 青贮品质的测定和方法 干物质测定,将待测样品称重后置于电热恒温干燥箱(GZX-DH-300-II,中国)65℃烘干48 h,测定其干物质(dry matter,DM)含量。样品浸出液的制取及pH测定,取青贮苜蓿样品30 g,加入270 mL蒸馏水,搅拌均匀,用粉碎机搅碎1 min,先后用 4 层纱布和定性滤纸过滤,滤出草渣得到浸出液,立即启用pH计(雷磁PHS-25,上海)测定pH。然后将滤液,置于冷冻离心机(Eppendorf 5424R,德国)12 000 r/min离心15 min,取上清液,用0.45 μm滤膜过滤后HPLC(Agilent1260安捷伦,美国)用于测定乳酸、乙酸、丙酸、丁酸。
1.2.3 菌群多样性的测定 将青贮饲料每个样品取0.5 g放于1.5 mL抽提管中,按照说明使用 FastDNA SPIN 土壤DNA提取试剂盒(MP Biomedicals,CA,美国)提取苜蓿饲料中的基因组。将提取的DNA进行1% 琼脂糖凝胶电泳,并用NanoDrop对DNA浓度和OD260/OD280值进行测定。16S rRNA 基因的PCR扩增,对以上获得DNA模板,细菌采用16S rRNA基因V3-V4区引物(338F:5'-ACTCCTACGGGAGGCAGCA-3',806R:5'-GGACTACHVGGGTWTCTAAT-3')[8]进行扩增。PCR反应采用20 μL体系,包括4 μL的5×FastPfu Buffer,2 μL的dNTPs(dATP、dTTP、dGTP和dCTP各2.5 mmol/L),0.4 μL 的 Fast-Pfu DNA Polymeras,10 ng DNA模板,正向引物和反向引物(5 μmol/L)各0.8 μL,0.2 μL的BSA(0.1%),无菌双蒸水补至20 μL。95℃预变性3 min;95℃变性30 s,55℃退火30 s,72℃延伸45 s,反应循环数为27;最后72℃延伸10 min。扩增产物使用 1.5%琼脂糖凝胶进行电泳检测,使用 Thermo Scientific公司的GeneJET胶回收试 剂盒回收产物,使用Illumina测序专用的NEB Next® Ultra DNA Library Prep Kit试剂盒建基因克隆文库。构建好的文库送交上海美吉生物工程有限责任公司通过Illumina Miseq PE300平台(Illumina Corporation,美国)进行高通量测序。1.2.4 生物信息学分析 使用Usearch(vsesion 7.0)软件平台进行操作分类单元(operational taxonomic unit,OTU)的聚类分析。然后进行序列优化,包括非重复序列的冗余分析,无重复单reads的去除。按照97%相似性序列的原则,接着对优化序列进行OTU 聚类分析,在这个过程中要排出一些嵌合体,最后生成OTU代表序列,将所有的优化序列归类到代表序列中,产生 OTU表,并与Silva数据库(Release128,http://www.arb-silva.de)BLAST比对进行分类学分析,所用Qiime平台(http://qiime.org/scripts/assign_taxonomy.html),统计后得到各样本群落组成。然后对群落进行基于OUT水平的Alpha多样性分析(Shannon、Simpson、Chao和Ace)用mothur软 件 平 台[9](Version 1.30.1,http://www.mother.org/wiki/Schloss_SOP# Alpha _diversity)进 行分析。菌群组成柱状图、Venn图、Heatmap、主坐 标 分 析(Principal coordinates analysis,PCoA)及NMDS分 析(non-metric multidimensional scaling analysis)均采用R语言相关软件包进行分析及作图。使用QIIME[10]对PCoA及NMDS聚类的可靠性分别进行了Adonis及Anosim分析。RDA分析使用R语言vegan包分析和作图。LEfSe分析使用LEfSe(http://huttenhower.sph.harvard.edu/galaxy/root?tool_id=lefse_upload)进行组间差异显著性物种的判断。1.2.5 数据分析 试验数据由Excel 2010处理,采用SPSS19.0进行统计分析,结果以“平均值±标准差”表示,对于多组样品基于Tukey算法进行单因素方差分析(one-way ANOVA)和双因素(处理I×有氧暴露时间S)方差分析(P<0.05)。
2 结果
2.1 青贮苜蓿发酵品质
青贮苜蓿前、有氧暴露前(PO0)、有氧暴露7 d(PO7)和14 d(PO14)后发酵品质见表1,双因素方差分析表明,LCP组对青贮苜蓿品质具有显著影响(P<0.05),有氧暴露时间对青贮苜蓿干物质(DM)含量影响不显著(P>0.05),对其他各指标影响显著(P<0.05),除DM和丙酸(PA)含量,LCP组和有氧暴露时间对青贮饲料各指标的交互作用显著(P<0.05)。LCP组对青贮饲料DM含量影响显著,CON组DM含量均低于LCP组(P<0.05)。青贮饲料CON组pH为5.46,LCP组为4.55,有氧暴露14 d后,CON组和LCP组pH升高,CON组pH升高至6.43,LCP组pH升高至4.83,pH在CON组均高于LCP 组(P<0.05)。有氧暴露降低了CON组和LCP组的乳酸菌数量(P<0.05),且CON组乳酸菌数量显著低于LCP组(P<0.05)。有氧暴露期间,青贮饲料酵母菌和霉菌生长显著(P<0.05)。有氧暴露降低了青贮饲料乳酸含量(P<0.05),但乳酸含量在LCP组大于CON组(P<0.05)。有氧暴露期间,CON组和LCP组乙酸和丙酸含量均降低(P<0.05)。
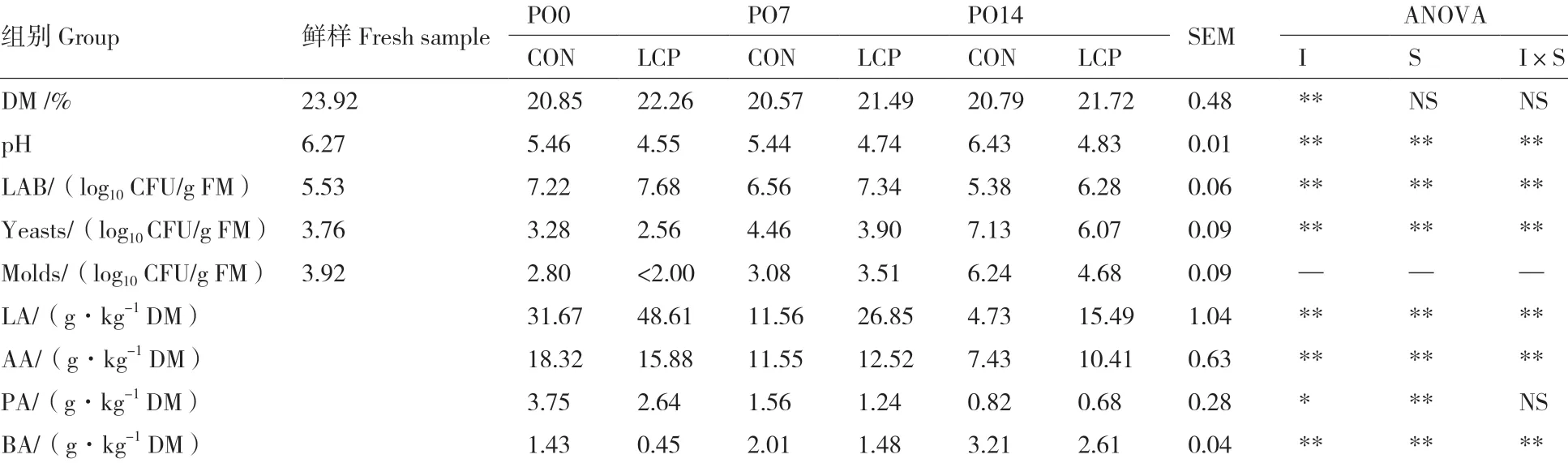
表1 有氧暴露苜蓿青贮品质Table 1 Fermentation quality of alfalfa silage during aerobic exposure from 0 to 14 d
2.2 细菌多样性动态变化
2.2.1 青贮苜蓿菌群α多样性分析 青贮苜蓿有氧暴露18个样品共获得993 834条有效序列,平均每个样本序列数为55 213条,平均每条序列长度为425.66 bp。共获得12个门、22个纲、47个目、80个科、109个属、141个种、157个OTU。稀释曲线趋于平台期,表明测序深度满足分析需求(图1)。
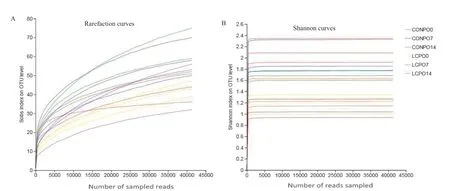
图1 青贮苜蓿菌群稀释曲线(A)和Shannon曲线(B)Fig.1 Rarefaction curves(A)and Shannon curves(B)of bacterial community in alfalfa silage
青贮苜蓿有氧暴露期间菌群多样性指数见表2和图2。青贮苜蓿有氧暴露期间,Shannon指数和Simpsom指数存在差异显著性。在青贮末期,CON组和LCP组的Shannon指数和 Simpsom指数存在差异显著性(P<0.05)。有氧暴露7 d,CON组和LCP组的Shannon指数和 Simpsom指数存在差异显著性(P<0.05)。而相同CON组内比较,青贮末期与有氧暴露14 d相比,Shannon指数和 Simpsom指数存在差异显著性(P<0.05)。
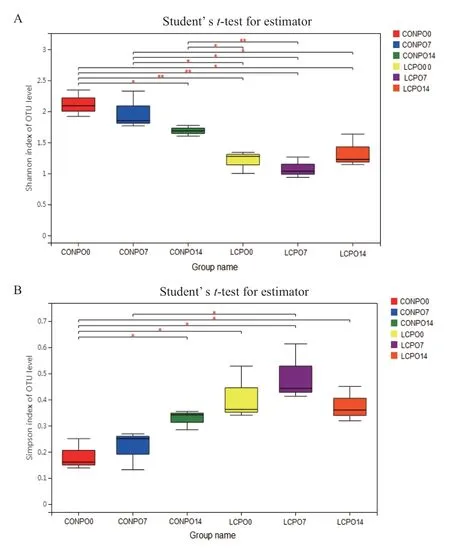
图2 青贮苜蓿菌群Shannon指数和 Simpsom指数差异显著性分析Fig. 2 Analysis on the difference between Shannon index and Simpson indexes of bacterial community in the silage alfalfa
2.2.2 青贮苜蓿菌群β多样性分析 基于bray_curtis距离算法的NMDS分析显示了青贮样本的β多样性,对于NMDS的结果,还使用了Adonis进行了组间差异检验,结果显示组间差异显著(R2= 0.741 1,P=0.001)。图3中Stress是检验NMDS分析结果的优劣。通常认为stress<0.2时可用NMDS的二维点图表示,其图形有一定的解释意义;当stress<0.1时,可以认为是一个好的排序;当stress< 0.05时,则具有很好的代表性。本实验的stress=0.071,说明样品间存在着较好的排序。由结果可见,CON组和LCP组分别形成了距离较远的两大群体。两组样本分别随着有氧暴露时间的延长而在NMDS2轴上发生了变化(图4)。说明青贮饲料菌群不仅受到接种菌的影响,也受有氧暴露的影响,但是接种菌处理的影响程度大于有氧暴露。
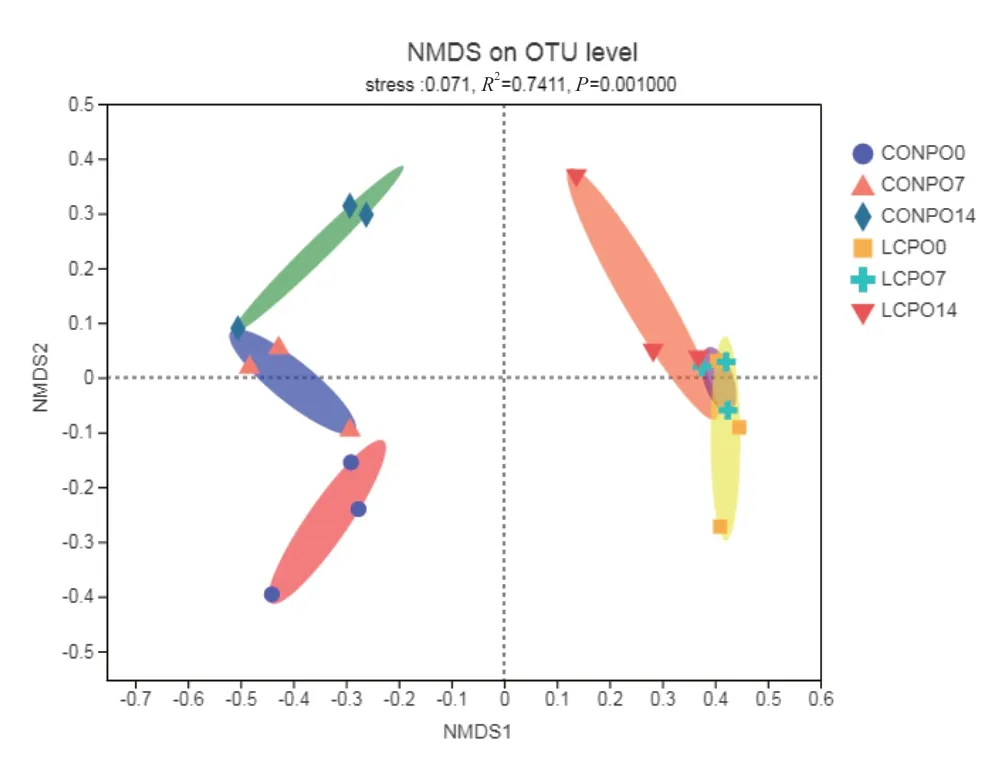
图3 青贮苜蓿有氧暴露期间NMDS分析Fig. 3 NMDS analysis of the silage alfalfa during aerobic exposure
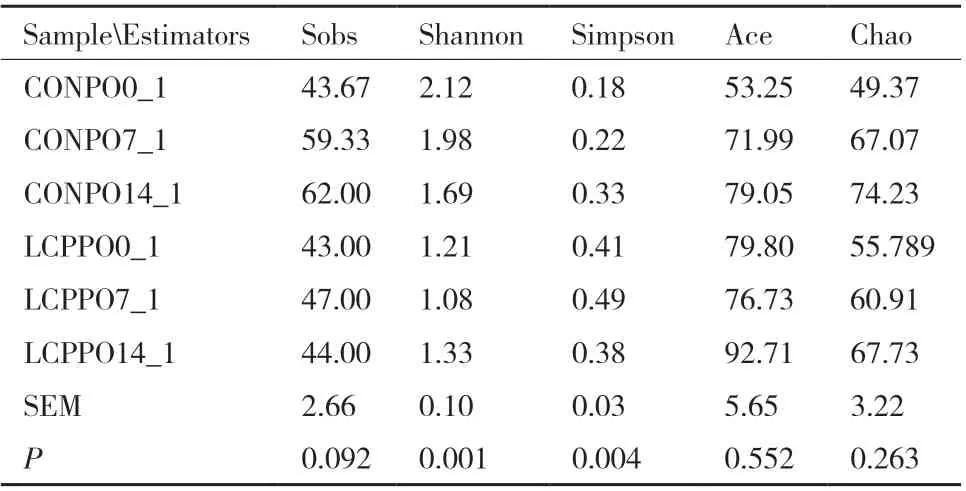
表 2 青贮苜蓿有氧暴露期间菌群多样性指数Table 2 Alpha-diversity of bacterial community in the silage alfalfa during aerobic exposure
2.2.3 青贮苜蓿有氧暴露细菌动态变化
2.2.3.1 门水平上细菌动态变化 在门的水平上,厚壁菌门(Firmicutes)在各个阶段均占优势,而变形菌门(Proteobacteria)CON组丰度较高(图4)。在CON组中,有氧暴露0 d、7 d、14 d厚壁菌门的丰度分别为65.11%、77.48%、54.08%;变形菌门分别为34.54%、21.08%、45.15%。在LCP组中,厚壁菌门占绝对优势,有氧暴露0 d、7 d、14 d的丰度分别为97.43%、97.95%、74.76%。而变形菌门的丰度分别为1.06%、1.63%、24.42%。

图4 门水平上青贮苜蓿细菌菌群组成Fig. 4 Composition of the silage alfalfa bacterial community at phylum level
2.2.3.2 属水平上细菌动态变化 在属的水平上(图5),在CON中,乳杆菌属(Lactobacillus)、肠杆菌属(Enterobacter)及肠球菌属(Enterococcus)是青贮饲料组主要的菌群种类。有氧暴露0 d、7 d、14 d乳杆菌属的丰度,分别为25.31%、64.59%、44.50%;肠杆菌属分别为32.46%、19.15%、6.58%;肠球菌属分别为16.84%、8.11%、3.85%。其他菌属丰度较低,如魏氏菌属(Weissella)分别为5.01%、4.24%、1.59%;Cedecea分别为2.04%、1.78%、3.21%。此外,在有氧暴露14 d时,醋杆菌属(Acetobacter)和Lyisibacillus的丰度分别为34.70%和3.78%。在LCP组中,乳杆菌属占绝对优势菌属,在有氧暴露0 d、7 d、14 d的丰度分别为96.85%、96.68%、74.59%,表明在有氧暴露14 d后乳杆菌属的丰度下降。此外,醋杆菌属和Komagataeibcter有氧暴露14 d时出现,丰度为18.26%和5.58%(图5)。青贮饲料在OTU水平上的组成及其所属菌属的构成见表3。
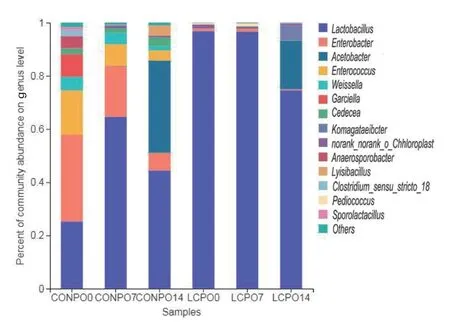
图5 属水平上青贮苜蓿有氧暴露各阶段菌群演替Fig. 5 Succession of bacterial community in the silage alfalfa at different stages of aerobic exposure at genus level
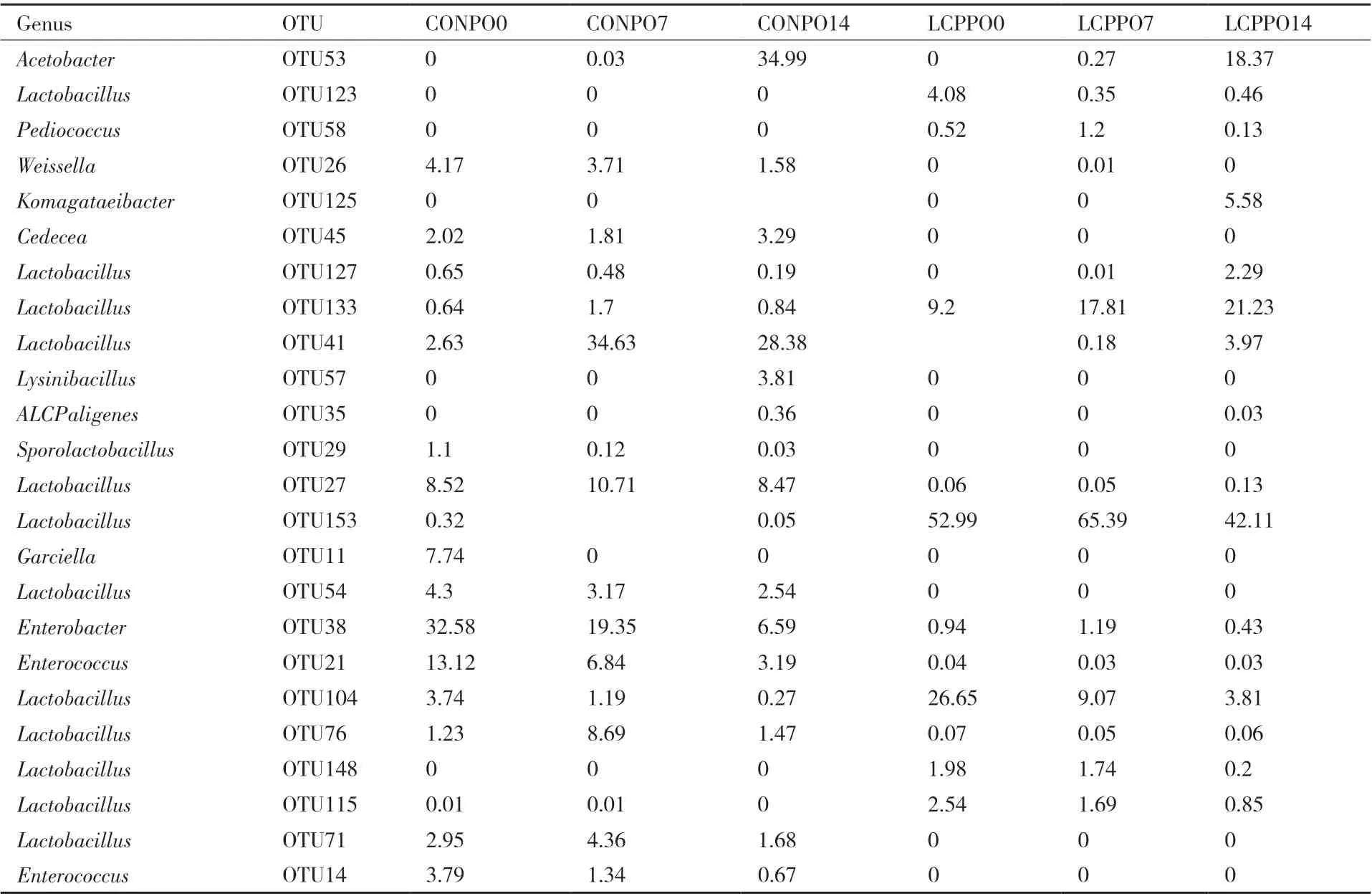
表3 青贮苜蓿有氧暴露各时段OTU组成Table 3 OTU composition of the silage alfalfa in different exposure time and treatments(>1%)
2.2.3.3 种水平上青贮苜蓿细菌动态变化 在种水平上(图6),CON组,有氧暴露0 d、7 d、14 d嗜酸乳杆菌(L. acidipiscis)的丰度分别是2.57%、34.21%、28.26%,未鉴定肠杆菌属(unidentified_g_Enterobacter)丰度分别是32.37%、19.10%、6.58%。短乳杆菌(L. brevis)丰度分别是8.58%、10.60%、8.48%。Enterococcus mundtii丰 度 分 别 是13.08%、6.81%、3.17%。棒状乳杆菌(L. coryniformis)分别 是2.98%、4.30%、1.65%。未 鉴 定 魏 氏 菌 属(unidentified_g_Weissella)分 别 是5.01%、3.81%、1.58%。Garciella(7.82%)在暴露前存在,暴露后消失。最显著的是,Acetobacter cereviseae在有氧暴露14 d时丰度为34.70%。LCP组有氧暴露后,干酪乳杆菌(L. casei)丰度先升高后降低,在有氧暴露0 d、7 d、14 d丰度分别是52.26%、65.12%、41.59%,布氏乳杆菌(L. buchneri)丰度逐渐升高,丰度分别是9.02%、17.79%、21.14%。L. reuteri丰度逐渐降低,丰度分别是26.24%、8.97%、3.81%。
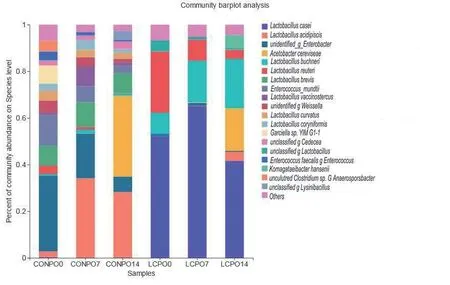
图6 种水平上青贮苜蓿有氧暴露各阶段菌群组成Fig. 6 Composition of bacterial community in the silage alfalfa at different stages of aerobic exposure at species level
2.2.3.4 青贮苜蓿菌群差异物种分析 LEfSe 分析(Kruskal-Wallis H test,P< 0.05,LAD> 4.0)显示了在组间丰度显著差异的物种(图7)。结果显示,有2个门、4个纲、6个目、7个科、9个属在组间丰度差异显著。在CONPO0组中显著富集的物种有梭菌纲(Clostridia)、γ-变形菌纲(Gammaproteobacteria)、梭菌目(Clostridiales)、肠杆菌目(Enterobacteriales)、毛螺旋菌科(Lachnospiraceae)、肠球菌科(Enterococcaceae)、明串珠菌科(Leuconostocaceae)、肠杆菌科(Enterobacteriaceae)、肠球菌属(Enterococcus)、魏氏 菌属(Weissella)、肠 杆菌属(Enterobacter)。在CONPO14组中显著富集的有芽胞杆菌目(Bacillales)、大洋芽胞杆菌属(Oceanobacillus)、变形菌门(Proteobacteria)、西地西菌属(Cedecea)、a-变形菌门(alphaproteobacteria)、醋杆菌目(Acetobacterales)、醋杆菌科(Acetobacteraceae)、醋杆菌属(Acetobacter)、棒状杆菌目(Corynebacteriales)、棒状杆菌科(Corynebacteriaceae)、棒杆菌属(Corynebacterium_1)。在LCPPO7中显著富集的物种有杆菌纲(Bacilli)、乳杆菌目(Lactobacillales)、乳杆菌科(Lactobacillaceae)。LCPPO0中显著富集的物种有乳杆菌属(Lactobacillus)、食酸菌属(Acidovorax)。
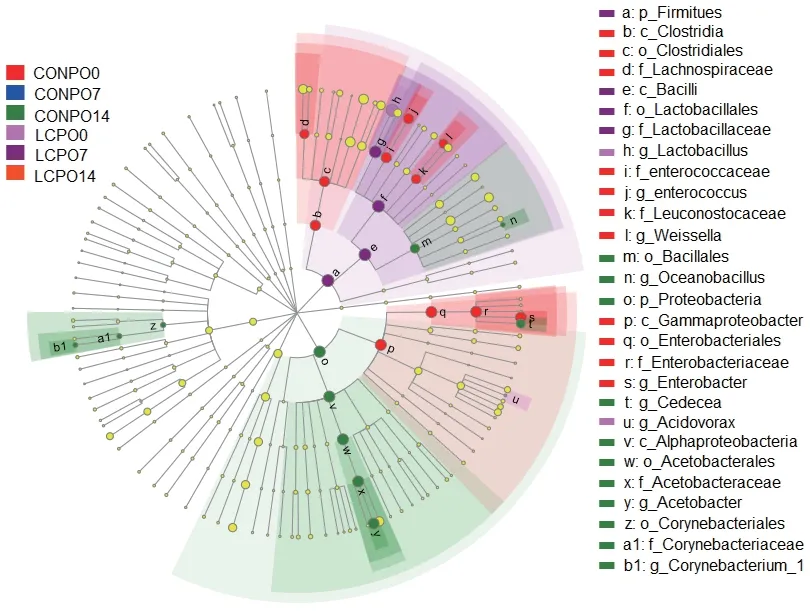
图7 LEfSe分析青贮苜蓿组间丰度差异显著的物种(LAD>4.0)Fig. 7 LEfSe analysis of the bacteria taxon with significant difference between treatments(LAD>4.0)
2.2.3.5 菌群与青贮特性(环境)因子关联性分析环境因子热图(图8)显示,有氧暴露青贮苜蓿环境样本细菌群落组成与青贮品质环境因子之间的相关性。乳杆菌属与pH呈负相关(P<0.05),与乳酸和乙酸未呈现相关性。肠杆菌属、肠球菌属、魏氏菌 属、Cedecea、Sporolactobacillus与pH呈 正 相 关(P<0.05)。醋杆菌属与乳酸和乙酸负相关(P<0.05)。
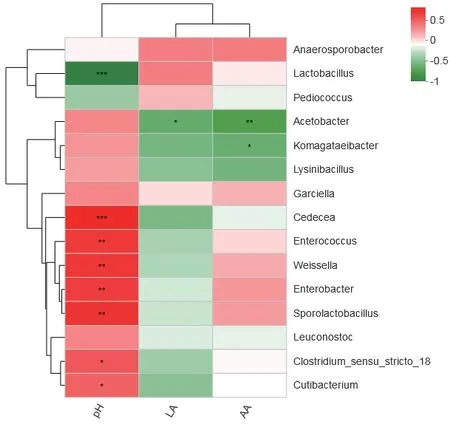
图8 青贮细菌菌群与青贮品质关联性热图分析Fig. 8 Heatmap analysis of correlation between silage quality and bacterial community
3 讨论
3.1 青贮品质
本试验经56 d的青贮,副干酪乳杆菌能够提高高水分苜蓿青贮发酵品质。Liu等[11]研究也显示植物乳杆菌和布氏乳杆菌显著降低高水分苜蓿青贮饲料的pH,提高了饲料乳酸产量。有氧暴露显示了青贮饲料pH的显著升高,Zhang等[12]对有氧暴露青贮苜蓿pH变化与本研究相似的趋势,有氧暴露5 d后,未接种乳酸菌青贮苜蓿pH上升较大,而接种剂的pH仅有微量上升。说明干酪乳杆菌接种剂对维持青贮饲料有氧稳定性有一定的积极作用。有氧暴露后,未接种的青贮苜蓿乳酸菌数量降低明显,而酵母及霉菌的数量增加,这与Tao等[13]研究结果一致和关于高水分青贮苜蓿的研究结果一致[11]。
3.2 细菌菌群多样性演替规律
近年来,青贮微生物菌群结构经历了一个连续性的变化过程,可通过高通量二代和单分子三代测序(SMRT)来揭示青贮发酵微生物多样性的演替规律[6,14]。本研究在有氧暴露7 d和 14 d的过程中,乳杆菌属占有很大的优势。Li等[14]对青贮苜蓿进行有氧暴露实验,使用变性梯度凝胶电泳方法研究其菌群变化,发现接种乳酸菌在有氧暴露7 d后乳杆菌属的电泳条带浓度依然明显,这与本研究高通量测序结果较为相似。未接种青贮苜蓿乳杆菌属丰度呈现了先上升后下降的趋势,而接种副干酪乳杆菌青贮苜蓿乳杆菌属在有氧暴露7 d仍然保持了稳定,直到14 d才有所下降。而从菌种组成来说,未接种青贮有氧暴露维持了较多的菌种组成,主要由乳杆菌属、肠杆菌属、肠球菌属组成;而接种处理菌群结构单一,主要以乳杆菌属为主,研究表明乳酸菌在青贮饲料中发挥着无可替代的作用[15-16]。但长时间有氧暴露(>14 d),接种副干酪乳杆菌青贮苜蓿醋杆菌属也大量繁殖。醋杆菌属是一种醋酸菌,这种菌群也是青贮有氧腐败的起始菌群之一,但通常在青贮玉米及禾本科牧草中发现[17],本研究首次发现醋酸菌在有氧暴露的青贮苜蓿中大量存在。在氧气暴露的青贮饲料中,醋酸菌可以将乙醇转化为乙酸,造成乙酸产量的增加,但醋杆菌属的种类可以进一步将乙酸氧化成二氧化碳和水,又造成了乙酸含量的降低[18]。醋杆菌属还能氧化乳酸成二氧化碳和水,造成乳酸含的降低,因此,醋杆菌属大量存在必然会降低青贮饲料的品质[19]。本研究关联性分析显示醋杆菌属与乳酸和乙酸负相关,这表明醋杆菌属在有氧暴露的青贮苜蓿中发挥了负面作用,醋杆菌属将乳酸和乙酸氧化成二氧化碳和水,从而造成乳酸和乙酸的减少。
4 结论
本研究首次发现醋杆菌属在有氧暴露的青贮苜蓿中大量存在,降低乳酸和乙酸的含量,恶化青贮饲料品质。接种副干酪乳杆菌提高了有氧暴露青贮苜蓿乳杆菌属的丰度,降低了长期(14 d)有氧暴露醋杆菌属的丰度。因此,青贮苜蓿接种副干酪乳杆菌可提高短期有氧暴露青贮发酵品质,提高其有氧稳定性,减缓有氧变质。
