苜蓿青贮中乳酸降解菌的分离、鉴定及降解性能研究
2021-11-06崔欣雨李荣荣蔡瑞王妍郑猛虎徐春城
崔欣雨 李荣荣 蔡瑞 王妍 郑猛虎 徐春城
(中国农业大学工学院,北京 100083)
苜蓿(Medicago sativa L.)是多年生豆科牧草,含有丰富的维生素和矿物质等营养成分,是当今世界上分布最广、栽培面积最大的牧草[1]。为实现长期保藏和全年均衡供应,常将苜蓿制作成干草,然而在我国苜蓿种植地带收割时伴随有雨热同期现象,苜蓿干草的制作过程中存在落叶与雨淋损失,实践生产发现高水分青贮是解决上述问题的理想措施。青贮依靠乳酸菌等有益菌迅速将青绿饲草中的可溶性碳水化合物转化为有机酸,使青贮饲料pH值下降,从而有效地抑制了有害微生物对营养成分的分解,其中乳酸是最主要的有机酸[2-3]。乳酸(C3H6O3)含羟基,酸度(pK=3.1)远高于挥发性脂肪酸(volatile fatty acid,VFA)酸度(pK=4.8),能够产生酸香气味,适量的乳酸可以刺激家畜食欲并显著提高适口性,且能通过破坏细菌的细胞壁增加细胞膜通透性导致内容物流出,从而达到杀菌效果[4-6]。因此,乳酸对改善饲草青贮的风味和维持青贮过程中微生物群落结构的平衡具有重要作用。
乳酸不易挥发,应随着青贮过程不断积累,然而在一些饲草青贮研究中出现了乳酸含量下降的现象[7-9]。Muck等[10]提出,随着干物质的损失,其他微生物的活动会造成已生成乳酸的降解与转化。Lindgren等[11]也发现,当可溶性碳水化合物含量较低或不足时,部分微生物会将乳酸代谢成其他有机产物。这类能够利用乳酸作为碳源或者电子受体的微生物称为乳酸降解菌,又叫乳酸利用菌,其体内具有NAD-非依赖型乳酸脱氢酶(NAD-independent lactate dehydrogenases,iLDH)和乳酸氧化酶(lactate oxidase,LOX)等能代谢乳酸的酶[12]。乳酸氧化生成丙酮酸时所产生的电子通过电子传递链进行氧化磷酸化能够产生为微生物供给能量的ATP,这一途径同时存在于部分原核微生物和真核微生物中。
有研究表明当青贮原料中混入土壤、施用有机肥料或酸化缓慢时,表面附着的肠杆菌属、梭菌属、芽胞杆菌属和酵母中的一些乳酸降解菌就能发挥作用,其不仅能分解乳酸影响发酵品质,有些还能在开封后代谢乳酸散发出大量热量导致青贮料温度上升,造成饲料变质从而对动物健康产生不利影响[13-14]。尽管人们已对青贮中乳酸降解的危害有一定认识,但是针对青贮中乳酸降解菌的研究较少。通过探究青贮中乳酸降解菌的降解性能和环境因子的耐受性,能够更加全面地认识青贮这一复杂的过程,从而提升苜蓿青贮的品质。
1 材料与方法
1.1 材料
1.1.1 苜蓿 来源于北京市农林科学院国家精准农业示范基地(北京市昌平区),品种分别为Khan、Meizoo和Central,于2020年9月22日刈割第三茬初花期苜蓿,留茬高度5 cm。
1.1.2 培养基 培养基的配制和乳酸降解菌的分离、纯化方法参考栗连会[15]。
乳酸钠分离培养基(g/L):乳酸钠20.0,酵母膏5.0,硫酸铵5.0,磷酸二氢钾0.3,磷酸氢二钾1.0,七水合硫酸镁0.3,琼脂粉20.0,pH值 6.8±0.2;
乳酸钠发酵培养基(g/L):乳酸钠20.0,酵母膏5.0,蛋白胨5.0,硫酸铵5.0,磷酸二氢钾0.3,磷酸氢二钾1.0,氯化钠0.5,七水合硫酸镁0.5,pH值 6.8±0.2。
生理生化培养基:西蒙氏枸橼盐培养基、乳糖发酵培养基、蛋白胨水、葡萄糖发酵管和蔗糖发酵管均购置于青岛高科技工业园海博生物技术有限公司。
1.2 方法
1.2.1 青贮调制 将刈割后的苜蓿迅速带回实验室用铡刀切短至1-2 cm,充分混匀后装入青贮专用聚乙烯袋,每袋约300 g,用真空包装机抽真空、封口后于室温条件下避光贮藏。
1.2.2 测定指标及方法 分别于3、7、14、21、28和56 d开封,充分混匀并准确称取10 g样品放入灭菌后的聚乙烯袋中,加入90 mL蒸馏水充分混合,均质器处理60 s后先用4层纱布过滤,再用定性滤纸过滤得到浸提液,每个处理重复3次。用pH计测定浸提液pH值;采用高效液相色谱法测定乳酸(lactic acid,LA)、乙 酸(acetic acid,AA)、丙 酸(propanoic acid,PA)和丁酸(butyric acid,BA)浓度[16]。
1.2.3 乳酸降解菌的分离和保存 称取开封后的苜蓿青贮样品10 g置于90 mL无菌生理盐水中,充分震荡后制作成10-1、10-2、10-3、10-4和10-5系列梯度的稀释液,吸取10-1、10-3和10-5稀释液至乳酸分离培养基上,用灭菌的涂布棒轻轻涂开,倒置于厌氧培养箱37℃培养72 h,每组重复3次。用接种环挑选单菌落,在乳酸分离培养基上划线并置于37℃厌氧培养48 h,重复至出现单菌落。将纯化后的单菌落接种到乳酸钠发酵培养基中培养24 h,将能使培养基变浑浊的菌株进行甘油保藏,按照分离的时间和顺序进行编号。
1.2.4 乳酸降解率的测定 采用磷酸缓冲溶液调整乳酸钠发酵培养基pH值至6.2,将挑选出的乳酸降解菌株按照105CFU/mL的接种量接种到培养基中,在30℃下厌氧培养120 h,采用对羟基联苯比色法[17]测定发酵液发酵前后乳酸含量,并计算乳酸降解率:

1.2.5 乳酸降解菌株的鉴定 进行菌落形态的观察,并采用增强革兰氏染色液(上海源叶生物科技有限公司)进行革兰氏染色观察,再利用生理生化鉴定管(青岛高科技工业园海博生物技术有限公司)进行糖发酵试验和IMViC试验(包括吲哚实验、甲基红试验、乙酰甲基甲醇试验和柠檬酸盐利用试验),参照《常见细菌系统鉴定手册》对菌株进行生理生化特征分析。采用细菌基因组DNA提取试剂盒(北京索莱宝科技有限公司)提取细菌DNA并作为模板,引物为正向引物:27F(5'-AGAGTTTGATCCTGGCTCAG-3')及反向引物:1492R(5'-GGTTACCTTGTTACGACTT-3'),PCR反应体系和PCR反应过程参考白文华[18]的方法,PCR产物长度约为1 400 bp。将扩增成功的PCR 产物送北京博迈德生物技术有限公司进行测序,获得的待测菌株序列利用BLAST(Basic Local Alignment Search Tool)工具与GenBank中的标准菌株进行对比,并用Mega 7.0软件构建系统进化树。
1.2.6 乳酸降解菌的降解性能 菌液密度(OD600)采用比浊法测定;采用2,4-二硝基苯肼比色法测定NAD-非依赖型乳酸脱氢酶和乳酸氧化酶的活性[19-20]。采用岛津气相色谱仪检测酸类代谢产物(条件:色谱柱30 m×0.25 mm×0.25 μm的RTX-WAX,检测器为FID)[21]。
1.2.7 生长耐受性实验 采用单因素试验研究温度(20、25、30和35℃)、pH值(4.5、5.0、5.5、6.0、6.5和7.0)、乳酸钠浓度(10、20、30 和40 g/L)和葡萄糖浓度(10、20和30 g/L)对菌株降解乳酸能力的影响,接种量为106CFU/mL,厌氧培养120 h后计算乳酸降解率。
1.2.8 数据处理 采用SPSS 23.0软件、Microsoft Excel 2016软件对数据进行处理和分析,P<0.05代表数据存在显著性差异;采用Origin 2021b软件作图。
2 结果
2.1 苜蓿青贮过程中发酵品质的变化
3个品种苜蓿的青贮pH值随着贮藏时间的延长显著下降(P<0.05),且前3 d下降速度最快并均降至6.1左右。Khan和Meizoo的青贮pH值分别在3-7 d和7-14 d出现回升,而Central的青贮pH值在青贮过程中持续下降(图1)。

图1 苜蓿青贮过程pH值的动态变化Fig.1 Dynamic changes of pH during alfalfa silage
乳酸、乙酸、丙酸均在青贮的前7 d快速积累,乙酸的含量最高,丙酸含量低于乙酸和乳酸,丁酸含量在前28 d均在检出线以下。青贮7 d后3个品种的乳酸含量随着时间延长无显著变化(P>0.05),Khan的乳酸含量在14 d达到最高值后不断下降,Meizoo和Central的乳酸含量在7 d后先减少后增加。3个品种的乙酸含量没有显著差异(P>0.05)且均呈现缓慢增加的状态,其中Khan的乙酸含量最高,在发酵结束后达到23.05 g/kg DM(表1)。

表1 苜蓿青贮过程中有机酸含量的动态变化Table 1 Dynamic changes of organic acids content during alfalfa silage
2.2 乳酸降解菌株的筛选及鉴定
2.2.1 乳酸降解菌的筛选 青贮过程中共分离得到75株乳酸降解菌,根据分离时间将其编号为RSF1-RSF31(0 d-7 d)、RSM1-RSM20(14 d-21 d)、RSH1-RSH24(28 d-56 d)。依据纯化菌落的颜色、形态、革兰氏染色试验、糖发酵试验及IMViC试验将75株菌进行分组(表2)。

表2 乳酸降解菌的分组情况Table 2 Grouping of lactic acid degrading bacteria
从A-U组中各选出一株代表菌株,依次测定乳酸降解率,降解率最高的RSM9达到44.64%,最低的RSF24只有10.22%。其中RSM9、RSF15、RSH16和RSF2的降解率分别为44.64%、33.86%、33.35%和30.64%,均超过30%(图2)。

图2 各组代表性菌株的乳酸降解率Fig.2 Degradation rate of lactic acid by representative strains in each group
2.2.2 乳酸降解菌的形态特征 4株菌的菌落颜色、形态等存在差异,但均能在LB培养基中生长繁殖,且均为革兰氏阴性菌(图3)。其中RSM9在分离培养基中呈白色不透明的圆形菌落,表面凸起,边缘整齐,具有一定的黏性;RSF15菌落为扁平的黄色同心圆菌落,边缘整齐且没有黏性;RSF2菌落为白色不透明圆形,菌落凸起,边缘整齐,具有黏性;RSH16为较小的白色圆形菌落,表面凸起且湿润,边缘整齐,具有一定的黏性。
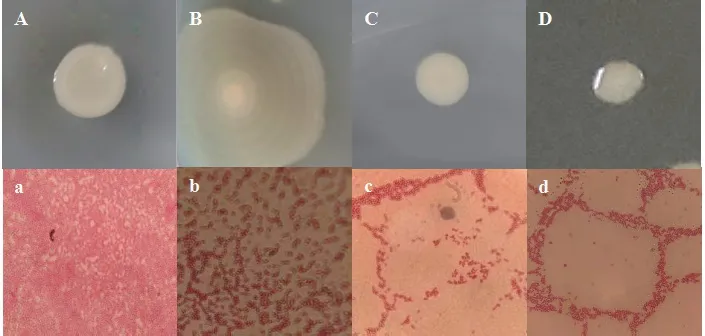
图3 菌株菌落形态及革兰氏染色结果Fig.3 Colony morphology and Gram staining of each strain
2.2.3 乳酸降解菌的系统发育树 RSM9、RSF15、RSF2和RSH16的片段长度 分 别为1 409、1 375、1 410和1 403 bp,将 其 序 列 与Genbank中 的 模式菌株相关序列进行比对,选择与其序列相似度>99%的菌种进行亲缘关系的比较并制作系统发育 树(图4)。其 中 菌 株RSM9、RSF15、RSF2和RSH16分 别 与Hafnia paralvei、Proteus columbae、Obesumbacterium proteus和Citrobacter cronae构 成同一进化分支,bootstrap值均大于90%。结合生理生化试验确定RSM9为哈夫尼菌(Hafnia sp.),RSF15属于变形菌(Proteus sp.),RSF2属于肥杆菌(Obesumbacterium sp.),RSH16为 柠 檬 酸 杆 菌(Citrobacter sp.)。四者的GenBank登录号依次为MW 793477、MW 793478、MW 793479和MW 793480。
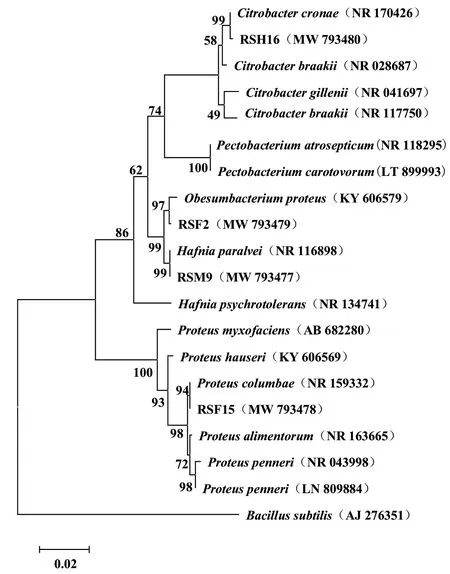
图4 4株乳酸降解菌株的系统发育树Fig.4 Phylogenetic tree of 4 lactic acid degrading strains
2.3 乳酸降解菌代谢特征
厌氧培养120 h后RSM9菌株的OD600达到0.989,生长情况最好。接种4种菌的发酵液的pH值均增加,其中RSM9组的pH值最大为6.76。RSM9、RSF15和RSF2菌株能够分泌NAD-非依赖型乳酸脱氢酶和乳酸氧化酶,而RSH16菌株没有测定到乳酸氧化酶活性。4株菌的酸类代谢产物主要是乙酸和丙酸,只有RSM9能代谢产生丁酸,根据测定结果计算4株菌的酸类代谢产物大约占降解物总量的15%-40%(表3)。

表3 4株乳酸降解菌的代谢特征Table 3 Metabolic characteristics of 4 strains of lactic acid degrading bacteria
2.4 环境因子对乳酸降解菌降解乳酸的影响
2.4.1 培养温度 4株菌温度适应性强,其中RSM9在各温度段乳酸降解率均较高,在35℃环境下降解率达到41.81%、RSF15、RSF2和RSH16在20℃降解率最高,分别为21.90%、23.67%和21.21%,当温度大于25℃时,温度的增加会提高乳酸降解率。(图5-A)。
2.4.2 pH值 在弱酸性环境下4株菌的乳酸降解能力要好于中性环境,当pH值降至5.0以下时不利于乳酸降解菌的代谢。其中菌株RSM9在pH≥6.0时表现出良好的乳酸降解能力,乳酸降解率高于其他3株菌,RSF15和RSF2在pH值为5.5时乳酸降解率最大分别为25.51%和21.15%,pH值在5.5-7.0时RSH16的乳酸降解率受pH值变化影响较小(图5-B)。
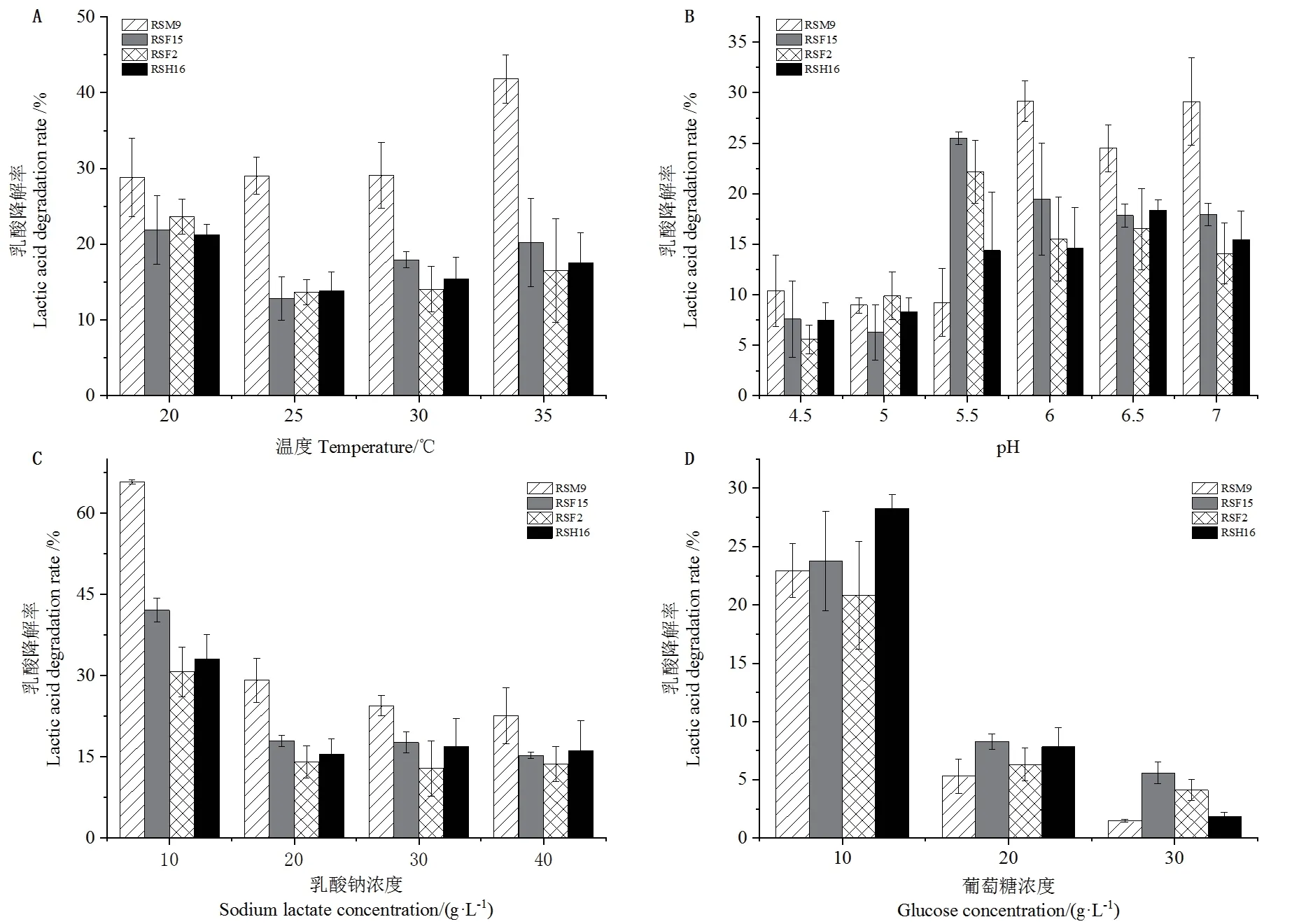
图5 环境因子对菌株乳酸降解率的影响Fig.5 Effects of environmental factors on the degradation rate of lactic acid
2.4.3 乳酸钠浓度 总体上乳酸降解率随着乳酸浓度的增加而降低,当乳酸钠浓度为10 g/L时4株菌的乳酸降解率最高,RSM9最高达到65.76%,其他3株菌的乳酸降解率均在30%以上。4株乳酸降解菌均能够耐受40 g/L的乳酸,在其中表现最好的是RSM9,RSF2的降解率最低仅为13.66%(图5-C)。2.4.4 葡萄糖浓度 在培养基中添加葡萄糖后的结果如图5-D所示。当添加10 g/L葡萄糖时4株菌的乳酸降解率最高分别为22.95%、23.75%、20.81%和28.29%。随着葡萄糖浓度的增加乳酸降解率降低,当葡萄糖浓度增加到30 g/L以上时,乳酸降解菌几乎不再降解乳酸。
3 讨论
本研究采用3个品种的苜蓿进行青贮试验,苜蓿较高的缓冲能和较低的含糖量导致三者经过56 d发酵后pH值均未达到理想水平[22-23]。在青贮的前7 d,由于新鲜苜蓿原料在切碎密封后仍有少量氧气存在,且初始pH较高,对微生物的抑制效果差,从而附着在原料上的乳酸菌与其他微生物竞争糖类底物进行生长代谢,使得原料所含有的可溶性碳水化合物被迅速消耗并转化成有机酸,造成青贮前期乳酸、乙酸和丙酸的快速积累。然而随着贮藏时间进一步的延长出现乳酸缓慢减少的现象,Khan和Meizoo品种的青贮pH值甚至回升,这与Tao等[24]单独青贮苜蓿的结果相一致。
青贮过程中有机酸含量处于动态变化中,其中乳酸、乙酸、丙酸和丁酸是青贮中重要的有机酸。乳酸是一种不易挥发的有机酸,不会随着开封逸出,因此其减少的主要原因是乳酸的生成量低于降解量。乳酸在7-14 d达到最大值的同时可溶性碳水化合物含量处于较低水平,此时乳酸降解菌开始利用乳酸进行代谢从而造成乳酸的消耗。本研究的结果表明4株菌的酸类代谢产物主要是乙酸,其次是丙酸和己酸。乳酸的羧基电离后产生的负离子可以与α位的羟基形成分子内氢键,从而使负离子稳定性更高,相比于乙酸等挥发性有机酸具有更强的酸性,故而乳酸降解后pH值会回升。除了酸类代谢产物外,有研究显示乳酸降解菌代谢产物还包括醛类、醇类和酯类等有机物[15]。
目前在酒醅、反刍动物的瘤胃液以及猪的肠道中均分离出部分乳酸降解菌,已报道能够降解乳酸的有丙酸杆菌属、脱硫弧菌属、固氮菌属、梭菌属、韦荣氏球菌属、巨球型菌属、芽胞杆菌属和真杆菌属等多个属的一些种,其中部分菌株能够很好地利用乳酸生长和繁殖[25-27]。与以往分离得到的菌属不同,本研究分离得到的菌株均属于兼性厌氧型肠杆菌科细菌,常见于土壤和动物肠道,其在青贮过程中降解乳酸的能力未被广泛报道。试验表明4株菌都具有NAD-非依赖型乳酸脱氢酶活力,可在厌氧环境下将乳酸氧化为丙酮酸,并进一步分解用于氧化磷酸化供给细胞能量[28]。而乳酸氧化酶是一种黄素蛋白酶,以黄素核苷酸作为辅因子,无需外加辅因子,但需要氧气参与才能完成乳酸代谢,当青贮料开封后此类微生物若大量繁殖或会引起有氧变质[29-30]。
夏光亮等[31]研究表明,生长环境的pH值、培养基底物类型、乳酸的浓度和构型等都对乳酸的降解有显著的影响。试验结果表明当葡萄糖浓度较高时乳酸降解率较低,这是由于微生物会优先消耗容易利用的速效碳源,微生物代谢糖类的过程会抑制乳酸向丙酮酸转化时乳酸脱氢酶的活性[32-33]。当乳酸钠浓度为10 g/L、pH值高于5.0时乳酸降解率较高,这与乳酸降解发生在苜蓿青贮的7-14 d时间点相吻合。4株菌的温度适应性强(20-35℃),乳酸降解能力受温度影响小,35℃下的降解能力要好于25℃和30℃,且RSM9在35℃时的乳酸降解率最高能达到41.81%。李荣荣等[34]研究发现,当贮藏温度为35℃时,随着发酵进行苜蓿青贮中乳酸含量显著降低,可能与这一温度下乳酸降解菌的代谢有关。
4 结论
从苜蓿青贮中分离获得4株能代谢乳酸的革兰氏阴性细菌RSM9、RSF15、RSF2和RSH16,经鉴定分别为哈夫尼菌(Hafnia sp.)、变形菌(Proteus sp.)、肥 杆 菌(Obesumbacterium sp.)和 柠 檬 酸 杆菌(Citrobacter sp.)。4株菌在乳酸钠发酵培养基中经30℃厌氧培养120 h后的乳酸降解率分别达到44.64%、33.86%、30.64%和33.35%,酸类代谢产物主要是乙酸和丙酸。这类微生物能够在可溶性碳水化合物含量显著减少、乳酸积累的苜蓿青贮的第7-14天发挥作用,通过代谢乳酸进行生长繁殖,造成青贮体系的pH回升。4株菌均为兼性厌氧型细菌,温度适应性强,但不耐酸,当pH<5.0时生长活性被抑制。
